
2_1-2_136
.doc
![]() ,
(4)
,
(4)
де - кількість молів речовини.
Кількість молів речовини визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (5)
, (5)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Кількість молів речовини з рівняння (5) підставляємо у вираз (4)
![]() ,
(6)
,
(6)
Молярні теплоємкості газу при ізобарному і ізохорному процесі пов’язані рівнянням Майора, з якого отримаємо:
![]() , (7)
, (7)
Теплоємності з виразів (6) та (7) підставляємо у формулу (1) і отримаємо вираз для розрахунку:
![]() = (8)
= (8)
Підставляємо дані умови в рівняння (8) та отримаємо відповідь:
![]() =
=
-
У посудині місткістю V = 6 л знаходиться при нормальних умовах двоатомний газ. Визначити теплоємність
 цього газу при
постійному об'ємі.
цього газу при
постійному об'ємі.
2.25.
Дано
V
= 6 л
![]() = 5
= 5![]() = 105 Па
= 105 Па![]() = 273 К
= 273 К
![]() = ?
= ?
Теплоємність речовини - це відношення кількості теплоти dQ, що поглинається нею у термодинамічному процесі, до зміни температури dT, що сталася за рахунок надання речовині цієї кількості теплоти:
![]() .
(1)
.
(1)
Питомою теплоємністю.
![]() ,
(2)
,
(2)
Молярною теплоємністю
![]() називають кількість теплоти, яка потрібна
для підвищення температури одного моля
речовини на 1 К.
називають кількість теплоти, яка потрібна
для підвищення температури одного моля
речовини на 1 К.
![]() ,
(3)
,
(3)
де - кількість молів речовини.
З рівняння (3) отримуємо
![]() ,
(4)
,
(4)
Кількість молів речовини визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (5)
, (5)
де
![]() =8,31 Дж/(моль•К) — універсальна газова
стала.
=8,31 Дж/(моль•К) — універсальна газова
стала.
Кількість молів речовини з рівняння (5) підставляємо у вираз (4)
![]() ,
(6)
,
(6)
Молярні теплоємкості газу при ізохорному процесі дорівнює:
![]() , (7)
, (7)
Теплоємність з виразів (7) підставляємо у формулу (6) і отримаємо вираз для розрахунку:
![]() = (8)
= (8)
Підставляємо дані умови в рівняння (8) та отримаємо відповідь:
![]() =
=
-
Визначити молярну масу
 газу, якщо
різниця його питомих теплоємкостей
газу, якщо
різниця його питомих теплоємкостей
 = 2,08 кДж/(кг
К).
= 2,08 кДж/(кг
К).
2.26.
Дано
![]() = 260 Дж/(кг∙К)
= 260 Дж/(кг∙К)
![]() = ?
= ?
Між питомою і молярною теплоємністю існує співвідношення:
![]() (1)
(1)
де
![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Молярні теплоємкості газу при ізобарному і ізохорному процесі пов’язані рівнянням Майора:
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Тоді питомі теплоємності пов’язані таким чином:
![]() . (3)
. (3)
З рівняння (3) визначаємо молярну масу:
![]() = (4)
= (4)
Підставляємо дані умови в рівняння (4) і отримаємо відповідь:
![]() =
=
2.27.
Визначити молярну теплоємність газу,
якщо
його питома теплоємність
![]() =
10,4 кДж/(кг
К)
і
=
10,4 кДж/(кг
К)
і
![]() =
14,6 кДж/(кг
К).
=
14,6 кДж/(кг
К).
2.27.
Дано
![]() = 10,4 кДж/(кг∙К)
= 10,4 кДж/(кг∙К)![]() = 14,6 кДж/(кг∙К)
= 14,6 кДж/(кг∙К)
![]() = ?
= ?
![]() = ?
= ?
Між питомою і молярною теплоємністю існує співвідношення:
![]() (1)
(1)
де
![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Молярні теплоємкості газу при ізобарному і ізохорному процесі пов’язані рівнянням Майора:
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Тоді питомі теплоємності пов’язані таким чином:
![]() . (3)
. (3)
З рівняння (3) визначаємо молярну масу газу:
![]() = (4)
= (4)
Тоді молярні теплоємності газу дорівнюватимуть
![]() = (5)
= (5)
![]() = (6)
= (6)
Підставляємо дані умови в рівняння (5) та (6) і отримаємо відповідь:
![]() =
=
![]() =
=
-
Обчислити питому теплоємність газу, знаючи, що його молярна маса
 =
4 10-3
кг/моль
і відношення
теплоємкостей
=
4 10-3
кг/моль
і відношення
теплоємкостей
 /
/ = 1,67.
= 1,67.
2.28.
Дано
![]() =
4 10-3
кг/моль
=
4 10-3
кг/моль![]() /
/
![]() = 1,67
= 1,67
![]() = ?
= ?
![]() = ?
= ?
Між питомою і молярною теплоємністю існує співвідношення:
![]() (1)
(1)
де
![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Відношення молярних теплоємкостей газу при ізобарному і ізохорному процесі дорівнює
 . (2)
. (2)
Тоді
![]() для даного газу дорівнює
для даного газу дорівнює
![]() . (3)
. (3)
З рівняння (1) з урахуванням (3) визначаємо питомі теплоємності:
 (4)
(4)
Підставляємо дані умови в рівняння (5) та (6) і отримаємо відповідь:
![]() =
=
![]() =
=
-
Трьохатомний газ під тиском
 =
240 кПа і температурі t
= 20°С займає
об'єм
V
= 10 л. Визначити теплоємність
=
240 кПа і температурі t
= 20°С займає
об'єм
V
= 10 л. Визначити теплоємність
 цього газу при
постійному тиску.
цього газу при
постійному тиску.
2.29.
Дано
t
= 20°С V
= 10 л
![]() = 6
= 6![]() =
240 кПа
=
240 кПа
![]() = ?
= ?
Теплоємність речовини - це відношення кількості теплоти dQ, що поглинається нею у термодинамічному процесі, до зміни температури dT, що сталася за рахунок надання речовині цієї кількості теплоти:
![]() .
(1)
.
(1)
Молярна теплоємність при сталому тиску дорівнює
![]() .
(2)
.
(2)
Кількість молів речовини визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (3)
, (3)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Підставляємо кількість молів газу з (3) та молярну теплоємність з (2) в рівняння (1) і отримаємо вираз для розрахунку відповіді:
![]() = (4)
= (4)
Дані умови задачі підставляємо у формулу (4) і отримаємо відповідь:
![]() =
=
-
Одноатомний газ при нормальних умовах займає об'єм V = 5 л. Обчислити теплоємність Cv цього газу при постійному об'ємі.
2.30.
Дано
V
= 5 л
![]() = 3
= 3![]() = 105 Па
= 105 Па![]() = 273 К
= 273 К
![]() = ?
= ?
Теплоємність речовини - це відношення кількості теплоти dQ, що поглинається нею у термодинамічному процесі, до зміни температури dT, що сталася за рахунок надання речовині цієї кількості теплоти:
![]() .
(1)
.
(1)
Молярна теплоємність при сталому об’ємові дорівнює
![]() .
(2)
.
(2)
Кількість молів речовини визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (3)
, (3)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Підставляємо кількість молів газу з (3) і молярну теплоємність з виразу (2) у вираз (1) та отримаємо розрахункову формулу:
![]() = (4)
= (4)
Дані умови задачі підставляємо у формулу (4) і отримаємо відповідь:
![]() =
=
-
Знайти середнє число зіткнень за час t = 1 с і довжину вільного пробігу молекули гелію, якщо газ знаходиться під тиском
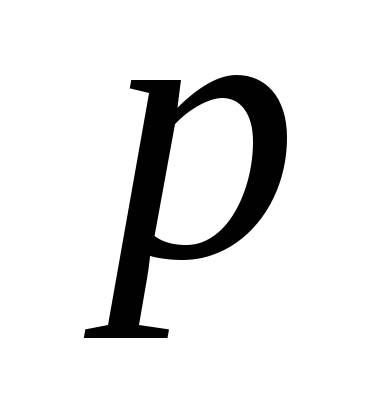 =
2 кПа при
температурі Т
= 200 К.
=
2 кПа при
температурі Т
= 200 К.
2.31.
Дано
t
= 1 с Т
= 200 К
![]() =
2 кПа
=
2 кПа
![]() = ?
= ?
![]() = ?
= ?
Середня кількість зіткнень однієї молекули за одиницю часу
![]() . (1)
. (1)
Середня довжина вільного пробігу молекул газу
![]() , (2)
, (2)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() = 1,9∙10-10
м — ефективний діаметр молекули гелію.
= 1,9∙10-10
м — ефективний діаметр молекули гелію.
Середня арифметична швидкості молекул визначається формулою:
![]() ,
(3)
,
(3)
де
![]() =
4 10-3
кг/моль
– молярна маса гелію.
=
4 10-3
кг/моль
– молярна маса гелію.
Концентрацію молекул газу визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (4)
, (4)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала;
= 8,31 Дж/(моль•К) — універсальна газова
стала;
![]() = 6,02∙1023 моль-1 – число
Авогадро.
= 6,02∙1023 моль-1 – число
Авогадро.
Концентрацію молекул газу з виразу (4) підставляємо в вираз (1) і отримаємо середню довжину вільного пробігу його молекул:
![]() , (5)
, (5)
Концентрацію молекул газу з виразу (4) та швидкість з виразу (3) підставляємо в вираз (2) і отримаємо середню кількість зіткнень однієї молекули за одиницю часу:
![]() . (6)
. (6)
Дані умови задачі підставляємо у формули (6) та (5) і отримаємо відповідь:
![]() =
=
![]() =
=
-
Визначити середню довжину вільного пробігу молекули азоту в посудині місткістю V = 5 л. Маса газу m = 0,5 г.
2.32.
Дано
V
=
5 л m
=
0,5 г d
=
3∙10-10
м
![]() = 28 г/моль
= 28 г/моль
![]() = ?
= ?
Середня довжина вільного пробігу молекул газу дорівнює
![]() , (1)
, (1)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() — ефективний діаметр молекули газу.
— ефективний діаметр молекули газу.
Концентрацію молекул газу визначимо з рівняння:
![]() , (2)
, (2)
де
![]() = 6,02∙1023 моль-1 – число
Авогадро;
= 6,02∙1023 моль-1 – число
Авогадро;
![]() - кількість молів газу;
- кількість молів газу;
![]() - кількість молекул цього газу.
- кількість молекул цього газу.
Підставляємо концентрацію молекул газу з (2) у формулу (1) і отримуємо розрахунковий вираз:
![]() = (3)
= (3)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (3) і отримаємо відповідь:
![]() =
=
-
При нормальних умовах довжина вільного пробігу молекули водню дорівнює
 = 0,160
мкм.
Визначити діаметр молекули водню.
= 0,160
мкм.
Визначити діаметр молекули водню.
2.33.
Дано
d
= ?
![]() = 105 Па
= 105 Па![]() = 273 К
= 273 К![]() = 0,160 мкм
= 0,160 мкм![]() = 2 г/моль
= 2 г/моль
Середня довжина вільного пробігу молекул газу дорівнює
![]() , (1)
, (1)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() — ефективний діаметр молекули газу.
— ефективний діаметр молекули газу.
Звідки отримаємо
![]() . (2)
. (2)
Концентрацію молекул газу визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (3)
, (3)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала;
= 8,31 Дж/(моль•К) — універсальна газова
стала;
![]() = 6,02∙1023 моль-1 – число
Авогадро.
= 6,02∙1023 моль-1 – число
Авогадро.
Підставляємо концентрацію молекул газу з (3) у формулу (2) і отримуємо розрахунковий вираз:
![]() = (4)
= (4)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (4) і отримаємо відповідь:
![]() =
=
-
Кисень знаходиться під тиском
 =
133 нПа при
температурі Т
= 200 К. Обчислити середнє число зіткнень
молекул кисню при
цих умовах за одну секунду.
=
133 нПа при
температурі Т
= 200 К. Обчислити середнє число зіткнень
молекул кисню при
цих умовах за одну секунду.
2.34.
Дано
t
= 1 с Т
= 200 К
![]() =
133 нПа
=
133 нПа![]() = 2,7∙10-10 м
= 2,7∙10-10 м![]() = 32 г/моль
= 32 г/моль
![]() = ?
= ?
![]() = ?
= ?
Середня кількість зіткнень однієї молекули за одиницю часу
![]() . (1)
. (1)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() — ефективний діаметр молекули газу.
— ефективний діаметр молекули газу.
Середня арифметична швидкості молекул визначається формулою:
![]() .
(2)
.
(2)
Концентрацію молекул газу визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (3)
, (3)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала;
= 8,31 Дж/(моль•К) — універсальна газова
стала;
![]() = 6,02∙1023 моль-1 – число
Авогадро.
= 6,02∙1023 моль-1 – число
Авогадро.
Концентрацію молекул газу з виразу (3) та швидкість з виразу (2) підставляємо в вираз (1) і отримаємо середню кількість зіткнень однієї молекули за одиницю часу:
![]() . (4)
. (4)
Дані умови задачі (виражені в системі СІ) підставляємо у формулу (4) і отримаємо відповідь:
![]() =
=
-
При якому тиску середня довжина вільного пробігу молекул азоту дорівнює 1 м, якщо температура газу t = 10°С?
2.35.
Дано
t
= 10°С
![]() = 273 К
= 273 К![]() = 1 м
= 1 м![]() = 28 г/моль
= 28 г/моль
![]() = ?
= ?
Середня довжина вільного пробігу молекул газу дорівнює
![]() , (1)
, (1)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() — ефективний діаметр молекули газу.
— ефективний діаметр молекули газу.
Концентрацію молекул газу визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала;
= 8,31 Дж/(моль•К) — універсальна газова
стала;
![]() = 6,02∙1023 моль-1 – число
Авогадро.
= 6,02∙1023 моль-1 – число
Авогадро.
Підставляємо концентрацію молекул газу з (2) у формулу (1) і отримуємо
![]() , (3)
, (3)
Звідки отримуємо формулу для розрахунку шуканого тиску газу:
![]() = (4)
= (4)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (4) і отримаємо відповідь:
![]() =
=
-
У посудині місткістю V = 5 л знаходиться водень масою m = 0,5 г. Визначити середню довжину вільного пробігу молекул водню.
2.36.
Дано
V
= 5 л m
= 0,5 г
![]() = 2 г/моль
= 2 г/моль
![]() = ?
= ?
Середня довжина вільного пробігу молекул газу дорівнює
![]() , (1)
, (1)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() — ефективний діаметр молекули газу.
— ефективний діаметр молекули газу.
Концентрацію молекул газу визначимо з рівняння:
![]() , (2)
, (2)
де
![]() = 6,02∙1023 моль-1 – число
Авогадро;
= 6,02∙1023 моль-1 – число
Авогадро;
![]() - кількість молів газу;
- кількість молів газу;
![]() - кількість молекул цього газу.
- кількість молекул цього газу.
Підставляємо концентрацію молекул газу з (2) у формулу (1) і отримуємо
![]() , (3)
, (3)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (3) і отримаємо відповідь:
![]() =
=
-
Обчислити масу одного атома азоту.
2.37.
Дано
![]() = 14 г/моль
= 14 г/моль
![]() = ?
= ?
Молярна маса речовини визначається формулою:
![]() (кг/моль). (1)
(кг/моль). (1)
Звідки маса атому азоту дорівнюватиме
![]() = (2)
= (2)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (2) і отримаємо відповідь:
![]() =
=
-
Густина газу при тиску
 =
96 кПа
і температурі t
= 0°С дорівнює
=
96 кПа
і температурі t
= 0°С дорівнює
 = 1,35
г/л.
Найти молярну масу газу.
= 1,35
г/л.
Найти молярну масу газу.
2.38.
Дано
t
= 0°С
![]() =
96 кПа
=
96 кПа![]() = 1,35
г/л
= 1,35
г/л
![]() = ?
= ?
Молярну масу газу визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (1)
, (1)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (1) і отримаємо відповідь:
