
2_1-2_136
.doc
![]() . (5)
. (5)
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (2)
![]() . (7)
. (7)
Звідки отримаємо
 . (8)
. (8)
Після підстановки
виразу для
![]() з (6) у формулу (8) та даних умови задачі,
отримаємо відповідь
з (6) у формулу (8) та даних умови задачі,
отримаємо відповідь
![]() =
=
-
Об'єм V1 = 7,5 л кисню адіабатичним чином стискується до об'єму V2 = 1 л, причому у кінці стиснення встановився тиск
 =
1,6 МПа. Під яким тиском
=
1,6 МПа. Під яким тиском
 знаходився
газ до стиснення?
знаходився
газ до стиснення?
2.80.
Дано
V1
=
7,5 л V2
=
1 л V2
=
2V1
![]() =
1,6 МПа
=
1,6 МПа
![]() =
5
=
5
![]() = ?
= ?
Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
— показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
![]() , (4)
, (4)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Молярна теплоємність газу при ізобарному процесі (рівняння Майєра) визначається формулою:
![]() . (5)
. (5)
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (1)
![]() . (7)
. (7)
Звідки отримаємо
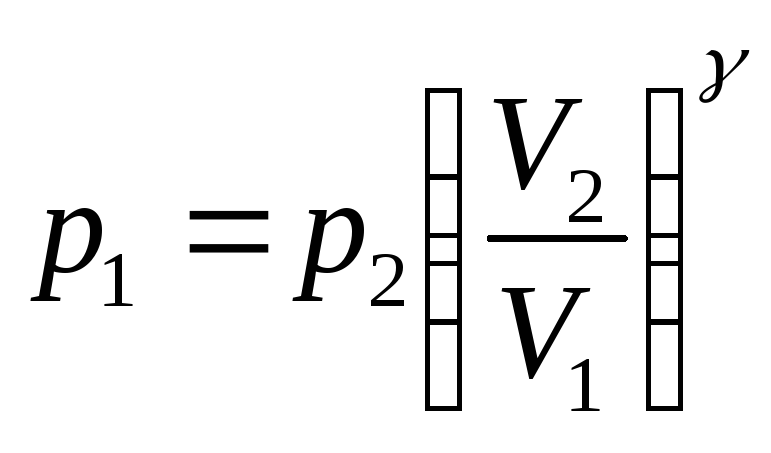 . (8)
. (8)
Після підстановки
виразу для
![]() з (6) у формулу (8) та даних умови задачі,
отримаємо відповідь
з (6) у формулу (8) та даних умови задачі,
отримаємо відповідь
![]() =
=
-
За умови адіабатичного стиснення повітря в циліндрах двигуна внутрішнього згорання тиск змінюється від
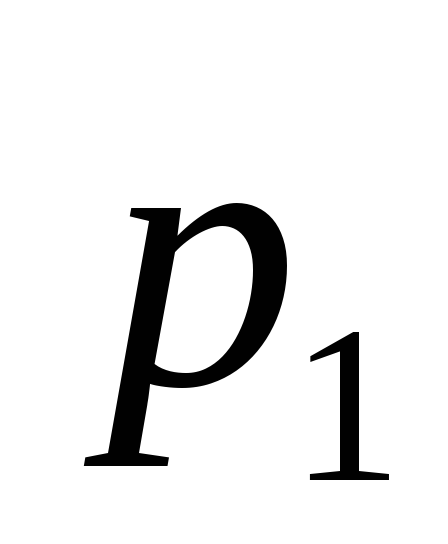 =
0,l МПа до
=
0,l МПа до
 =
3,5 МПа. Початкова температура повітря
t0
=
40°С. Знайти
температуру t
повітря у кінці стиснення.
=
3,5 МПа. Початкова температура повітря
t0
=
40°С. Знайти
температуру t
повітря у кінці стиснення.
2.81.
Дано
![]() =
0,l МПа
=
0,l МПа![]() =
3,5 МПа
=
3,5 МПа
![]() = t0
=
40°С
= t0
=
40°С![]() =
5
=
5
![]() = ?
= ?
Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
— показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
![]() , (4)
, (4)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Молярна теплоємність газу при ізобарному процесі (рівняння Майєра) визначається формулою:
![]() . (5)
. (5)
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (3)
![]() . (7)
. (7)
Звідки отримаємо
 . (8)
. (8)
Після підстановки
виразу для
![]() з (6) у формулу (8) та даних умови задачі,
отримаємо відповідь
з (6) у формулу (8) та даних умови задачі,
отримаємо відповідь
![]() =
=
-
Газ розширяється за законом адіабати, причому об'єм його збільшується вдвічі, а термодинамічна температура падає у 1,32 рази. Яке число ступенів свободи мають молекули цього газу?
Дано
![]() = 2,
= 2,
![]() = 1,32
= 1,32
![]() = ?
= ?
2.82.
Розв’язок.
Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
— показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
![]() , (4)
, (4)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Молярна теплоємність газу при ізобарному процесі (рівняння Майєра) визначається формулою:
![]() . (5)
. (5)
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (2)
![]() . (7)
. (7)
Звідки отримаємо
 . (8)
. (8)
Логарифмуємо вираз (8)
![]() . (9)
. (9)
З виразу (9) отримаємо
 . (10)
. (10)
Враховуючі вираз (6) отримаємо формулу для розрахунку:
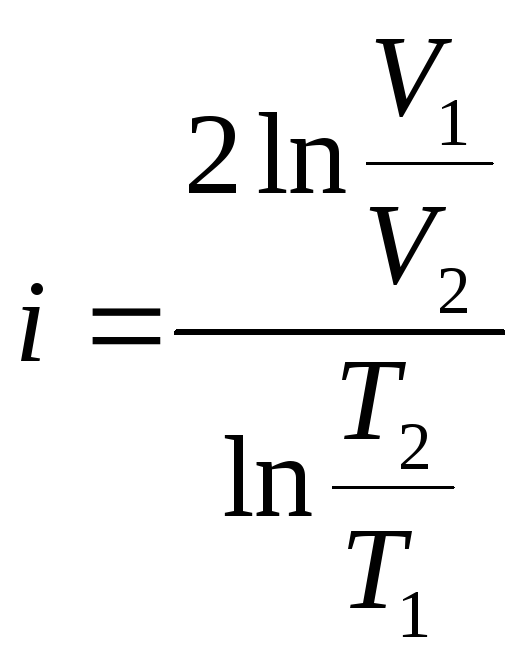 . (11)
. (11)
Після підстановки у формулу (11) даних умови задачі, отримаємо відповідь
![]() =
=
-
Двоатомний газ, що знаходиться під тиском
 0
= 2 МПа, з температурою t0
=
27°С, стискується за законом адіабати
від об'єму
V0
до V1
=
0,5V0.
Знайти
температуру t1
і тиск
0
= 2 МПа, з температурою t0
=
27°С, стискується за законом адіабати
від об'єму
V0
до V1
=
0,5V0.
Знайти
температуру t1
і тиск
 газу після
стиснення.
газу після
стиснення.
2.83.
Дано
t0
=
27°С V1
=
0,5V0
![]() 0
= 2 МПа
0
= 2 МПа![]() = 5
= 5
![]() = ?
= ?
![]() = ?
= ?
Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
— показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
![]() , (4)
, (4)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Молярна теплоємність газу при ізобарному процесі (рівняння Майєра) визначається формулою:
![]() . (5)
. (5)
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (2)
![]() . (7)
. (7)
Звідки отримаємо
 . (8)
. (8)
Розпишемо рівняння (1)
![]() . (9)
. (9)
Звідки отримаємо
 . (10)
. (10)
Після підстановки
виразу для
![]() з (6) у формули (8) і (10) та даних умови
задачі, отримаємо відповідь
з (6) у формули (8) і (10) та даних умови
задачі, отримаємо відповідь
![]() =
=
![]() =
=
-
У посудині під поршнем знаходиться гримучий газ, що займає при нормальних умовах об'єм V = 0,1 л. При швидкому стисненні газ запалюється. Знайти температуру Т запалення гримучого газу, якщо відомо, що робота стиснення А = 46,35 Дж.
2.84.
Дано
V
= 0,1
л А
= 46,35 Дж
![]() = 105 Па
= 105 Па![]() = 273 К
= 273 К![]() = 5
= 5
![]() = ?
= ?
Процес стиснення
газу можна вважати адіабатним, для якого
![]() =
=
![]() .
Тоді
.
Тоді
![]() . (1)
. (1)
Звідки отримаємо
температуру
Т
=
![]() запалення
гримучого газу
запалення
гримучого газу
![]() . (2)
. (2)
Відношення
![]() визначаємо з рівняння
Менделєєва — Клапейрона:
визначаємо з рівняння
Менделєєва — Клапейрона:
![]() . (3)
. (3)
Вираз (3) підставляємо у формулу (2) і отримаємо розрахункову формулу:
![]() = (4)
= (4)
Після підстановки у формулу (4) даних умови задачі, отримаємо відповідь
![]() =
=
-
У посудині під поршнем знаходиться газ при нормальних умовах. Відстань між дном посудини і дном поршня 25 см. Коли на поршень поклали вантаж масою 20 кг, поршень опустився на 13,4 см. Вважаючи стиснення адіабатичним, знайти для даного газу відношення сp/сv. Площа поперечного перетину поршня s = 10 см2.
2.85.
Дано
s
= 10 см2
![]() = 105 Па
= 105 Па![]() = 273 К
= 273 К![]() = 25 см
= 25 см![]() = 20 кг
= 20 кг![]() = 13,4 см
= 13,4 см
![]() = ?
= ?
Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
— показник
адіабати. Молярну
теплоємність газу для випадку його
участі в ізохорному процесі визначають
за формулою:
![]() , (4)
, (4)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Молярна теплоємність газу при ізобарному процесі (рівняння Майєра) визначається формулою:
![]() . (5)
. (5)
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (1)
![]() . (7)
. (7)
Звідки отримаємо
 , (8)
, (8)
де тиск газу зросте до величини
![]() , (9)
, (9)
а об’єм зменшиться до величини
![]() . (10)
. (10)
Вирази (9) і (10) у формулу (8) і отримаємо формулу для розрахунку:
 , (11)
, (11)
Після підстановки у формули (11) даних умови задачі, отримаємо відповідь
![]() =
=
-
Двоатомний газ займає об'єм
 = 0,5 л
при
тиску
= 0,5 л
при
тиску
 = 50 кПа.
Газ стискується адіабатичним
способом до
деякого об'єму
V2
та тиску
= 50 кПа.
Газ стискується адіабатичним
способом до
деякого об'єму
V2
та тиску
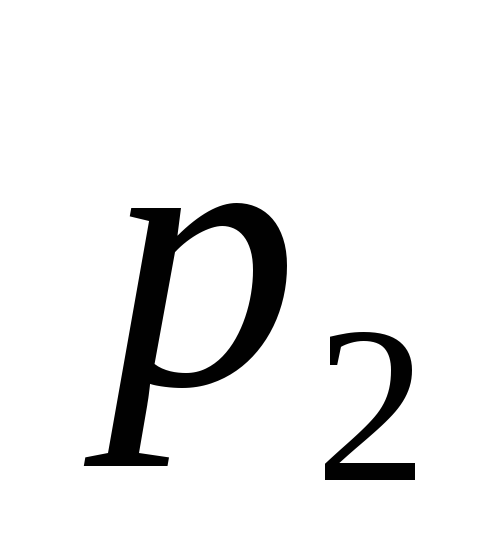 .
Потім він охолоджується при
V2
=
const до початкової температури, причому
його тиск
стає рівним
.
Потім він охолоджується при
V2
=
const до початкової температури, причому
його тиск
стає рівним
 = 100 кПа.
Знайти
об'єм
V2
і тиск
= 100 кПа.
Знайти
об'єм
V2
і тиск
 .
.
Рис. 2.86
2.86.
Дано
![]() = 5
= 5![]() =
0,5 л
=
0,5 л![]() = 50 кПа
= 50 кПа![]() =
100 кПа
=
100 кПа
![]() = ?
= ?
![]() = ?
= ?
Зробимо малюнок.
Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати. Рівняння (1) – (3) перетворюються
одне в друге завдяки використанню
рівнянню Менделєєва – Клапейрона.
— показник
адіабати. Рівняння (1) – (3) перетворюються
одне в друге завдяки використанню
рівнянню Менделєєва – Клапейрона.
Молярну теплоємність газу для випадку його участі в ізохорному процесі визначають за формулою:
![]() , (4)
, (4)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (1) для першого процесу
![]() . (7)
. (7)
З рівняння (7) отримаємо
 . (8)
. (8)
З рівняння Менделєєва – Клапейрона для першого і останнього стану газу отримаємо:
 (9)
(9)
отримаємо
![]() . (10)
. (10)
А з ізохорного процесу отримаємо
![]() . (11)
. (11)
З рівнянь (10) і (11) отримуємо
![]() . (12)
. (12)
А з рівнянь (8) та (12) маємо
 . (13)
. (13)
Після перетворень
отримаємо вираз для визначення тиску
![]() :
:
 . (14)
. (14)
А з рівняння (8) та (14) отримаємо вираз
для розрахунку об’єму
![]() :
:
 . (15)
. (15)
Після підстановки у формули (15) і (14) даних умови задачі, отримаємо відповідь
![]() =
=
![]() =
=
-
Газ розширяється за законом адіабати так, що його тиск падає від
 =
200 кПа
до
=
200 кПа
до
 =
100 кПа.
Потім він нагрівається при
постійному об'ємі
до початкової температури, причому
його тиск
стає рівним
=
100 кПа.
Потім він нагрівається при
постійному об'ємі
до початкової температури, причому
його тиск
стає рівним
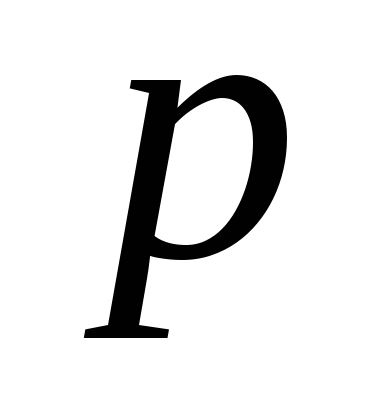 =
122 кПа.
Знайти
відношення
сp/сv.
для цього газу.
=
122 кПа.
Знайти
відношення
сp/сv.
для цього газу.
Рис. 2.86
2.87.
Дано
![]() =
200 кПа
=
200 кПа![]() =
100 кПа
=
100 кПа![]() =
122 кПа
=
122 кПа
![]() = ?
= ?
Зробимо малюнок.
Перший процес адіабатичний. Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати. Рівняння (1) – (3) перетворюються
одне в друге завдяки використанню
рівнянню Менделєєва – Клапейрона.
— показник
адіабати. Рівняння (1) – (3) перетворюються
одне в друге завдяки використанню
рівнянню Менделєєва – Клапейрона.
Молярну теплоємність газу для випадку його участі в ізохорному процесі визначають за формулою:
![]() , (4)
, (4)
![]() - кількість ступенів
вільності молекул газу.
- кількість ступенів
вільності молекул газу.
Відношення
![]() до
до
![]() дорівнює
дорівнює
![]() . (6)
. (6)
Розпишемо рівняння (1) для першого процесу
![]() . (7)
. (7)
З рівняння (7) отримаємо
 . (8)
. (8)
З другого, ізохорного процесу:
![]() , (9)
, (9)
отримаємо
![]() . (10)
. (10)
Підставляємо
температуру
![]() з виразу (10) у вираз (8)
з виразу (10) у вираз (8)
 . (11)
. (11)
Логарифмуємо вираз (11)
![]() . (12)
. (12)
З виразу (12) отримаємо відповідь:
 . (13)
. (13)
Після підстановки у формулу (13) даних умови задачі, отримаємо відповідь
![]() =
=
-
Яку енергію треба затратити, щоб видути мильний пузир діаметром
 =
12 см? Яким буде додатковий тиск
всередині цього пузиря?
=
12 см? Яким буде додатковий тиск
всередині цього пузиря?
2.88.
Дано
![]() =
12 см
=
12 см![]() = 0,043 Дж/м2
= 0,043 Дж/м2
![]() = ?
= ?
![]() = ?
= ?
Додаткова енергія, яку мають молекули в поверхневому шарі рідини, отримала назву поверхневої і визначається таким чином:
![]() ,
(1)
,
(1)
де - поверхневий натяг; S – площа поверхневого шару, м2.
Оскільки мильний пузир має зовнішній і внутрішній шар молекул, площа поверхні яких майже рівні, то енергія дорівнюватиме
![]() .
(2)
.
(2)
Надлишковий тиск, зумовлений кривизною поверхні рідини (формула Лапласа), для сферичної поверхні:
![]() .
(3)
.
(3)
Після підстановки у формули (2) і (3) даних умови задачі, отримаємо відповідь
![]() =
=
![]() =
=
-
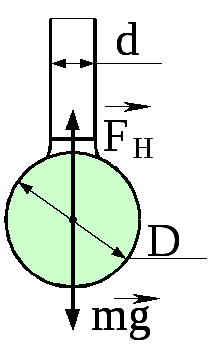
На нижньому кінці трубки діаметром d = 0,2 см, висить сферична крапля води. Знайти діаметр цієї краплі.
2.89.
Рис. 2.89 Дано
d
= 0,2 см
![]() = ?
= ?
Зробимо малюнок.
Крапля відірветься від трубки коли її вага перевищить силу поверхневого натягу, що діє в найменшому по діаметру контуру в місті з’єднання краплі з трубкою.
![]() . (1)
. (1)
Будемо вважати,
що цей діаметр дорівнює діаметру трубки
![]() .
Тоді з формули коефіцієнта
поверхневого натягу можна визначити
силу натягу:
.
Тоді з формули коефіцієнта
поверхневого натягу можна визначити
силу натягу:
![]() , (2)
, (2)
де
![]() — сила
поверхневого натягу;
— сила
поверхневого натягу;
![]() —
довжина ділянки контуру, що обмежує
вільну поверхню.
—
довжина ділянки контуру, що обмежує
вільну поверхню.
З рівнянь (1) і (2) отримуємо рівняння
![]() . (3)
. (3)
де
![]() - густина води, кг/м3.
- густина води, кг/м3.
Розв’язуємо рівняння (3) відносно діаметра краплі
![]() = (4)
= (4)
Підставляємо в формулу (4) данні умови задачі, виражені в системі СІ, і отримаємо відповідь:
![]() =
=
-
Гас витікає з вертикальної трубки діаметром
 = 1,8 мм. Скільки
крапель вийде з
= 1,8 мм. Скільки
крапель вийде з
 = 1 граму гасу, якщо коефіцієнт поверхневого
натягу гасу
= 1 граму гасу, якщо коефіцієнт поверхневого
натягу гасу
 = 24 10-3
Н/м, g = 10
м/с2
?
= 24 10-3
Н/м, g = 10
м/с2
?
