
2_1-2_136
.doc![]() =
=
-
Визначити тиск газу, що містить N = 109 молекул і має об'єм V = 1 см3, при температурах T1 = 3 K і T2 = 1000 K.
2.39.
Дано
N
= 109
молекул V
= 1 см3 T1
=
3 K
T2
=
1000 K
![]() = ?
= ?
![]() = ?
= ?
З рівняння Клапейрона-Менделєєва для одного моля газу маємо:
![]() ;
(1)
;
(1)
де
![]() - визначає концентрацію молекул у газі.
- визначає концентрацію молекул у газі.
Молярну масу газу визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (1)
, (1)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (1) і отримаємо дві відповіді:
![]() =
=
![]() =
=
-
При температурі t =35°С і тиску
 =
708 кПа густина газу становить
= 12,2 кг/м3.
Визначити відносну молекулярну масу
газу.
=
708 кПа густина газу становить
= 12,2 кг/м3.
Визначити відносну молекулярну масу
газу.
2.40.
Дано
t
=35°С
=
12,2 кг/м3
![]() =
708 кПа
=
708 кПа
![]() = ?
= ?
Відносна молекулярна маса, або відносна маса молекули
![]() , (1)
, (1)
де
![]() — абсолютне значення маси молекули,
кг;
— абсолютне значення маси молекули,
кг;
![]() кг - атомна
одиниця маси. .
кг - атомна
одиниця маси. .
Відносна молекулярна маса речовини
![]() , (2)
, (2)
де
![]() — кількість атомів
— кількість атомів
![]() хімічного елемента, що входить до складу
молекули даної речовини;
хімічного елемента, що входить до складу
молекули даної речовини;
![]() — відносна атомна маса цього елемента
(відносні атомні маси наведено в таблиці
Менделєєва).
— відносна атомна маса цього елемента
(відносні атомні маси наведено в таблиці
Менделєєва).
З рівняння Клапейрона-Менделєєва:
![]() ,
(3)
,
(3)
знаходимо молярну масу газу:
![]() ,
(4)
,
(4)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Дані умови задачі (виражені в системі СІ) та молярну масу з (4) підставляємо у вираз (1) і отримаємо відповідь:
![]() =
=
-
Який об'єм V займає суміш азоту масою m1 = 1 кг і гелію масою m2 = 1 кг при нормальних умовах?
2.41.
Дано
m1
=
1 кг m2
=
1 кг
![]() = 105 Па
= 105 Па![]() = 273 К
= 273 К![]() = 28 г/моль
= 28 г/моль![]() = 4 г/моль
= 4 г/моль
![]() = ?
= ?
Тиск суміші газів (закон Дальтона) має вигляд:
![]() , (1)
, (1)
![]() -
парціальний тиск
-
парціальний тиск
![]() -ї
компоненти суміші.
-ї
компоненти суміші.
Парціальні тиски газів визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Підставляємо парціальні тиски молекул газу з (2) у формулу (1) і отримуємо вираз:
 , (3)
, (3)
Розв’язуємо рівняння (3) відносно об’єму і отримаємо вираз для розрахунку:
![]() = (4)
= (4)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (4) і отримаємо відповідь:
![]() =
=
-
У балоні місткістю V = 15 л знаходиться суміш, що містить m1 = 10 г водню, m2 = 54 г водяної пари і m3 = 60 г оксиду вуглецю. Температура суміші t = 27°С. Визначити тиск.
2.42.
Дано
V
= 15 л m1
=
10 г m2
=
54 г m3
=
60 г t
= 27°С
![]() = 2 г/моль
= 2 г/моль![]() = 28 г/моль
= 28 г/моль![]() = 44 г/моль
= 44 г/моль
![]() = ?
= ?
Тиск суміші газів (закон Дальтона) має вигляд:
![]() , (1)
, (1)
![]() -
парціальний тиск
-
парціальний тиск
![]() -ї
компоненти суміші.
-ї
компоненти суміші.
Парціальні тиски газів визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала.
= 8,31 Дж/(моль•К) — універсальна газова
стала.
Підставляємо парціальні тиски молекул газу з (2) у формулу (1) і отримуємо вираз:
 , (3)
, (3)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (3) і отримаємо відповідь:
![]() =
=
-
Знайти повну кінетичну енергію, а також кінетичну енергію обертального руху однієї молекули NH3 при температурі t = 27°С.
2.43.
Дано
t
= 27°С
![]() = 6
= 6![]() = 3
= 3![]() = 3
= 3![]() = 2 г/моль
= 2 г/моль![]() = 28 г/моль
= 28 г/моль![]() = 17 г/моль
= 17 г/моль
![]() = ?
= ?
![]() = ?
= ?
Повна середня кінетична енергія молекули
![]() , (1)
, (1)
де
![]() Дж/К - стала Больцмана;
Дж/К - стала Больцмана;
![]() — термодинамічна
температура газу.
— термодинамічна
температура газу.
Енергію обертального руху однієї молекули дорівнює
![]() , (2)
, (2)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (2) і отримаємо відповіді:
![]() =
=
![]() =
=
-
Визначити питомі теплоємності
 і
і
 газоподібного оксиду вуглецю
СО.
газоподібного оксиду вуглецю
СО.
2.44.
Дано
![]() = 5
= 5![]() =
28 10-3
кг/моль
=
28 10-3
кг/моль
![]() = ?
= ?
![]() = ?
= ?
Між питомою і молярною теплоємністю існує співвідношення:
![]() (1)
(1)
де
![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Молярні теплоємкості газу при ізобарному і ізохорному процесі визначаються формулами:
 , (2)
, (2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Тоді питомі теплоємності пов’язані таким чином:
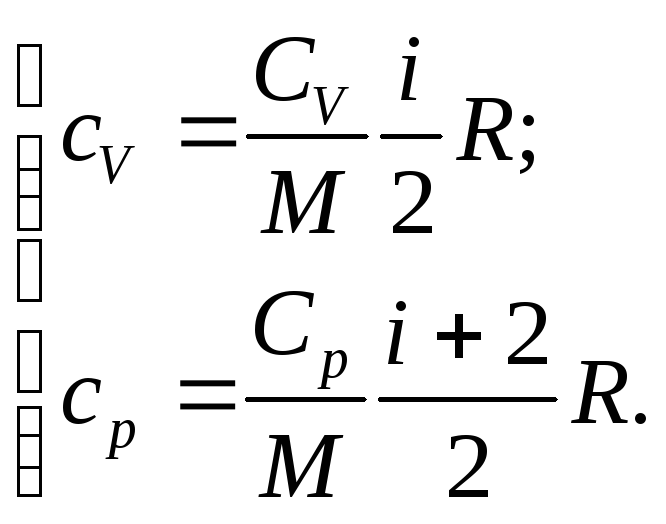 . (3)
. (3)
Підставляємо дані умови в рівняння (3) і отримаємо відповіді:
![]() =
=
![]() =
=
-
Суміш газу складається з кисню О2 з масовою часткою 1 = 85% і озону О3, з масовою часткою 2 = 15 %. Визначити питомі теплоємності
 і
і
 цієї газової суміші.
цієї газової суміші.
2.45.
Дано
![]() = 5
= 5![]() = 6
= 6![]() =
32 10-3
кг/моль
=
32 10-3
кг/моль![]() =
48 10-3
кг/моль
=
48 10-3
кг/моль![]() = 85%
= 85%![]() = 15%
= 15%
![]() = ?
= ?
![]() = ?
= ?
Між питомою і молярною теплоємністю існує співвідношення:
![]() (1)
(1)
де
![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Молярні теплоємкості суміші газів при ізобарному і ізохорному процесі визначаються формулами:
 , (2)
, (2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Тоді питомі теплоємності пов’язані таким чином:
 . (3)
. (3)
Підставляємо дані умови в рівняння (3) і отримаємо відповіді:
![]() =
=
![]() =
=
-
Газова суміш складається з азоту масою m1 = 3 кг і водяної пари масою m2 = 1 кг. Приймаючи ці гази за ідеальні, визначити питомі теплоємності
 і
і
 газової суміші.
газової суміші.
2.46.
Розв’язок.
Між питомою і молярною теплоємністю існує співвідношення:
![]() (1)
(1)
д
Дано
m1
=
3 кг m2
=
1 кг
![]() = 5
= 5![]() = 6
= 6![]() =
28 10-3
кг/моль
=
28 10-3
кг/моль![]() =
18 10-3
кг/моль
=
18 10-3
кг/моль
![]() = ?
= ?
![]() = ?
= ?![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Молярні теплоємкості суміші газів при ізобарному і ізохорному процесі визначаються формулами:
 , (2)
, (2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала;
= 8,31 Дж/(моль∙К) – універсальна газова
стала;
![]() ,
,
![]() - масові
частки газів.
- масові
частки газів.
Тоді питомі теплоємності суміші дорівнюють:
 . (3)
. (3)
Підставляємо дані умови в рівняння (3) і отримаємо відповіді:
![]() =
=
![]() =
=
-
Молекула газу складається з двох атомів. Різниця питомих теплоємкостей газу дорівнює:
 =
260 Дж/кг
К.
Знайти
молярну масу газу і ці теплоємності
=
260 Дж/кг
К.
Знайти
молярну масу газу і ці теплоємності
 і
і
 .
.
2.47.
Розв’язок.
М
Дано
![]() = 5
= 5![]() =
260 Дж/кг
К
=
260 Дж/кг
К
![]() = ?
= ?
![]() = ?
= ?
![]() = ?
= ?
![]() (1)
(1)
де
![]() - молярна маса речовини, моль/кг.
- молярна маса речовини, моль/кг.
Питомі теплоємкості газу при ізобарному і ізохорному процесі визначаються формулами:
 , (2)
, (2)
де
![]() = 8,31 Дж/(моль∙К) – універсальна газова
стала.
= 8,31 Дж/(моль∙К) – універсальна газова
стала.
Молярну масу газу визначаємо з використанням умови задачі:
![]() = 260 Дж/кг
К. (3)
= 260 Дж/кг
К. (3)
Звідки отримаємо молярну масу газу
![]() . (4)
. (4)
Підставляємо (4) у вирази (2) і отримаємо вирази для розрахунку теплоємкостей:
 , (5)
, (5)
Підставляємо дані умови в рівняння (5) і отримаємо відповіді:
![]() =
=
![]() =
=
-
Знайти середню довжину вільного пробігу молекули водню при
 =
133 мПа та t
= - 173°С.
=
133 мПа та t
= - 173°С.
2.48.
Дано
t
= - 173°С
![]() =
133 мПа
=
133 мПа![]() = 2 г/моль
= 2 г/моль![]() = 2,3∙10-10 м
= 2,3∙10-10 м
![]() = ?
= ?
Середня довжина вільного пробігу молекул газу дорівнює
![]() , (1)
, (1)
де
![]() — концентрація молекул,
— концентрація молекул,
![]() — ефективний діаметр молекули газу.
— ефективний діаметр молекули газу.
Концентрацію молекул газу визначимо з рівняння стану ідеального газу (рівняння Менделєєва — Клапейрона):
![]() , (2)
, (2)
де
![]() = 8,31 Дж/(моль•К) — універсальна газова
стала;
= 8,31 Дж/(моль•К) — універсальна газова
стала;
![]() = 6,02∙1023 моль-1 – число
Авогадро.
= 6,02∙1023 моль-1 – число
Авогадро.
Підставляємо концентрацію молекул газу з (2) у формулу (1) і отримуємо
![]() , (3)
, (3)
Дані умови задачі (виражені в системі СІ) підставляємо у вираз (3) і отримаємо відповідь:
![]() =
=
-
Водень займає об'єм V = 10 м3 при тиску
 =
0,1 МПа. Його нагріли при
постійному об'ємі
до тиску
=
0,1 МПа. Його нагріли при
постійному об'ємі
до тиску
 =
0,3 МПа. Визначити зміну внутрішньої
енергії газу, роботу,
що виконана ним, і теплоту Q, яка була
доведена до газу.
=
0,3 МПа. Визначити зміну внутрішньої
енергії газу, роботу,
що виконана ним, і теплоту Q, яка була
доведена до газу.
2.49.
Дано
V
= 10 м3
![]() =
0,1 МПа
=
0,1 МПа![]() =
0,3 МПа
=
0,3 МПа![]() = 2 г/моль
= 2 г/моль![]() = 5
= 5
![]() = ?
= ?
![]() = ?
= ?
![]() = ?
= ?
Якщо температура газу у деякому термодинамічному процесі зміниться на T, тоді і його внутрішня енергія зміниться на U:
![]() ,
(1)
,
(1)
де
![]() - молярна теплоємність
газу при ізохорному процесі.
- молярна теплоємність
газу при ізохорному процесі.
Оскільки об’єм газу не змінюється то газ роботи не виконує, тоді теплота Q, яку було доведена до газу дорівнює зміні його внутрішньої енергії.
Підставляємо дані умови в рівняння (1) і отримаємо відповідь:
![]() =
=
![]() =
=
![]() = 0
= 0
-
Кисень при незмінному тиску
 =
80 кПа нагрівається. Його об'єм
збільшується від V1
=
1 м3
до V2
=
3 м3.
Визначити зміну внутрішньої енергії
=
80 кПа нагрівається. Його об'єм
збільшується від V1
=
1 м3
до V2
=
3 м3.
Визначити зміну внутрішньої енергії
 кисню,
роботу
А,
виконану ним при
розширенні, а також теплоту Q,
яка була доведена до газу.
кисню,
роботу
А,
виконану ним при
розширенні, а також теплоту Q,
яка була доведена до газу.
2.50.
Дано
V1
=
1 м3
V2
=
3 м3
![]() =
80 кПа
=
80 кПа
![]() = 32 г/моль
= 32 г/моль![]() = 5
= 5
![]() = ?
= ?
![]() = ?
= ?
![]() = ?
= ?
Якщо температура газу у деякому термодинамічному процесі зміниться на T, тоді і його внутрішня енергія зміниться на U (використовуємо рівняння Менделєєва – Клапейрона):
![]() ,
(1)
,
(1)
де
![]() - молярна теплоємність
газу при ізохорному процесі.
- молярна теплоємність
газу при ізохорному процесі.
Розширюючись газ виконує роботу проти зовнішніх сил, елементарну роботу dA визначають за формулою:
![]() .
(2)
.
(2)
А повна робота дорівнює:
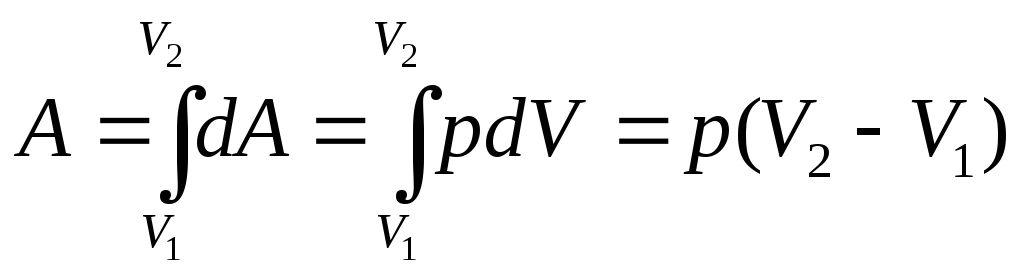 (3)
(3)
З першого начала термодинаміки отримаємо
![]() . (4)
. (4)
Підставляємо дані умови в рівняння (1), (2) та (4) і отримаємо відповіді:
![]() =
=
![]() =
=
![]() =
=
-
У циліндрі під поршнем знаходиться азот, що має масу m = 0,6 кг і займає об'єм V1 = 1,2 м3, при температурі t1 = 560 К. Внаслідок нагрівання газ розширився і зайняв об'єм V2 = 4,2 м3, причому температура залишилася незмінною. Знайти зміну внутрішньої енергії газу
 ,
виконану ним роботу
А
і теплоту Q,
яка була доведена до газу.
,
виконану ним роботу
А
і теплоту Q,
яка була доведена до газу.
2.51.
Дано
m
= 0,6 кг V1
=
1,2 м3 t1
=
560 К V2
=
4,2 м3
![]() = 28∙10-3 кг/моль
= 28∙10-3 кг/моль
![]() = ?
= ?![]() = ?
= ?![]() = ?
= ?
Оскільки під час нагрівання газу його температура залишається незмінною, то цей процес називається ізотермічним. Тоді згідно з формулою 1-го начала термодинаміки:
![]() , (1)
, (1)
де
![]() - елементарна кількість теплоти, що
підводиться до термодинамічної системи;
- елементарна кількість теплоти, що
підводиться до термодинамічної системи;
![]() - зміна внутрішньої енергії системи (у
нашому випадку ця зміна дорівнює нулю);
- зміна внутрішньої енергії системи (у
нашому випадку ця зміна дорівнює нулю);
![]() - робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму.
- робота, виконувана системою проти
зовнішніх сил при нескінченно малій
зміні об’єму.
Тобто маємо
![]() . (2)
. (2)
Розширюючись газ виконує роботу проти зовнішніх сил, елементарну роботу dA визначають за формулою:
![]() . (3)
. (3)
А повну роботу:
 (4)
(4)
Тиск визначаємо з рівняння Менделєєва-Клапейрона:
![]() . (5)
. (5)
Тоді роботу можна визначити за формулою:
 . (6)
. (6)
Підставляємо дані умови в рівняння (6) і отримаємо відповідь:
![]() = 0.
= 0. ![]() =
=
![]() =
=
-
У автомобільному двигуні міра адіабатного стиснення горючої суміші дорівнює 6,2. Суміш подається в циліндр при температурі t1 = 15°С. Знайти температуру t2 горючої суміші в кінці такту стиснення. Горючу суміш розглядати як двоатомний ідеальний газ.
2.52.
Дано
t1
=
15°С
![]() = 6,2
= 6,2![]() = 5
= 5
![]() = ?
= ?
Рівняння адіабатного процесу (рівняння Пуассона) мають вигляд
![]() ,
(1)
,
(1)
або
![]() , (2)
, (2)
або
![]() ,
(3)
,
(3)
де
![]() — показник
адіабати,
— показник
адіабати,
![]() = молярна теплоємність
газу для випадку його участі в ізохорному
процесі
= молярна теплоємність
газу для випадку його участі в ізохорному
процесі
