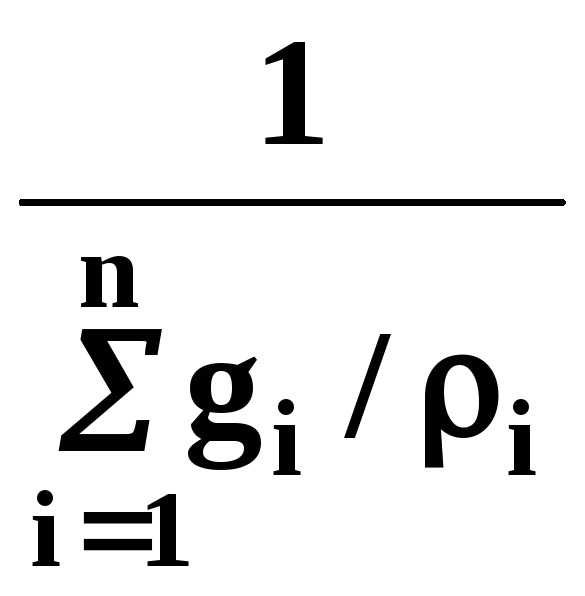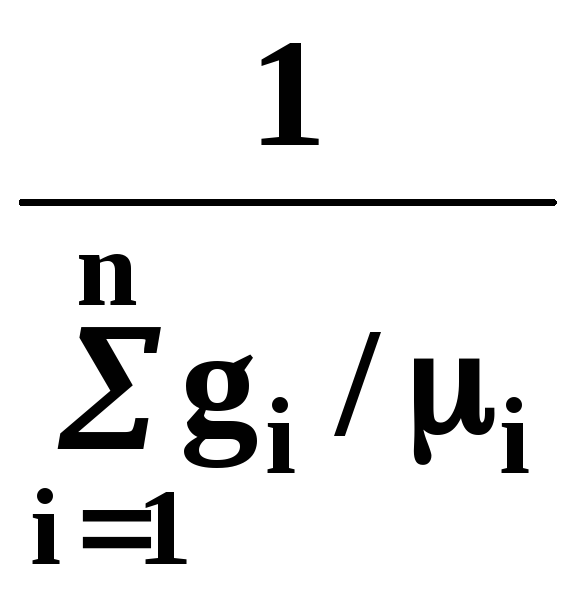- •«Термодинаміка»
- •Основні поняття термодинаміки
- •Контрольні запитання
- •Суміші ідеальних газів
- •Контрольні запитання
- •3. Перший і другий закон термодинаміки
- •Контрольні запитання
- •Процеси зміни параметрів ідеального газу
- •Визначення основних характеристик термодинамічних процесів
- •Контрольні запитання
- •5. Рівняння стану реальних газів
- •Критичні параметри та параметри насичення [2]
- •6. Ізотерми газів
- •Контрольні запитання
- •Розв’язання
- •7. Перший закон термодинаміки для реальних газів
- •7.1. Ізохорний процес зміни стану газу
- •7.2. Ізобарний процес
- •7.3. Ізотермічний процес
- •7.4. Адіабатний процес
- •7.5. Стискування газів у компресорах
- •7.6. Процеси адіабатного руху газу в потоці і витікання газу
- •7.7. Дроселювання газів і пари
- •Контрольні запитання
Суміші ідеальних газів
У суміш ідеальних газів входять компоненти, що не вступають між собою в хімічну взаємодію й підлягають закону стану ідеального газу.
Склад газової суміші визначається кількістю кожного із компонентів і задається масовою або об’ємною часткою.
Масова частка – це відношення маси окремого газу т1, що входить у суміш, до маси всієї суміші m
g1=
m1/ m;
g2=
m2/ m;
… g n=
m n/
m;
![]() .
(29)
.
(29)
Об’ємною часткою називають відношення об’єму кожного компонента, що входить у суміш V1, до об’єму всієї суміші V
r1
= V1/
V; r2
= V2/
V; … rn
= Vn/
V;
![]() .
(30)
.
(30)
Об’ємна і мольна частки рівнозначні.
Тиск окремого компонента, який би він мав за умови, що він один знаходиться в усьому об’ємі газової суміші, називається парціальним тиском газу.
Сума парціальних тисків компонентів дає величину тиску суміші газів (закон Дальтона)
![]() .
(31)
.
(31)
Парціальний тиск кожного з компонентів суміші визначається за відомим тиском суміші та об’ємною часткою компонентів
Р1 = r1 ×Р; Р2 = r2 ×Р; … Рn = rn ×Р. (32)
Перерахунок часток виконується за залежностями
g1= r1 ×ρ1 / ρ; rі = gі× ρ / ρі , (33)
де ρі і ρ – відповідно густина і-го компонента і суміші газів у кг/м3.
Усі термодинамічні функції й параметри суміші газів мають адитивні властивості – характеристики суміші визначаються як сума характеристик компонентів з урахуванням частки кожного з компонентів.
Залежності для визначення характеристик суміші наведені в таблиці 4.
Контрольні запитання
Визначити парціальний тиск кисню в атмосферному повітрі.
Що являють собою масова й об’ємна частки компонентів суміші газів?
Мольна частка СН4 у складі природного газу становить 0,3. Визначити об’ємну частку СН4.
Масова частка пропану в суміші газів становить 0,005. Визначити його об’ємну частку, якщо густина пропану ρС3Н8 = 2,5 кг/м3, а густина суміші ρ = 0,8 кг/м3.
Таблиця 4
|
№ з/п |
Найменування характеристики суміші |
Позна-чення |
Од. вимірювання |
Залежності для визначення | |
|
Через об’ємну частку |
Через масову частку | ||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1 |
Густина |
ρ |
|
|
|
|
2 |
Молекулярна маса |
μ |
кг |
|
|
|
3 |
Газова стала |
R |
|
|
|
|
4 |
Тиск |
Р |
МПа |
|
|
|
5 |
Масова теплоємність |
С |
|
– |
|
|
6 |
Об’ємна теплоємність |
С´ |
|
|
– |
|
7 |
Теплота згорання газової суміші |
|
|
|
– |
Задачі
№1. До об’ємного складу суміші, що добувається з нафтової свердловини, входить вода 60% і нафта 40%. Густина води ρ1=1000 кг/м3, а нафти ρ2=800 кг/м3. Масова теплоємність води С1=4,2 кДж/кг·гр, а нафти С2=1,6 кДж/кг·гр. Визначити густину суміші, її теплоємність і кількість теплоти для нагрівання V=10 м3/год нафти від температури tп= +10°C до tк= +60°C. Тиск у підігрівачі постійний. Теплоємність прийняти незалежною від температури.
Розв’язання
Густина суміші „вода – нафта”
ρ = ρ1 r1 + ρ2 r2= 10000,6+8000,4 = 920 кг/м3.
Масова частка компонентів суміші за відомими значеннями об’ємної частки визначається за формулою (33)
для води g1 = r1 ρ1 /ρ = 0,61000/920 = 0,65 (65%);
для нафти g2 = r2 ρ2 /ρ = 0,4800/920 = 0,35 (35%).
Масова теплоємність суміші обчислюється за формулою (5) таблиці 4
С = g1 С1 + g2 С2 = 0,654,2 + 0,351,6 = 3,3 кДж/кг·гр.
Кількість теплоти для нагрівання 10 м3/год суміші визначається за залежністю
Q = СVρ(tк – tп) = 3,310920(60 – 10) = 1518000 кДж/год=1518000/3600=
= 421,6 кВт = 0,42 МВт.
№2.
Масовий
склад
горючого
природного газу: СН4
– 90%;
С2Н6
– 6%; СО2
– 4%. Визначити теплоту згорання газу.
До якого тиску необхідно стиснути газ,
щоб при температурі tк
=
+50°C і масі М = 8 кг він займав об’єм V2
=
4 м3?
![]() =
35800
кДж/нм3,
=
35800
кДж/нм3,
![]() = 64400 кДж/нм3.
= 64400 кДж/нм3.
Розв’язання
Визначають густину суміші газів за нормальних умов відповідно до залежності (1) таблиці 4
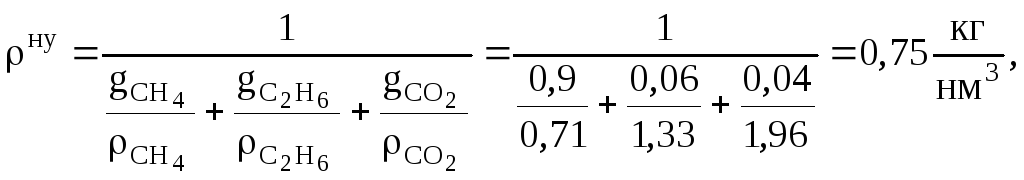
де
![]() ;
;
![]() ;
;
![]() .
.
Об’ємний склад суміші за відомим масовим складом розраховується за формулою (33)
![]() (95%);
(95%);
![]() (3,5%);
(3,5%);
![]() (1,5%).
(1,5%).
Перевірка: ∑rі= rСН +rС2Н6 +rСО2= 0,95+0,035+0,015=1,0.
Теплота згорання газу згідно із законом адитивності
![]() ,
кДж/нм3.
,
кДж/нм3.
Газова стала компонентів суміші визначається за залежностями
![]() ;
;
![]() ;
;![]() .
.
Газова стала для суміші газів згідно із законом адитивності
![]()
, кДж/кг·гр.
Абсолютний тиск газу, при якому 4 кг газу будуть займати об’єм 4 м3, визначається із рівняння стану суміші газів
РАV= М RТ; РА= М RТ/ V, Па;
Р
= РА
=
8491,7(273+50)/4
= 317761 Па = 317,8 кПа
![]() 3,18
ата.
3,18
ата.
Надлишковий (манометричний) тиск газу буде становити
РМАН = РА – РБАР = 317,8 – 101,3 = 216,5 кПа 2,16 ата.