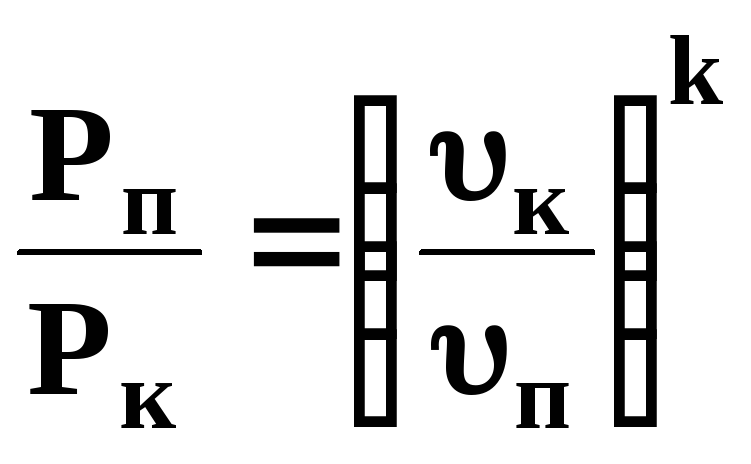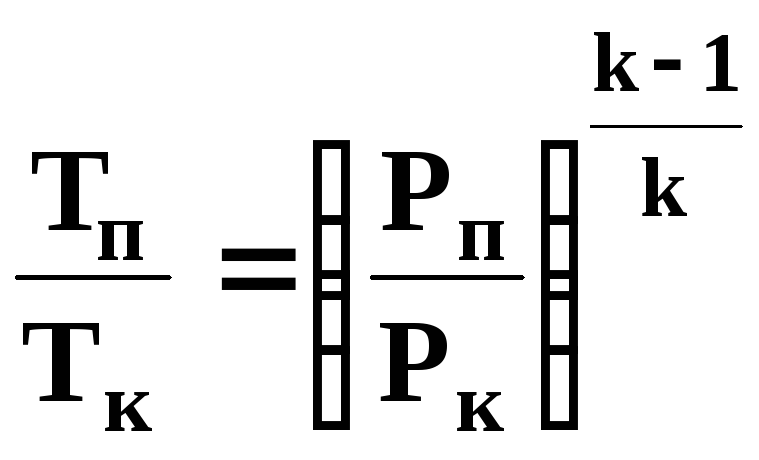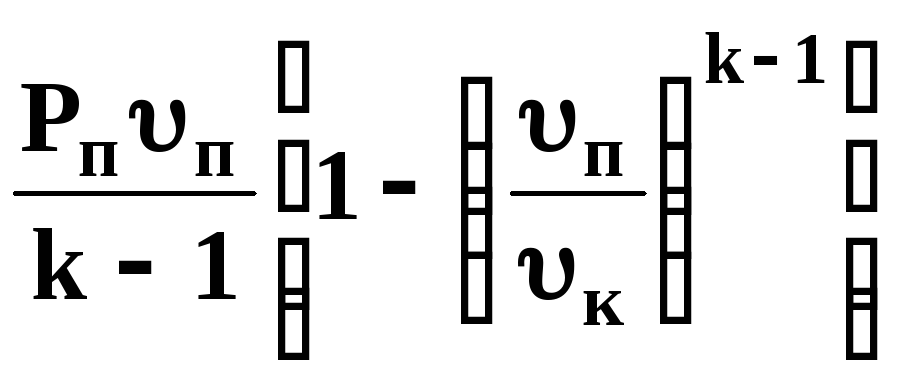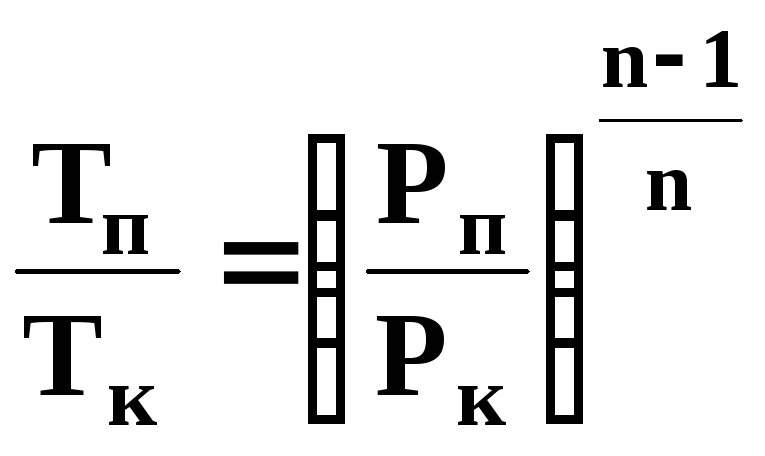- •«Термодинаміка»
- •Основні поняття термодинаміки
- •Контрольні запитання
- •Суміші ідеальних газів
- •Контрольні запитання
- •3. Перший і другий закон термодинаміки
- •Контрольні запитання
- •Процеси зміни параметрів ідеального газу
- •Визначення основних характеристик термодинамічних процесів
- •Контрольні запитання
- •5. Рівняння стану реальних газів
- •Критичні параметри та параметри насичення [2]
- •6. Ізотерми газів
- •Контрольні запитання
- •Розв’язання
- •7. Перший закон термодинаміки для реальних газів
- •7.1. Ізохорний процес зміни стану газу
- •7.2. Ізобарний процес
- •7.3. Ізотермічний процес
- •7.4. Адіабатний процес
- •7.5. Стискування газів у компресорах
- •7.6. Процеси адіабатного руху газу в потоці і витікання газу
- •7.7. Дроселювання газів і пари
- •Контрольні запитання
Визначення основних характеристик термодинамічних процесів
|
№ з/ п |
Назва процесу |
Рівняння процесу |
Кількість теплоти
q,
|
Робота
l,
|
Примітки | |
|
1 |
2 |
4 |
5 |
6 |
7 | |
|
1 |
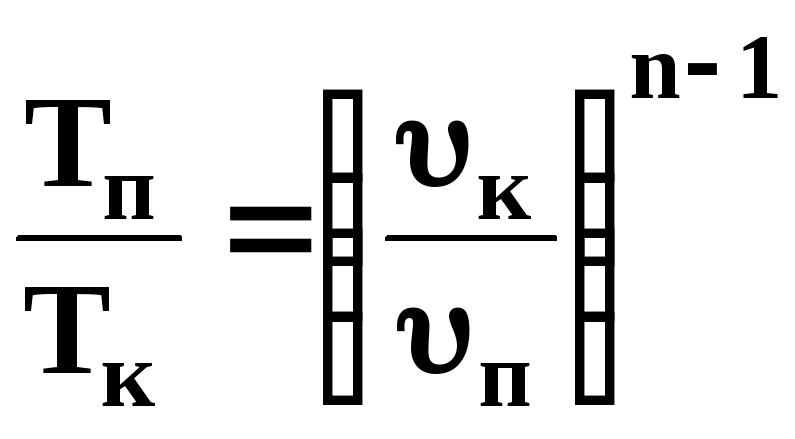
Ізохорний υ= сonst n=∞ |
υ= сonst
|
Сmυ(ТК – ТП) |
0 |
Сmυ,
ТП, ТК, (ºК) | |
|
2 |
Ізобарний Р= соnst n=0 |
Р=сonst
|
Сmр(ТК – ТП) |
Р(υК – υП) |
Сmр,
Т (ºК) | |
|
iК − iп |
R(ТК – ТП) | |||||
|
3 |
Ізотерміч-ний Т= сonst n=1 |
Т= сonst
|
q=l |
ΔU=0 |
RТ·ln(υК/υП) |
R
υ
Р (Па) |
|
Т(SК – SП) |
РПυП·ln(РП/РК) | |||||
|
4 |
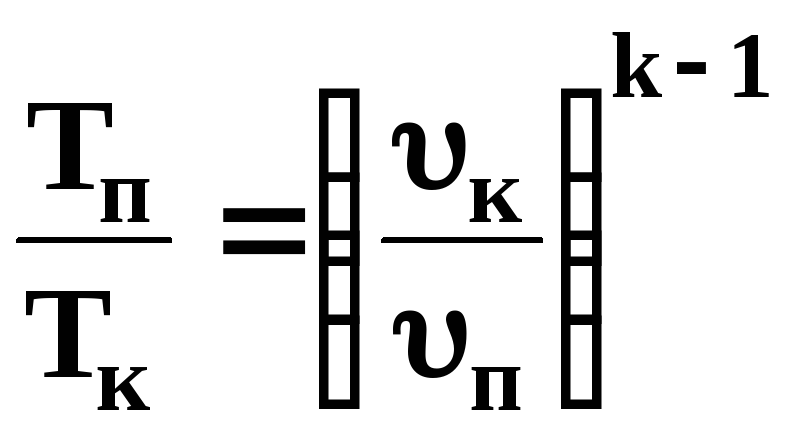
Адіабат-ний dq=0 dS=0 n=k
Pυk=const |
|
0 |
іК –іП |
SП = SК Р (Па) Т (ºК)
υ
R
| |
|
| ||||||
|
| ||||||
|
| ||||||
|
5 |
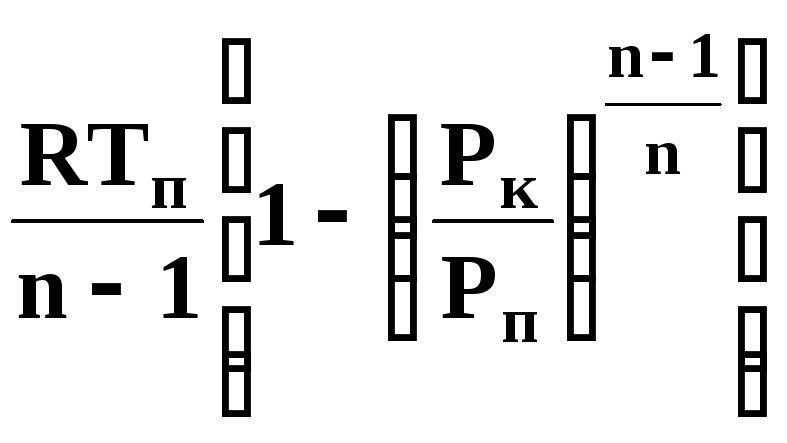
Політроп-ний Сυ =с onst Pυn=const -∞<n<∞ |
|
Сmυ
×(ТК – ТП) |
|
Р (Па) Т (ºК)
υ
R
| |
Визначення незалежних від виду процесу величин зміни ентропії ΔS = SК – SП, ентальпії Δі = іК – іП та внутрішньої енергії ΔU = Uк – Uп виконується за формулами відповідно (25), (28), (20), (14).
Аналіз характеристик для різних термодинамічних процесів дає можливість зробити такі висновки:
в ізохорному процесі робота не виконується, а вся відведена теплота витрачається на зміну внутрішньої енергії
q = ΔU = Сmυ(Тк – Тп);
збільшення тиску робочого тіла при υ= сonst приводить до пропорційного підвищення температури РТ;
теплота, що підводиться до робочого тіла в ізобарному процесі, приводить до збільшення ентальпії і витрачається як на зміну внутрішньої енергії, так і на здійснення роботи
q = ік – іп = Сmр(Тк – Тп)= l + ΔU;
внутрішня енергія та ентальпія при ізотермічному процесі не змінюються. Теплота, підведена до робочого тіла, витрачається тільки на виконання роботи. Ізотермічний процес є одним із найефективніших
ΔТ = 0; ΔU = 0; Δі = 0; q = l;
в адіабатному (ізоентропійному) процесі робота виконується в результаті зміни внутрішньої енергії РТ. Зовнішній теплообмін у процесі відсутній
– ΔU = l; dq =0;
у політропному процесі зміна стану ідеального газу здійснюється при постійному значенні теплоємності, незмінним залишається також розподіл теплоти між роботою і внутрішньою енергією.
Політропи, рівнянням яких є Pυn = const, у координатах Р-υ і T-S зображаються кривими, характер котрих залежить від показника політропи n. На рис. 2 видно, що при вказаних значеннях k > n > 1 підведення теплоти до робочого тіла супроводжується зменшенням його температури. У зв’язку з цим теплоємність у таких процесах буде мати від’ємне значення. В той же час для політропних процесів з k < n < 1 знаки приростання температури ΔТ і кількості теплоти q збігаються, а теплоємність додатна. Збільшення температури відбувається також при підведенні теплоти в ізохорному й ізобарному процесах (див. процеси при n = ∞ і n = 0 на рис.2).
При n = k (адіабатний процес) температура РТ змінюється найбільш інтенсивно – графік адіабатного процесу виглядає як пряма лінія, що проходить паралельно координаті температури. І це відбувається взагалі без підведення теплоти й без теплообміну.
Зміна внутрішньої енергії незалежно від виду процесу адекватна зміні температури. При ΔТ > 0, ΔU > 0, а при ΔТ < 0 , ΔU < 0.
Робота
ж із розширення РТ залежить від виду
термодинамічного процесу і показника
політропи n. Найбільшу частку на одиницю
підведеної теплоти перетворити в роботу
можна в ізобаричному процесі при n =1.
При збільшенні показника політропи до
1 < n < k і далі до +
![]() n > k робота розширення стає меншою та
при n =∞
(ізохорний процес) робота стає рівною
нулю.
n > k робота розширення стає меншою та
при n =∞
(ізохорний процес) робота стає рівною
нулю.
Отже, вид термодинамічних процесів, за якими здійснюється зміна параметрів РТ у реальних технічних пристроях і теплових двигунах, має значний вплив на ефективність їх роботи, у тому числі на величину ККД, витрати палива і можливість досягнення потрібних параметрів роботи.