
- •Висновок…………………………………………………………………35
- •Висновок………………………………………………………………..
- •1 Основні положення про роботу у хімічній лабораторії
- •1.2 Хімічний посуд та його призначення
- •1.3 Миття та сушіння хімічного посуду
- •1.5 Приготування розчинів
- •1.5.1 Способи виразу концентрації розчинів
- •1.5.2 Приготування титрованих розчинів
- •1.5.3 Перевірка концентрацій розчинів
- •1.6 Висновок
- •2.1 Первинні настроювання текстового редактора word
- •2.2 Робота з редактором формул
- •3 Загальні відомості про бібліотеку доннту
- •3.1 Структура бібліотеки
- •3.1.1 Види каталогів бібліотеки і правила роботи з ними
- •3.2.1 Результати пошуку літератури у тематичному і алфавітному каталогах
- •1.2.3 Результати пошуку літератури у відділі періодики
- •3.3 Результати роботи з літературою
- •3.3.1 Аналіз обраних книг
- •3.3.2 Результати пошуку літератури у відділі періодики
- •3.4 Результати оформлення бібліографічного опису у списку використаної літератури
- •3.5 Висновок
1.5 Приготування розчинів
Основним розчином в об'ємному анаїізі є титрований, або стандартний, розчин початкового реактиву при титруванні яким визначають зміст речовини в аналізованій речовині.
Приг отування розчинів точно відомої концентрації вимагає дотримання особливих правил, виняткової точності й обережності у роботі. Недотримання необхідних умов згодом неминуче відбивається на точності всіх об'ємних визначень, виконаних допомогою приготовленого стандартного розчину, і дуже часто приводить не тільки до необхідності переробляти аналіз, але й установлювати знову титр вихідного розчину.
Існують такі способи готування титрованих розчинів:
-
приготування титрованого розчину по точному навішенню вихідної речовини;
-
установка титру розчину за допомогою установчої речовини;
-
установка титру розчину за допомогою іншого титрованого розчину;
-
готування титрованих розчинів по "фіксаналу".
1.5.1 Способи виразу концентрації розчинів
Під концентрацією розуміють масу або кількість речовини, що доводиться на одиницю маси або одиниці об'єму розчину або розчинника.
Концентрації бувають:
а) масова частка (процентна концентрація) - це безрозмірна величина, рівна відношенню маси речовини до маси розчину:

б) молярна концентрація - це кількість молей речовини на об'єм розчину:

в) еквівалентна або нормальна концентрація - це кількість грам - еквівалент речовини на об'єм розчину:

Правило еквівалентності. Хімічні елементи або їхні сполуки вступають у хімічні реакції один з одним у строго певних вагових кількостях, що відповідають їхнім хімічним еквівалентам (грам - еквівалентам);
г) моляльна концентрація - це кількість молей речовини в одному кг розчинника:

д) мольна частка розчиненої речовини - безрозмірна величина, рівна відношенню числа молей речовини до загального числа молів всіх речовин у розчині:
Х
=

1.5.2 Приготування титрованих розчинів
Дано завдання приготувати 250 см3 0,1 н розчину КОН. Для цього с початку розраховуємо цю задачу теоретично, а потім практично приготуємо титрований розчин.

M(KOH) = 39+16+1 = 56 г/моль,
m(KOH) = 0,1·57·0,250 = 1,425 л.
1.5.3 Перевірка концентрацій розчинів
Порядок визначення концентрації розчинів методом кислотно-основного титрування (титриметричний аналіз).
Суть методу полягає в додатку по краплях розчину відомої концентрації (титрованого розчину) до точно виміряному об'єму розчину невідомої концентрації в присутності індикатора. Як індикатори в кислотно-основному титруванні використовують: метиловий оранжевий, метиловий червоний, фенолфталеїн.
Cпочатку підготовляємо бюретку. Требо помити її водою й обполоскати невеликою кількістю титрованого розчину, що заливається через лійку. Розчин повністю злити з бюретки;
-
за допомогою лійки заповнити бюретку титрованим розчином на 2 - 3 см3 вище нульової мітки й забрати лійку;
-
заповнити носик бюретки й установити нуль;
-
у конічну колбу для титрування відібрати аліквоту (певний об'єм) досліджуваного розчину за допомогою мірної піпетки;
-
додати 2 - 3 краплі індикатора і перемішати. У випадку невеликого об'єму розчину, дистильованою водою довести його об'єм до (50 - 70) см3;
-
обережно по краплях з бюретки додають титрований розчин до зміни кольору індикатора;
-
титрування повторюють 2 - 3 рази. Вибираючи середню величину з 2-х достовірних результатів. Достовірними вважаються результати, що відрізняються не більше 0,2 см3 ;
-
по закінченню титрування, титрований розчин зливають із бюретки, промивають водою якщо буде потреба, повністю заливають дистильованою водою.
Було поставлене завдання установити концентрацію приготовленого раніше розчину КОН шляхом титрування аліквоти 10 см3 0,1 н соляною кислотою.
Результати титрування:
 =
8 см3;
=
8 см3;
 =
8,3
см3;
=
8,3
см3;
 =
8,1
см3;
=
8,1
см3;
 =
8,2
см3;
=
8,2
см3;




 ;
;



Результата аналітичних визначень зводимо в таблицю 1.1.
Таблиця 1.1 - Результати аналітичних визначень
|
Задано |
Розраховано |
Титрування |
|||||||||
|
об'єм розчину,
|
речовина |
концентрація, моль/ |
m(речовини) |
аліквота,
|
см3 |
см3 |
см3 |
см3 |
концентрація розчину моль- екв/дм3 |
||
|
250 |
КОН |
0,1 |
1,4 |
10 |
8 |
8,3 |
8,1 |
8,2 |
0,082 |
||
Практично
взята наважка
 Виразимо концентрацію розчину іншими
способами, прийнявши щільність розчину
за 0,998
г/см3:
Виразимо концентрацію розчину іншими
способами, прийнявши щільність розчину
за 0,998
г/см3:


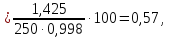

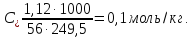




 ,
,

