
- •Кафедра прикладной экологии и охраны окружающей среды
- •Характеристика объектов окружающей среды
- •Химический состав, классификация и некоторые особенности природных вод
- •Подразделения вод согласно минерализации
- •Состав поверхностых вод суши
- •Характерные интервалы концентрации биогенных элементов в поверхностных водах суши (в скобках пдк, мг/л)
- •Зависимость содержания nh3 от рН воды при разных температурах
- •Содержание микроэлементов в поверхностных водах суши и биометаллах
- •Молекулярные массы комплексных соединений микроэлементов
- •Характерные интервалы концентраций органических соединений природного происхождения в поверхностных водах суши в мг с/л.
- •Состав подземных вод
- •Состав воздуха и атмосферных осадков
- •Химический состав чистого воздуха
- •Химический состав почв.
- •Группы водосборной площади Днепра
- •Химический состав донных отложений
- •Содержание основных компонентов и микроэлементов в донных отложениях
- •Общая схема анализа и основные этапы
- •Характеристика методов анализа
- •Общая характеристика методов анализа объектов окружающей среды
- •Особенности анализа воздуха
- •Отбор проб
- •Подготовка проб к анализу.
- •Особенности анализа почв и донных отложений.
- •Отбор проб и их подготовка к анализу
- •Основные этапы анализа
- •Особенности анализа природной воды. Виды проб и техника их отбора
- •Отбор проб с водных объектов
- •Консервация, транспортировка и хранение проб воды
- •Определение химических ингредиентов в растворённом состоянии, коллоидно-дисперсной форме и взвесях
- •Концентрирование микрокомпонентов
- •Зависимость количества экстракций n для 99 % извлечения веществ от коэффициента разделения (d) и кратности концентрирования (vвод./vорг.)
- •Удаление веществ, мешающих анализу
- •Автоматизация анализа природных вод
- •Статистическая обработка результатов анализа
- •Зависимость t от n при различных р
Состав поверхностых вод суши
Растворенные газы, рН, Eh . Из растворенных газов наиболее характерными являются кислород и диоксид углерода, содержание которых в большей степени зависит от температуры воды, ее прозрачности и глубины, с которой отбиралась проба. На рис. 1 показано влияние температуры (t) на растворимость кислорода в дистиллированной воде (кривая 1). Эта зависимость описывается формулой.
О2 (мг/л) = 4,505 × 10-3 × t2 – 3,716 × 10-1 × t + 14,650 (1)
Минерализация природных вод также влияет на растворимость кислорода, уменьшая ее на 0,04 – 0,08 мг/л на каждые 1000 мг солей в зависимости от температуры. Это влияние хорошо заметно при минерализации свыше 1 г/л и уменьшается при увеличении температуры воды (рис. 1, кривые 2 – 4)
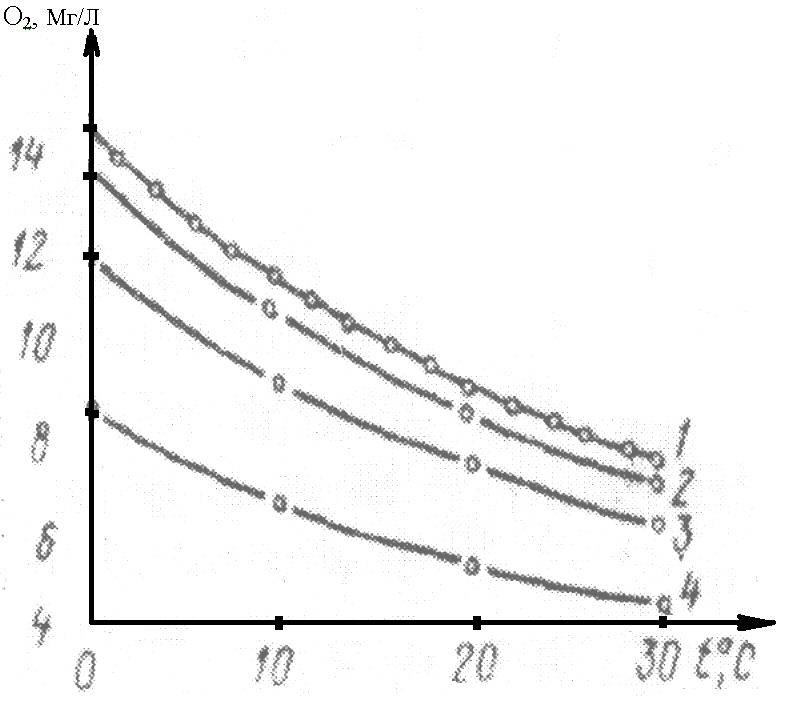
Рис. 1. Зависимость растворимости О2 от минерализации при разных t при Р = 760 мм рт.ст. и РО2 = 0,209 атм.; 1 – 0 (дист. вода), 2 – 10 г/л; 3 – 35 г/л; 4 – 70 г/л
Концентрация О2 в поверхностных водах суши может изменяться практически от 0 до 14-15 мг/л и зависит от влияния других групп противоположно направленных процессов. К первой группе процессов, которые обогащают воду кислородом, принадлежат абсорбции О2 из атмосферы и его выделения водными растениям при фотосинтезе. Последний в значительной степени зависит от температуры и интенсивности освещения природного водного объекта. К другой группе процессов, которые уменьшают содержание кислорода в воде, принадлежат биохимические окисления органических веществ и химическое окисление восстановителей (Fe2+, Mn2+, NO-2, Н2S и др.) Вследствие этого в незагрязненных водах концентрация растворенного О2 в летний период выше, чем зимой, и также выше в поверхностных слоях по сравнению с придонными. Глубинная стратификация также зависит от интенсивности перемешивания водных масс. Для маленьких и быстрых речек глубина стратификации меньше, чем для больших рек или озер, водохранилищ, прудов, особенно в штилевую погоду. Поскольку основным поставщиком О2 в поверхностные воды является фотосинтез водными растениями, то наибольшее насыщение воды кислородом наблюдается ~ в 14-15 часов, а наименьшее - ~ в 4-6 часов утра. Колебание содержания О2 на протяжении суток может достигать 2-3 мг/л и более. Поэтому для характеристики кислородного режима определенного водного объекта необходимо провести серийный анализ, отбирая пробы воды с различных глубин, в разных точках акватории и в разное время суток и анализировать немедленно после отбора пробы.
Диоксид углерода содержится во всех водах в основном в свободном состоянии в виде молекулы СО2. Лишь часть этих молекул (~ 1 %) взаимодействуют с водой с образованием слабой угольной кислоты Н2СО3, и поэтому под растворенным СО2 подразумевают сумму СО2 + Н2СО3.
Основным источником поступления СО2 в поверхностные воды является биохимическое окисление органических соединений и в меньшей степени дыхание водных организмов. Снижение его содержания происходит при интенсивном фотосинтезе.
В результате этого в незагрязненных поверхностных водах концентрация растворенных О2 и СО2 изменяются антибатно (рис.2). Однако, эта зависимость нарушается при загрязнении воды органическими соединениями, особенно токсичными для водных организмов и неорганическими восстановителями, что приводят к значительному уменьшению концентрации О2 (черные точки рис. 2)
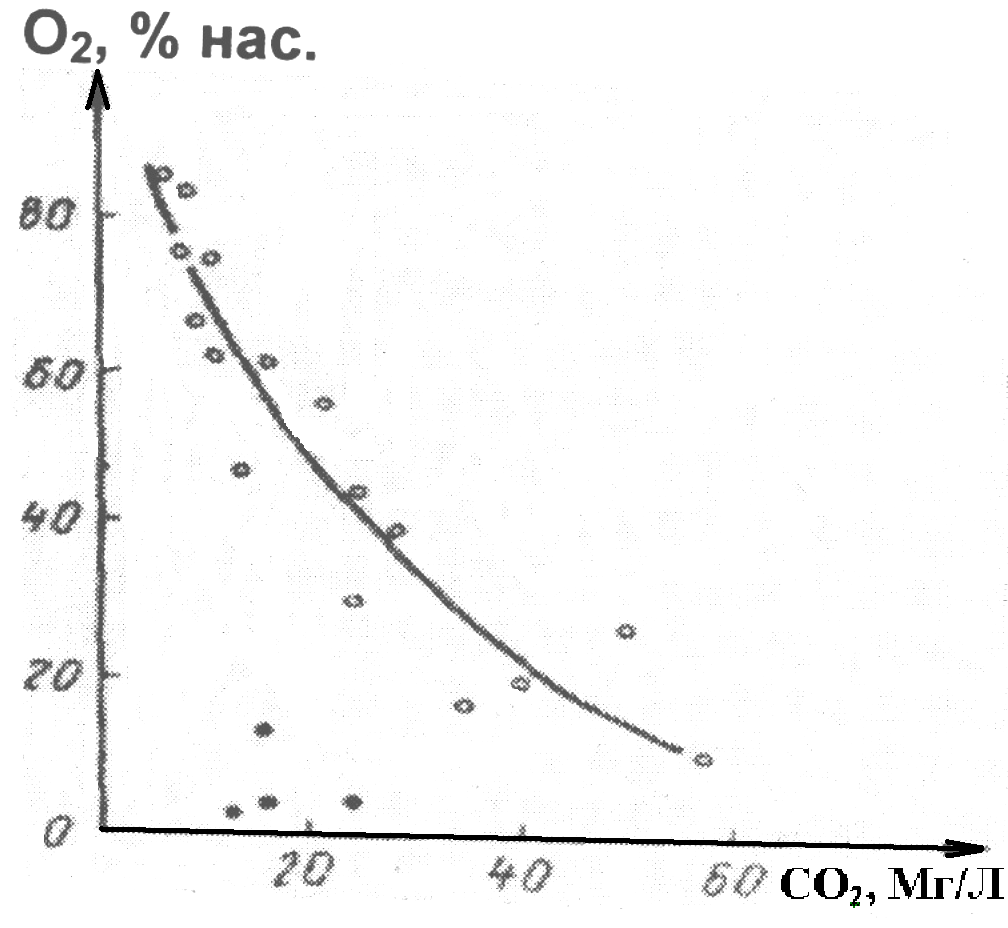
Рис. 2. Взаимосвязь между содержанием растворённых в воде кислорода и диоксида углерода
СО2 растрачивается также на растворение карбонатов:
↓CaCO3 + CO2 + H2O↔Ca2- + 2HCO-3 (2)
Равновесную концентрацию свободного СО2, моль/л, которая отвечает этой реакции, можно рассчитать по формуле, которая выводится совместным решением уравнений констант диссоциаций угольной кислоты и констант равновесия растворения CaCO3:
![]() (3)
(3)
где К1 и К2 – последовательные константы диссоциации угольной кислоты (К1 = 4,5 × 10-7; К2 = 4,8 × 10-11); ПРСаСО3 = 4,8 × 10-9 (произведение растворимости СаСО3)
[HCO-3]и [Са2+] – концентрация этих ионов, моль/л;
![]() и
и![]() -их коэффициенты
активности, которые зависят от ионной
силы (минерализации воды). Если в природной
воде возникает концентрация СО2
выше, чем она может в соответствии с
уравнением (3), то такая вода содержит
так называемый «агрессивный СО2»
и способна разрушить бетонные
гидросооружения вследствие протекания
реакции (2).
-их коэффициенты
активности, которые зависят от ионной
силы (минерализации воды). Если в природной
воде возникает концентрация СО2
выше, чем она может в соответствии с
уравнением (3), то такая вода содержит
так называемый «агрессивный СО2»
и способна разрушить бетонные
гидросооружения вследствие протекания
реакции (2).
Сероводород в природных водах или отсутствует, или нагромождается в незначительных количествах в придонных слоях, особенно зимой. Присутствие сероводорода является признаком загрязнения воды органическими веществами. Для водных объектов санитарно-бытового и рыбохозяйственного назначения присутствие сероводорода и сульфидов недопустимо.
Концентрация ионов водорода в природных водах зависит в основном от содержания продуктов диссоциации угольной кислоты, от наличия слабых органических кислот и солей тяжелых металлов, которые гидролизуются. Наиболее значительно на величину рН незагрязненных поверхностных вод суши влияет концентрация угольной кислоты. Поэтому в условиях интенсивного фотосинтеза в летнее время рН воды всегда является выше, чем в условиях преимущества деструктивных процессов, что приводят до нагромождения СО2 в холодное время года. По этой же причине рН поверхностных слоёв воды является в основном выше, чем придонных. В целом для поверхностных вод суши наиболее характерным является смена концентраций водных ионов в интервале рН 6,8 – 8,5 хотя в некоторых случаях, например, в болотных водах, рН может увеличиваться до 4,5-5.
Природные воды содержат много неорганических и органических ингредиентов, которые способны находится в различных состояниях окисления. Совокупность таких ингредиентов создает определенное окислительно-восстановительное состояние воды, которое характеризуется окислительно-восстановительным потенциалом Еh. Основными ингредиентами, которые влияют на Еh, являются растворенный кислород, соединения железа, марганца и серы, а также некоторые органические вещества. При высоком содержании О2, т.е. в условиях интенсивного фотосинтеза, Еh может достичь величин порядка + 700 мВ. Наоборот, в условиях биохимического окисления органических соединений, в результате чего в воде накапливается СО2 или образуется Н2S, окислительно-восстановительный потенциал может снизиться до – 100 мВ и ниже. В незагрязненных поверхностных водах значение Еh. и рН изменяется, как правило, параллельно, что влияет на состояние и реакционную способность многих ингредиентов. Так, при повышении Еh. и рН воды неорганический азот связывается преимущественно в ионы NO3, сера в SO4-, а марганец и железо образуют твердые соединения MnO2 и Fe(OH)3 или комплексы с неорганическими лигандами. Наоборот, при снижении Еh и рН воды неорганический азот переходит в ионы NH+4 , сера – в HS- , а доминирующими формами марганца и железа становятся ионы Mn2+ и Fe2+ и их комплексы с неорганическими и органическими лигандами.
Главные ионы (солевые компоненты). Хлориды, сульфаты и гидрокарбонаты натрия (калия),Mg и Са поступают в поверхностные воды суши, в основном вследствие растворения в воде различных горных пород, минералов, солей и т.д. Например, Са содержится в природе в основном в виде карбоната во многих минералах (кальцит, мрамор, мел, доломит), далее в виде сульфата (гипс, ангидрид) и, наконец, в породах вулканического происхождения (гранит, базальт), которые на 100 кг породы содержат ~ 4 кг химически связанного Са. Сульфаты Са относительно хорошо растворимы в воде и вместе с сульфатами Мg создают постоянную жесткость воды. Все другие минералы кальция плохо растворимы. Наличие же в природных водах значительного содержания ионов Са2+ и Мg2+ обусловлено образованием в присутствии СО2 хорошо растворимых гидрокарбонатов (см. реакцию № 2).
Наиболее распространённые интервалы концентраций главных ионов следующие (мг/л):
Мg2+ - 0,5 ÷ 50;
Na+ + K+ - 1 ÷ 75;
Ca2+ = 10 ÷ 120
Cl- - 5 ÷ 80;
SO4 – 2 ÷ 120
HCO3- - 10 ÷ 250
Как видим, в поверхностных водах суши доминируют ионы HCO3- и Ca2+, что отвечает гидрокарбонатно-кальциевым водам.
В результате электростатического взаимодействия между катионами и анионами, особенно при повышенных концентрациях, образуются ионные пары, наиболее характерные для карбонатов, гидрокарбонатов и сульфатов Са и Мg. Часть таких ионных пар (ассоциатов) незначительна и для Са, например, изменяется в интервалах:
СаСО30 – 1 ÷ 4 %;
СаНСО3+ - 3 ÷ 5 %;
СаSO40 – 2 ÷ 10 %.
Эти ассоциаты не являются стойкими и поэтому их образование не влияет на результаты аналитического определения главных ионов.
Концентрация главных ионов изменяется в поверхностных водах суши в основном под действием гидрологического фактора – при увеличении водного стока весной их концентрация уменьшается в результате разбавления, а в летне-осенний и зимний периоды, наоборот, увеличивается. Так минерализация воды в верхнем Днепре на протяжении многих лет изменяется в таких пределах (мг/л): весной – 100 – 250, летом – 200 – 340, осенью – 290 – 350 и зимой – 350 – 400.
Изменение рН воды практически не влияет на концентрацию главных ионов, кроме компонентов карбонатной системы
Н2О ОН- ОН-
СО2 ↔ Н2СО3 ↔ НСО-3 ↔ СО32‑ (4)
Н+ Н+
Состояние этого равновесия при различных значениях рН воды можно определить с использованием констант диссоциации угольной кислоты (рис. 3)
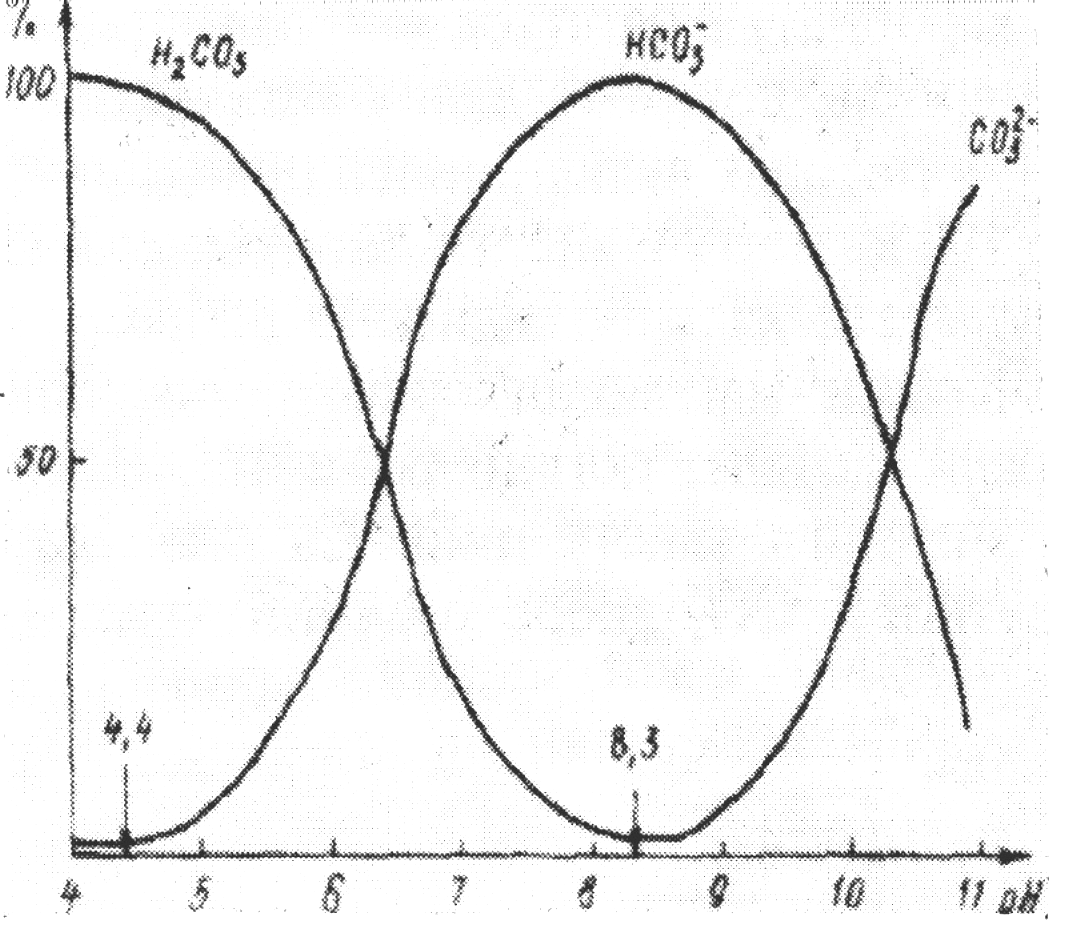
Рис. 3. Состояние равновесия ионов карбонатной системы от рН воды
Из рисунка видно, что для поверхностных вод суши (рН = 6,8 – 8,5) наиболее характерным является образование гидрокарбонатионов. При загрязнении воды кислотами или в результате интенсивных деструктивных процессов может образоваться значительное количество Н2СО3 (СО2), и при этом рН воды уменьшается. При повышении рН до 9 – 11, что имеет место в зонах интенсивного фотосинтеза, или при загрязнении воды соединениями основного характера образуется значительное количество ионов СО32-. Это может привести к уменьшению концентрации ионов Са2+ вследствие выделения в осадок Са СО3.
Биогенные элементы. К биогенным элементам принадлежат Р, N2, Si и Fe в разных соединениях. Они имеют огромное значение для развития живых существ, и их роль в природных водах подобна роли минеральных удобрений в развитии сельскохозяйственных культур.
Азот содержится в природных водах в виде разных неорганических и органических соединений. В органических соединениях N входит главным образом в ионы NH4+, NO2- и NO3-. В органических соединениях N входит главным образом в состав белков и продуктов их разложения – аминокислот, аминов и т.д. («органический азот» Nорг). Неорганические соединения азота («неорганический азот» Nнеорг) усваивается водными растениями в процессе фотосинтеза. Поэтому при интенсивной вегетации концентрация Nнеорг может уменьшатся практически к 0. Напротив, эти соединения появляются в водах при биохимическом разложении азотосодержащих органических соединений. Обратный переход одних соединений азота в другие с перемещением электронов является сложным химическим и биохимическим процессом, какой в общем виде можно отобразить схемой
Растения → животные → продукты разложения (Nорг) → NH4+ → NO2- → NO3- → растения.
Эти процессы являются очень лабильными и многофакторными, поэтому концентрации отдельных форм азота в природных водах изменяются в широких пределах (см. данные) Мг/л.
Таблица 2
