
glava6
.pdf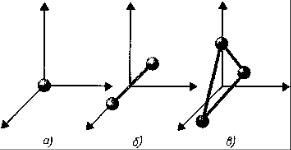
Глава 6
Основы термодинамики
§ 29
Число степеней свободы молекулы. Закон равномерного распределения
энергии по степеням свободы молекул
Внутренняя энергия U – это энергия хаотического движения микрочастиц сис-
темы и энергия взаимодействия этих частиц.
Внутренняя энергия – однозначная функция термодинамического состояния системы, т.е. в каждом состоянии система обладает вполне определенной внут-
ренней энергией.
Число степеней свободы молекулы i – это число независимых переменных (ко-
ординат), полностью описывающих положение системы в пространстве.
В ряде задач молекулу одноатомного газа рассматривают как материальную точ-
ку, которой приписывают три степени свободы поступательного движения (рис.
а). При этом энергию вращательного
движения можно не учитывать ( r → 0 , J = mr2 → 0 , Tвр = Jω2  2 → 0 ).
2 → 0 ).
Система двухатомной молекулы с жесткой связью (рис. б) обладает тремя степенями свободы поступательного движения и двумя степенями свободы вра-
щательного движения. Вращение вокруг третьей оси (ось проходит через оба ато-
ма) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы ( i = 5 ).
Трехатомная (рис. в) и многоатомная нелинейные молекулы имеют шесть степеней свободы ( i = 6 ): три поступательных и три вращательных.
Жесткой связи между атомами в молекулах не существует. Поэтому для ре-
альных молекул необходимо учитывать также степени свободы колебательного движения.

В любой молекуле всегда есть три поступательные степени свободы, при-
чем, ни одна из них не имеет преимущества над другими, поэтому на каждую из них приходится в среднем одинаковая энергия
< ε1 >= < ε0 > = 1 kT . 3 2
Закон Больцмана о равномерном распределении энергии по степеням свобо-
ды молекул: для статистической системы, находящейся в состоянии термодина-
мического равновесия, на каждую поступательную и вращательную степени сво-
боды приходится в среднем кинетическая энергия, равная kT 2 , а на каждую ко-
2 , а на каждую ко-
лебательную степень свободы в среднем энергия, равная kT .
Колебательная степень свободы «обладает» вдвое большей энергией пото-
му, что на нее приходится и кинетическая, и потенциальная энергия, причем,
средние значения их одинаковы. Таким образом, средняя энергия молекулы
< ε >= i kT , 2
где i = iпост + iвращ + 2iколеб .
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Для идеального газа пренебрегаем потенциальной энергией взаимодействия между молекулами, поэтому внутреннюю энергию для одного моля Um можно найти в виде суммы кинетических энергий NA молекул
U |
|
= |
i |
kTN |
|
= |
|
i |
RT. |
(29.1) |
|||||
m |
|
|
|
A |
|
|
|||||||||
|
2 |
|
|
2 |
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||
Внутренняя энергия для произвольной m массы газа |
|||||||||||||||
U = |
m |
|
i |
RT = ν |
i |
RT , |
|
||||||||
|
|
|
|
||||||||||||
|
|
|
M 2 |
|
2 |
|
|
|
|||||||
где M – |
молярная масса, ν – |
количество вещества. |
|||||||||||||
Задача 1. Найдите полную кинетическую энергию 1023 молекул углекисло-
го газа при температуре 273 К.

Дано: |
|
|
|
Решение |
N = 1023 |
Полная кинетическая энергия всех молекул газа равна его |
|||
i = 6 |
внутренней энергии, и она равна |
|||
T = 273 К |
U = N e , |
|||
|
|
|
|
|
U = ? |
где e – |
средняя энергия одной молекулы газа, которая равна |
||
|
e |
= |
i |
kT , |
|
||||
|
|
|||
|
|
2 |
|
|
где k =1,38×10−23 Дж/К – постоянная Больцмана. Подставим это выражение в пер-
вую формулу, получим
U = N i kT. 2
После подстановки числовых значений получаем
U =1023 × 6 ×1,38×10−23 Дж/К×273 К = 1130 Дж. 2
Задача 2. Найдите температуру кислорода, если средняя энергия враща-
тельного движения одной молекулы равна 1,0×10–20 Дж.
Дано: |
|
|
|
Решение |
|
eвр |
=1,0 ×10−20 Дж |
|
Средняя энергия вращательного движения молекулы |
||
iвр = |
2 |
определяется по формуле |
|||
|
|
|
|
||
|
|
|
eвр = |
iвр |
kT, |
T = ? |
|
|
|||
|
|
|
|||
|
|
|
2 |
|
|
|
|
где |
k =1,38 ×10−23 Дж/К – постоянная Больцмана. Выразим |
||
|
|
||||
температуру газа |
|
|
|
||
T = 2 eвр
eвр  .
.
iврk
В полученное равенство подставим числовые значения
T = |
|
2 ×1,0 ×10−20 |
Дж |
= 725 |
К . |
|
×1,38 ×10−23 |
Дж/К |
|||
2 |
|
|
|||

Задача 3. Определите среднее значение полной кинетической энергии од-
ной молекулы углекислого газа при температуре 300 К.
Дано:
T = 300 К
i = 6
 e
e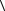 = ?
= ?
значения
Решение
Полная кинетическая энергия одной молекулы газа определяет-
ся по формуле
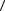 e
e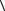 = i kT , 2
= i kT , 2
где k =1,38×10−23 Дж/К – постоянная Больцмана. Подставим числовые
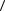 e
e = 6 ×1,38 ×10−23 Дж/К×300 К =1,24 ×1020 Дж. 2
= 6 ×1,38 ×10−23 Дж/К×300 К =1,24 ×1020 Дж. 2
Задача 4. Найдите суммарную кинетическую энергию теплового движения всех молекул азота, занимающих объем 3 л при давлении 2 атм. Колебания не
учитывать. |
|
|
|
|
|
|
|
|
|
|
|
Дано: |
|
СИ |
|
|
Решение |
V = 3 л |
|
0,003 м3 |
Суммарная кинетическая энергия всех молекул газа |
||
p = 2 атм |
|
2×105 Па |
равна его внутренней энергии и определяется по формуле |
||
i = 5 |
|
|
U = n |
i |
RT . |
|
|
|
|
||
|
|
|
2 |
|
|
U = ? |
|
|
|
||
|
|
|
|
|
|
|
|
|
По уравнению Клапейрона-Менделеева pV = νRT , тогда |
||
|
|
|
|||
выражение для внутренней энергии примет вид |
|||||
U = i pV . 2
Подставим числовые значения
U= 5 × 2 ×105 Па×0,003 м3 =1500 Дж . 2
§ 30
Первое начало термодинамики
Рассмотрим термодинамическую систему, для которой механическая энер-
гия не изменяется, а изменяется лишь ее внутренняя энергия.
Внутренняя энергия системы может изменяться либо в результате соверше-
ния системой (над системой) работы, либо в результате теплообмена системы с окружающей средой.
Допустим, что некоторая система, обладающая внутренней энергией U1 ,
получила количество теплоты Q и, перейдя в новое состояние с внутренней энер-
гией U2 , при этом совершила работу A над внешней средой (работа A считается положительной, если она совершается против внешних сил). В результате внут-
ренняя энергия изменилась на величину U = U2 − U1 и это изменение будет рав-
но
U = Q − A ,
или |
|
Q = U + A . |
(30.1) |
Уравнение (30.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Выражение (30.1) в дифференциальной форме будет иметь вид dQ = dU + dA ,
или в более корректной форме |
|
δQ = dU + δA, |
(30.2) |
где dU – бесконечно малое изменение внутренней энергии системы, |
δA – эле- |
ментарная работа, δQ – бесконечно малое количество теплоты. В этом выраже-
нии dU является полным дифференциалом, а δA и δQ таковыми не являются.
Из формулы (30.1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т.е. в джоулях (Дж).

Если система периодически возвращается в исходное состояние, то U = 0 .
Тогда, согласно первому началу термодинамики
A = Q ,
т.е. вечный двигатель первого рода – периодически действующий двигатель,
который совершал бы большую работу, чем сообщенная ему извне энергия – не-
возможен.
§ 31
Работа газа при изменении его объема
δA = Fdl = pSdl = pdV , |
|
где S – площадь поршня, Sdl = dV – |
изменение объ- |
ема системы. Таким образом, |
|
δA = pdV . |
(31.1) |
Полную работу, совершенную газом, в результате |
|
изменения объема от V1 до V2 найдем интегрированием выражения (31.1) |
|
V2 |
|
A = ∫pdV . |
(31.2) |
V1 |
|
Результат интегрирования зависит от характера зависимости между давлением и объемом. Работа со-
вершаемая газом при расширении от объема V1 до
объема V2 определяется площадью, ограниченной осью абсцисс, кривой p = f(V) и прямыми V1 и V2 .
Графически можно изображать только равно-
весные процессы – процессы, состоящие из последо-
вательности равновесных состояний. Они протекают так, что изменение термоди-
намических параметров за короткий промежуток времени бесконечно мало.

§ 32
Теплоемкость
Удельная теплоемкость вещества – величина, равная количеству теплоты, не-
обходимому для нагревания 1 кг вещества на 1 К.
c = δQ , [c] = Дж . |
|
mdT |
кг× К |
Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1К.
C = |
|
δQ |
, |
|
(32.1) |
|
|
|
|
||||
m |
ndT |
|
||||
|
|
|
|
|
|
|
где ν = m M – количество вещества. |
|
|||||
[C ] = |
|
Дж |
. |
|
||
|
|
|
||||
m |
|
|
моль× К |
|
||
|
|
|
|
|||
Удельная теплоемкость c связана с молярной Cm соотношением |
|
|||||
Cm = cM , |
(32.2) |
|||||
где M – молярная масса вещества. |
|
|||||
Различают теплоемкость при постоянном объеме и при постоянном давле-
нии, если в процессе нагревания вещества его объем или давление поддержива-
ются постоянными.
Запишем выражение I начала термодинамики для 1 моля газа
Cm dT = dUm + pdVm . |
(32.3) |
||
Если газ нагревается при Vm = const , то pdVm = δA = 0 , тогда |
|
||
CV = |
dUm |
, |
(32.4) |
|
|||
|
dT |
|
|
т.е. молярная теплоемкость газа при постоянном объеме CV |
равна изменению |
||
внутренней энергии 1 моля газа при повышении его температуры на 1 К. Соглас-
но формулы (29.1)
dUm = i RdT ,
2
тогда

C = |
i |
R . |
(32.5) |
V |
2 |
|
Если газ нагревается при постоянном давлении, то выражение (32.3) можно записать в виде
Cp = dUm + pdVm . dT dT
Учитывая (32.4), и продифференцировав уравнение Клапейрона-Менделеева
pVm = RT по T при p = const , получим |
|
Cp = CV + R. |
(32.6) |
Выражение (32.6) называется уравнением Майера.
Используя выражения (32.5) и (32.6) можно получить равенство
C |
= |
i + 2 |
R . |
(32.7) |
||||
|
|
|||||||
p |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
При рассмотрении термодинамических процессов важно знать характерное |
||||||||
для каждого газа отношение Cp к CV |
|
|||||||
γ = |
Cp |
= |
i + 2 |
. |
(32.8) |
|||
|
|
|||||||
|
|
CV |
|
|
i |
|
||
Из формул (32.5) и (32.7) следует, что |
||||||||
молярная |
|
теплоемкость определяется |
лишь |
|||||
числом степеней свободы и не зависит от |
||||||||
температуры. Это утверждение молекулярно- |
||||||||
кинетической теории справедливо в довольно |
||||||||
широком интервале температур лишь для од- |
||||||||
ноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в
теплоемкости, как показано на рисунке, зависит от температуры.
Теперь приведем таблицу для значений CV , Cp и γ соответствующих раз-
личным молекулам.

Таблица
|
Характер |
|
Число степеней свободы |
|
|
|
|
|
|
|
|
|
||||
молекула |
связи между |
|
|
|
|
|
i |
|
|
CV |
|
|
Cp |
γ |
||
|
поступ. |
вращ. |
колебат. |
|
|
|
|
|
||||||||
|
атомами |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
одноатомная |
– |
|
3 |
– |
– |
3 |
|
3 |
R |
|
5 |
R |
1,67 |
|||
2 |
2 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
жесткий |
|
3 |
2 |
– |
5 |
|
5 |
R |
|
7 |
R |
1,40 |
|||
двухатомная |
2 |
2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
упругий |
|
3 |
2 |
1 |
7 |
|
7 |
R |
|
9 |
R |
1,29 |
||||
|
|
|
|
|||||||||||||
|
2 |
2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
многоатомная |
жесткий |
|
3 |
3 |
– |
6 |
|
6 |
R |
|
8 |
R |
1,33 |
|||
2 |
2 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||||
Задача 1. Найдите число степеней свободы молекул газа, молярная тепло- |
||||||||||||||||
емкость которого при постоянном давлении равна 29 Дж/(моль×К). |
|
|
|
|||||||||||||
Дано: |
|
|
|
|
|
Решение |
|
|
|
|
|
|
|
|
|
|
Cp = 29 Дж/(моль× К) |
Молярная теплоемкость газа при постоянном давле- |
|||||||||||||||
|
|
нии определяется по формуле |
|
|
|
|
|
|
|
|
|
|||||
i = ? |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Cp = i + 2 R , 2
где R = 8,31 Дж/(моль× К) – универсальная газовая постоянная. Выразим отсюда число степеней свободы молекулы
i = 2Cp - 2 .
R
Подставим числовые значения
i = 2 × 29 Дж/(моль×К) - 2 = 5 . 8,31 Дж/(моль× К)
Задача 2. Найдите молярную массу и число степеней свободы молекул иде-
ального газа, если известны его удельные теплоемкости cV = 650 Дж/(кг×К) и
cp = 910 Дж/(кг×К).
Дано: |
|
|
|
|
|
|
|
Решение |
|||
cV = 650 Дж/(кг× К) |
Удельные теплоемкости газа при постоянном объеме |
||||||||||
c = 910 Дж/(кг× К) |
и при постоянном давлении, соответственно, определяются |
||||||||||
p |
|
|
|
|
|
|
|
|
|
|
|
|
по формулам |
|
|
|
|
|
|||||
M = ? i = ? |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
|
= |
i |
|
R |
и c = |
i + 2 |
|
R |
, |
|
|
|
|||||||||
|
V |
|
|
|
|
||||||
|
|
|
2 M |
p |
2 |
|
M |
||||
|
|
|
|
|
|
||||||
где R = 8,31 Дж/(моль× К) – универсальная газовая постоянная. Найдем разность
теплоемкостей
cp - cV = R . M
Отсюда выразим молярную массу газа
M = |
|
R |
|
|
|
. |
|
|
|
||
|
cp |
- cV |
|
В полученное равенство подставим числовые значения
M = |
8,31 |
Дж/(моль × К) |
= 0,032 |
кг/моль . |
|
910 Дж/(кг |
× К) - 650 Дж/(кг × К) |
||||
|
|
|
Выразим из формулы для удельной теплоемкости газа при постоянном объ-
еме число степеней свободы молекулы
i = 2cVM . R
Подставим числовые значения
i = 2 ×650 Дж/(кг× К) ×0,032 кг/моль = 5. 8,31 Дж/(моль× К)
