
glava6
.pdf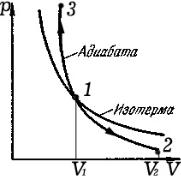
pVγ = const . |
(34.4) |
Полученное выражение есть уравнение адиабатического процесса, назы-
ваемое также уравнением Пуассона.
Для перехода к переменным T, V или p, T, исключив из (34.4) с помощью
уравнения Клапейрона-Менделеева, соответственно давление или объем
TVγ −1 = const , |
(34.5) |
Tγ p1− γ = const . |
(34.6) |
Выражения (34.4) – (34.6) представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина
γ = |
Cp |
= |
cp |
= |
i + 2 |
(34.7) |
|
CV |
cV |
i |
|||||
|
|
|
|
называется показателем адиабаты (коэффициентом Пуассона).
Диаграмма адиабатического процесса (адиабата)
изображена на рисунке. Вычислим работу, совершенную газом в этом процессе. Запишем уравнение (34.2) в виде
δA = − |
m |
C |
dT . |
|
||||
|
|
|
||||||
|
|
M |
V |
|
|
|
|
|
|
|
|
|
|
|
|
||
Если газ адиабатически расширяется от объема V1 |
до V2 , |
|||||||
то его температура уменьшается от T1 до T2 и работа расширения идеального газа |
||||||||
|
|
|
|
T2 |
|
|||
A = − |
m |
CV ∫ dT = |
m |
CV (T1 − T2 ) . |
(34.8) |
|||
|
|
|||||||
|
M |
|
|
M |
|
|||
|
|
|
|
T1 |
|
|||
Применяя те же приемы, что и при выводе формулы (34.5), выражение
(34.8) для работы при адиабатическом расширении можно преобразовать к виду
|
p V |
|
|
V |
γ −1 |
|
|
RT m |
|
|
V |
γ −1 |
|
||
A = |
1 1 |
1 |
− |
1 |
|
|
= |
1 |
|
|
1 |
− |
1 |
|
, |
γ −1 |
|
γ −1 M |
|
||||||||||||
|
|
V |
|
|
|
|
V |
|
|
||||||
|
|
|
2 |
|
|
|
|
|
|
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где p1V1 = (m M)RT1 .
M)RT1 .
Процессы, в которых теплоемкость остается постоянной, называются политроп-
ными.
Исходя из I начала термодинамики при условии постоянства теплоемкости
( C = const ) можно вывести уравнение политропы
pVn = const , |
(34.9) |
где n = (C −Cp )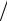 (C −CV ) – показатель политропы. Очевидно, что из (34.9) при
(C −CV ) – показатель политропы. Очевидно, что из (34.9) при
C = 0 , |
n = γ |
– |
получаем уравнение адиабаты; |
C = ∞, |
n =1 |
– |
уравнение изотермы; |
C = Cp , n = 0 |
– |
уравнение изобары; |
|
C = CV , n = ±∞ – |
уравнение изохоры. |
||
Таким образом, все рассмотренные изопроцессы являются частными слу-
чаями политропного процесса.
Задача 1. Два моля гелия, находившегося при температуре 300 К, адиабати-
чески сжали так, что его давление возросло в 8 раз. Найдите температуру газа по-
сле сжатия и работу, совершенную над газом.
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
ν = 2 моля |
|
|
|
|
|
Запишем уравнение адиабатического процесса через давле- |
||||||||||||||
i = 3 |
|
|
|
ние и температуру |
|
|
|
|
|
|||||||||||
T1 = 300 К |
|
|
|
|
|
Tγp1−γ |
= Tγp1−γ . |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
1 |
1 |
|
2 |
|
2 |
|
|
|
|
||
p2 p1 = 8 |
|
Преобразуем равенство, переведя температуры в левую часть, а |
||||||||||||||||||
|
|
|
|
давления – |
|
|
|
|
|
|
|
|||||||||
T2 = ? |
A = ? |
|
в правую |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
T |
|
γ |
p |
1−γ |
p |
2 |
γ−1 |
|||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
= |
1 |
|
|
= |
|
. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
p1 |
|
|||||
Выразим отсюда конечную температуру |
|
|
||||||||||||||||||
|
|
|
p |
|
|
γ−1 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
T = T |
2 |
γ |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
2 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где γ – |
показатель адиабаты, который равен |
|||||||||||||||||||
|
γ = |
i + 2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
i

Выразим степень полученного равенства через число степеней свободы
γ −1 |
= |
(i + 2 − i)i |
= |
2 |
||
g |
|
i(i + 2) |
i + 2 |
|||
|
|
|||||
Тогда формула для конечной температуры будет иметь следующий вид
|
|
|
|
2 |
|
|
|
p |
|
|
|
|
|
|
2 |
i+2 |
||||
T2 |
|
|
|
|||
|
|
|||||
= T1 |
|
. |
||||
|
p1 |
|
||||
Подставим числовые значения
T2 = 300 К×82 (3+2) = 698 К .
(3+2) = 698 К .
Работу, совершенную над газом в адиабатическом процессе, определим по
формуле
A = CVν(T2 −T1 ) ,
где CV – молярная теплоемкость газа при постоянном объеме, которая равна
CV = i R . 2
С учетом этого работа будет равна
A = i nR(T2 - T1 ) . 2
Подставим числовые значения
A= 3 × 2 моля×8,31 Дж/(моль× К) ×(698 К - 300 К) = 9700 Дж. 2

Задача 2. При адиабатическом сжатии 2 кг углекислого газа была затрачена работа 150 кДж. Найдите конечную температуру газа, если он в начале находился
при температуре 273 К. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дано: |
СИ |
|
|
|
|
|
Решение |
m = 2 кг |
|
Работа адиабатического сжатия газа опре- |
|||||
M = 0,044 кг/моль |
|
деляется по формуле |
|||||
i = 6 |
|
A = C |
m |
(T - T ) , |
|||
|
|
|
|||||
A =150 кДж |
1,5×105 Дж |
|
|
V M 2 1 |
|||
T1 = 300 К |
|
где CV – |
молярная теплоемкость газа при посто- |
||||
|
|
|
|
|
|
|
|
|
|
янном объеме, равная |
|||||
T2 = ? |
|
||||||
|
|
|
|
|
|
|
|
|
|
C |
= |
i |
R . |
||
|
|
||||||
|
|
|
|||||
|
|
V |
2 |
|
|
|
|
|
|
|
|
|
|
||
Подставим выражение для теплоемкости в формулу для работы, получим
A = i m R(T2 - T1) . 2 M
Отсюда выразим температуру газа после сжатия
T = |
2AM |
+ T . |
|
|
|
|
|
|
|
||
2 |
imR |
1 |
|
|
|
|
|
|
|
|
|
Подставим числовые значения |
|
|
|
||
T = |
2 ×1,5 ×105 Дж×0,044 кг/моль |
+ 273 |
К = 405 |
К . |
|
|
|
||||
2 |
6 × 2 кг×8,31 Дж/(моль× К) |
|
|
|
|
|
|
|
|
||
Задача 3. Некоторую массу водорода сжали в 6 раз один раз адиабатически,
другой раз изотермически. Начальное состояние газа в обоих случаях одинаково.
Найдите отношение работы, затраченной на сжатие при адиабатическом процессе,
к соответствующей работе при изотермическом процессе.
Дано: |
Решение |
|
γ =1,4 |
На рисунке изображены графики двух процессов, совершае- |
|
V1 |
V2 = 6 |
мых над газом. Процесс 1–2 соответствует адиабатическому сжа- |
|
|
тию, процесс 1–3 показывает изотермическое сжатие. |
A |
A = ? |
|
12 |
13 |
|
|
|
|

Работа, которая совершается над газом при адиабатическом сжатии, определяется формулой
|
m RT |
|
V |
|
γ−1 |
|
|
|||
A = |
|
|
−1 , |
|
||||||
|
|
1 |
|
|
1 |
|
|
где |
||
M γ −1 |
|
|
||||||||
12 |
V |
|
|
|
|
|||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m– масса газа, M – молярная масса, R –
универсальная газовая постоянная.
Работа, совершаемая над газом при изотермическом сжатии равна
|
|
= |
m |
|
|
V |
|
A |
23 |
|
RT ln |
1 |
. |
||
|
|
||||||
|
|
M |
1 |
|
V2 |
|
|
|
|
|
|
|
|
||
Найдем отношение работы, затраченной на сжатие при адиабатическом процессе,
к соответствующей работе при изотермическом процессе
|
A |
= |
(V V )γ−1 |
−1 |
||||||||
|
12 |
1 |
|
2 |
|
|
|
|
. |
|||
|
A |
23 |
|
(γ −1) ln(V V ) |
||||||||
|
|
|
|
|
1 |
|
2 |
|
||||
Подставим числовые значения |
||||||||||||
|
A |
= |
(6)1,4−1 −1 |
=16 . |
||||||||
|
12 |
|
|
|
|
|
|
|||||
|
A23 |
(1,4 −1) ln 6 |
||||||||||
|
|
|
|
|
||||||||
Задача 4. Двухатомный идеальный газ совершает процесс, описываемый |
||||||||||||
уравнением pV2,5 |
= const. Найдите молярную теплоемкость газа в этом полит- |
|||||||||||
ропном процессе. |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Дано: |
|
|
|
|
|
|
|
|
|
|
Решение |
|
i = 5 |
|
|
Запишем формулу для показателя политропы |
|||||||||
n = 2,5 |
|
|
n = |
C −Cp |
, |
|||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
C −CV |
||||||
C = ? |
|
|
|
|
|
|||||||
|
|
где C = |
i + 2 |
R – молярная теплоемкость газа при постоянном давлении, |
||||||||
|
|
|||||||||||
|
|
|
||||||||||
|
|
|
|
p |
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
CV = i R – молярная теплоемкость газа при постоянном объеме. 2
Выразим из формулы для показателя политропы молярную теплоемкость газа в рассматриваемом процессе
C = nCV −Cp . n -1
В полученную формулу подставим выражения для Cp и CV
C = niR - (i + 2)R = (n -1)i - 2 R. 2(n -1) 2(n -1)
Подставим числовые значения
C = (2,5 -1) ×5 - 2 ×8,31 Дж/(моль×К) = 15,2 Дж/(моль× К) . 2 ×(2,5 -1)
§ 35
Круговой процесс (цикл). Обратимые и необратимые процессы
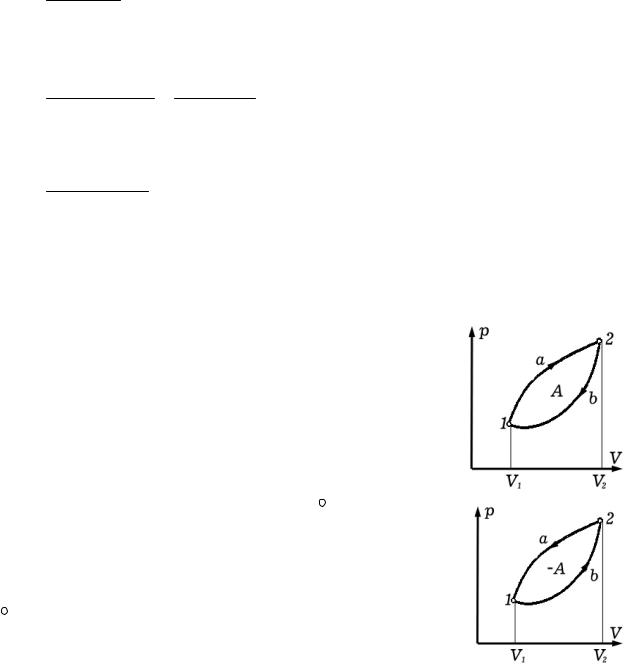
Круговым процессом (циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное.
Работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Если за цикл
совершается |
положительная работа |
A = ∫pdV > 0 |
(цикл |
|
протекает по часовой стрелке), то он называется прямым. |
||||
Если |
за |
цикл совершается |
отрицательная |
работа |
A = ∫pdV < 0 |
(цикл протекает против часовой стрелки), то |
|||
он называется обратным.
Прямой цикл используется в тепловых двигателях, а обратный – в холо-
дильных машинах.
Первое начало термодинамики для цикла можно записать в следующем ви-
де ( U = 0 )

Q = U + A = A . |
(35.1) |
Однако, в результате цикла система может теплоту, как получать, так и отдавать,
поэтому
Q = Q1 − Q2 ,
где Q1 – количество теплоты, полученное системой, Q2 – количество теплоты, от-
данное системой. Поэтому термический коэффициент полезного действия для
кругового процесса
η = |
A |
= |
Q1 − Q2 |
= 1− |
Q2 |
. |
(35.2) |
|
|
|
|||||
|
Q1 |
|
Q1 |
|
Q1 |
|
|
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс сначала происходит в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит ни-
каких изменений.
Всякий процесс, не удовлетворяющим условиям обратимого, является необрати-
мым.
Обратимые процессы – это идеализация реальных процессов.
§ 36
Энтропия, ее статистическое толкование
и связь с термодинамической вероятностью
Отношение теплоты Q, полученной телом в изотермическом процессе, к темпера-
туре T теплоотдающего тела, называется приведенным количеством теплоты.
Для любого обратимого кругового процесса
∫ T |
(36.1) |
δQ = 0 . |
Из равенства нулю интеграла (36.1) следует, что подынтегральное выраже-
ние δQ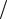 T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это со-
T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это со-
стояние. Таким образом,
δQ = dS . |
(36.2) |
T |
|
Функция состояния, дифференциалом которой является δQ T , называется энтро-
T , называется энтро-
пией и обозначается S.
Из формулы (36.1) следует, что для обратимых процессов изменение энтро-
пии |
|
DS = 0 . |
(36.3) |
В термодинамике доказывается, что энтропия системы, совершающей необрати-
мый цикл, возрастает
DS > 0 . |
(36.4) |
Выражения (36.3) и (36.4) относятся только к замкнутым системам, если
же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Соотношения (36.3) и (36.4) можно представить в виде не-
равенства Клаузиуса
DS ³ 0 , |
(36.5) |
т.е. энтропия замкнутой системы может либо возрастать, либо оставаться посто-
янной.
Если система совершает равновесный переход из состояния 1 в состояние 2,
то, согласно I начала термодинамики, изменение энтропии равно
S |
= S − S = |
2 |
δQ = |
2 |
dU + δA |
. |
(36.6) |
∫ |
∫ |
|
|||||
1→2 |
2 1 |
T |
T |
|
|||
|
|
|
|
|
|
||
|
|
1 |
|
1 |
|
|
|
Формула (36.6) определяет энтропию лишь с точностью до аддитивной постоян-
ной. Физический смысл имеет не сама энтропия, а разность энтропий.
Исходя из выражения (36.6), найдем изменение энтропии в процессах иде-
ального газа. Так как
dU = |
m |
C |
|
dT и δA = pdV = |
m |
RT |
dV |
, то |
||||||||
|
V |
|
|
|
|
|||||||||||
|
M |
|
|
|
|
|
M |
|
V |
|
||||||
|
|
|
|
|
|
|
|
|
||||||||
S1→2 = S2 − S1 = |
m |
T2 |
dT |
+ |
m |
V2 dV |
|
|||||||||
|
CV T∫ |
|
|
RV∫ |
|
, |
||||||||||
M |
T |
M |
V |
|||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
или

S1→2 = S2 − S1 = |
m |
|
T2 |
+ Rln |
V2 |
|
|
|
|
|
, |
(36.7) |
|||||
|
CV ln |
|
|
|
||||
|
T1 |
V1 |
||||||
|
M |
|
|
|
|
|
||
т.е. изменение энтропии |
S1→2 идеального газа при переходе его из состояния 1 в |
|||||||
состояние 2 не зависит от вида процесса перехода 1 – 2 . |
|
|||||||
Так как для адиабатического процесса δQ = 0 , то |
S = 0 и, следовательно, |
|||||||
S = const , т.е. адиабатический обратимый процесс протекает при постоянной эн-
тропии. Поэтому его часто называют изоэнтропийным процессом. Из формулы
(36.7) следует, что при изотермическом процессе (T1 = T2 )
S= m Rln V2 , M V1
при изохорном процессе ( V1 = V2 )
S= m CV ln T2 . M T1
Энтропия обладает свойством аддитивности: энтропия системы равна сум-
ме энтропий тел, входящих в систему
n
S = ∑Si .
i=1
Более глубокий смысл энтропии вскрывается в статистической физике, эн-
тропия связывается с термодинамической вероятностью состояния системы.
Термодинамическая вероятность W состояния системы – это число способов,
которыми может быть реализовано данное состояние макроскопической системы,
или число микросостояний, осуществляющих данное макросостояние ( W ³ 1).
Согласно Больцману, энтропия S системы и термодинамическая вероят-
ность связаны между собой следующим образом
S = k ln W . |
(36.8) |
Следовательно, энтропия может рассматриваться как мера вероятности состоя-
ния термодинамической системы.
По Больцману: энтропия является мерой неупорядоченности системы.
Все процессы в реальной замкнутой системе ведут к увеличению ее энтро-
пии – принцип возрастания энтропии.

Задача 1. Найдите изменение энтропии при изотермическом расширении
азота массой 14 г от объема 20 л до объема 80 л.
Дано: |
|
|
СИ |
|
|
|
|
|
Решение |
||||
M = 0,028 кг/моль |
|
|
|
|
Изменение |
|
энтропии при изотермическом |
||||||
m =14 г |
|
0,014 кг |
процессе определяется по формуле |
||||||||||
V1 = 20 л |
|
0,02 м3 |
DS = |
m |
Rln |
V2 |
. |
|
|
||||
|
|
|
|
|
|
|
|
|
|||||
V2 = 80 л |
|
0,08 м |
3 |
|
M |
|
V1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
Подставим числовые значения |
|||||||
S = ? |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,08 м3 |
||||
|
0,014 кг |
|
|
|
|
|
|||||||
DS = |
|
|
|
×8,31 Дж/(моль× К) ×ln |
|
|
|
|
= 5,7 Дж/К . |
||||
|
|
|
|
|
|
3 |
|||||||
|
0,028 кг/моль |
|
|
|
|
0,02 м |
|
||||||
|
|
|
|
|
|
|
|||||||
Задача 2. Найдите приращение энтропии двух молей углекислого газа при увеличении его абсолютной температуры в 1,5 раза, если процесс нагревания изо-
хорный. Газ считать идеальным.
Дано: |
|
|
|
|
|
Решение |
ν = 2 моля |
Изменение энтропии при изохорном процессе равно |
|||||
i = 6 |
DS = |
m |
CV ln |
T2 |
, |
|
|
|
|
||||
T2 T1 =1,5 |
|
M |
|
T |
||
|
|
|
1 |
|
||
|
|
|
|
|
||
|
где m M = ν – |
количество вещества, CV – молярная теплоемкость |
||||
S = ? |
||||||
|
газа при постоянном объеме, которая определяется по формуле |
|||||
|
||||||
CV = i R . 2
Подставим в формулу для изменения энтропии выражение для молярной тепло-
емкости, и отношение массы газа к молярной массе заменим на количество веще-
ства, тогда получим
DS = |
i |
T |
|
|
|
|
2 |
|
|
|
|
|||
2 nRln |
T |
. |
||
|
|
|
1 |
|
Подставим числовые значения
DS = 6 × 2 моля×8,31 Дж/(моль× К) ×ln1,5 = 20 Дж/К.
2
