
glava6
.pdf
Задача 3. Найдите изменение энтропии при изобарном расширении гелия
массой 2 г от объема 10 л до объема 20 л.
Дано: |
СИ |
i = 3 |
|
M = 0,004 кг/моль |
|
m = 2 г |
0,002 кг |
V =10 л |
0,01 м3 |
1 |
|
V = 20 л |
0,02 м3 |
2 |
|
|
|
S = ? |
|
|
|
Решение
Изменение энтропии при изобарном расши-
рении газа определяется по формуле
DS = |
m |
T |
+ Rln |
V |
|
|
|
|
|
2 |
2 |
|
, |
||
|
|
|
|||||
|
CV ln |
T1 |
V1 |
|
|||
|
M |
|
|
|
|||
где CV – молярная теплоемкость газа при постоян-
ном объеме, которая определяется выражением
C V |
= |
i |
R . |
|
|||
|
2 |
|
|
Для определения отношения температур запишем закон Гей-Люссака
V1 = V2
T1 T2
и выразим это отношение
T2 = V2 .
T1 V1
С учетом всего вышесказанного изменение энтропии будет равно
|
m |
|
|
|
V2 |
|
|
|
|
i + 2 m |
|
V2 |
|
||
DS = |
i |
+ Rln |
V2 |
= |
|
|
|||||||||
|
|
|
Rln |
|
|
|
|
|
|
Rln |
|
. |
|||
M |
2 |
V |
V |
2 |
M |
V |
|||||||||
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
|
1 |
|
Подставим числовые значения |
|
|
|
|
|
||
|
(3 + 2) ×0,002 кг |
|
|
0,02 м3 |
|
||
DS = |
|
×8,31 |
Дж/(моль× К) ×ln |
|
|
|
= 7,2 Дж/К . |
|
|
3 |
|||||
|
2 ×0,004 кг/моль |
|
|
0,01 м |
|
|
|
|
|
|
|
|
|
||
§ 37
Второе начало термодинамики
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Кроме того, можно представить множество процессов, не противоре-
чащих I началу, в которых энергия сохраняется, а в природе они не осуществля-
ются. Появление II начала термодинамики – это необходимость дать ответ на во-
прос, какие процессы в природе возможны, а какие нет – определяет направление развития процессов.
Второе начало термодинамики можно сформулировать как закон возраста-
ния энтропии замкнутой системы при необратимых процессах: любой необрати-
мый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Можно дать более краткую формулировку II начала термодинамики: в про-
цессах, происходящих в замкнутой системе, энтропия не убывает.
Укажем еще две формулировки второго начала термодинамики.
По Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквива-
лентную работу.
По Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Первые два начала термодинамики дают недостаточные сведения о поведе-
нии термодинамических систем при нуле Кельвина. Они дополняются третьим началом термодинамики или теоремой Нернста– Планка: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к ну-
лю Кельвина
lim S = 0 .
T→0
Из теоремы Нернста– Планка следует, что Cp = CV = 0 при T → 0 .
§ 38
Тепловые двигатели и холодильные машины. Цикл Карно и его КПД для
идеального газа
Термодинамическая система, которая может обмениваться теплотой с телами без изменения температуры, называется термостатом.
Принцип действия тепловой машины приведен на ри-
сунке. От термостата с более высокой температурой T1 , назы-
ваемого нагревателем, за цикл отнимается количество теп-
лоты Q1 , а термостату с более низкой температурой T2 , назы-
ваемому холодильником, за цикл передается количество те-
плоты Q2 , при этом совершается работа A = Q1 − Q2 .
Чтобы η = 1, должно быть выполнено условие Q2 = 0 , т.е. тепловой двига-
тель должен иметь один источник теплоты, а это невозможно. Карно (1796–1832)
показал, что для работы теплового двигателя необходимо не менее двух источни-
ков теплоты, с различными температурами, иначе это приводило бы к противоре-
чию второго начала термодинамики.
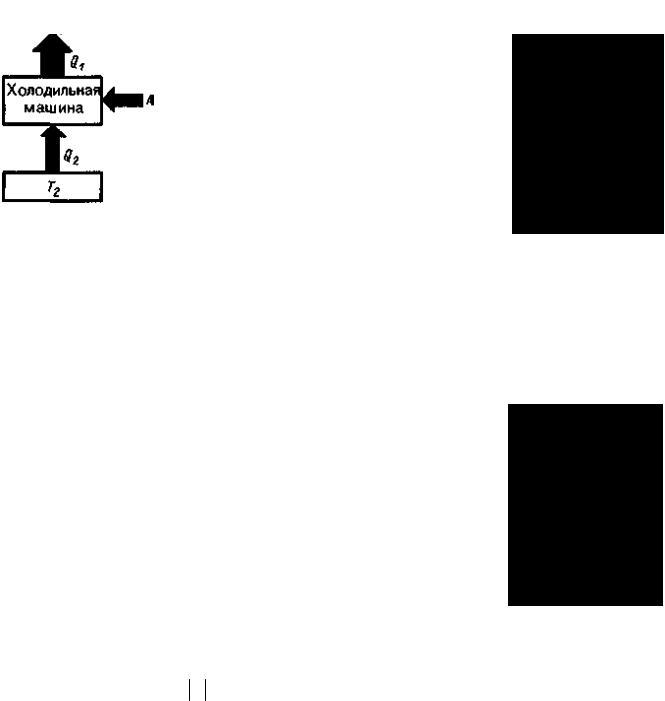
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине, принцип действия которой представлен на рисунке. Система за цикл от термостата с более низкой температурой T2 отнимает количество теплоты Q2 и отдает термостату с более высокой температурой T1 количество теплоты Q1 . Для кругового
процесса Q = A , но, по условию, Q = Q2 − Q1 < 0 , поэтому A < 0 и Q2 − Q1 = A ,
или Q1 = Q2 − A = Q2 + A , т.е. количество теплоты Q1 , отданное системой источ-
нику теплоты с более высокой температурой T1 , больше количества теплоты Q2 ,
полученного от источника теплоты с более низкой температурой T2 , на величину работы, совершенной над системой. Следовательно, без совершения работы нель-
зя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому.

Теорема Карно: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей T1 и холодильников T2 , наибольшим КПД обладают обратимые машины; при этом КПД обратимых машин, работающих при одинаковых T1 и T2 , равны друг другу и не зависят от природы рабочего тела.
Наиболее экономичным обратимым циклом является цикл, состоящий из двух изотерм и двух адиабат, и называемый циклом Карно. Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуде с подвижным поршнем.
Цикл Карно изображен на рисунке, где изотермические расширение и сжатие заданы
соответственно кривыми 1–2 и 3–4 , а адиабатические расширение и сжатие – кри-
выми 2–3 и 4–1 . При изотермическом процессе U = const , поэтому, количество теплоты Q1 , полученное от нагревателя, равно работе расширения A12 , совершае-
мой газом при переходе из состояния 1 в состояние 2
A |
= |
m |
RT ln |
V2 |
= Q . |
(38.1) |
|
|
|||||
12 |
|
M |
1 |
V1 |
1 |
|
|
|
|
|
|
При адиабатическом расширении 2–3 теплообмен с окружающей средой отсутст-
вует, и работа расширения A23 совершается за счет изменения внутренней энер-
гии
A23 = − m CV (T2 −T1 ) .
M
Количество теплоты Q2 , отданное газом холодильнику при изотермическом сжа-
тии, равно работе сжатия A34
A |
= |
m |
RT ln |
V4 |
= −Q . |
(38.2) |
|
|
|||||
34 |
|
M |
2 |
V3 |
2 |
|
|
|
|
|
|
Работа адиабатического сжатия
A41 = − m CV (T1 −T2 ) = −A23 .
M
Работа, совершаемая в результате кругового процесса
A = A12 + A23 + A34 + A41 = Q1 + A23 −Q2 − A23 = Q1 −Q2 .
Термический КПД цикла Карно равен
h = |
A |
= |
Q1 −Q2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Q1 |
|
|
|
Q1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Применив уравнение (34.5) для адиабат 2–3 |
и 4–1 , получим |
|
||||||||||||||||||||||||||
T Vγ−1 |
= T Vγ−1 |
, T Vγ−1 |
= T Vγ−1 |
, |
|
|
|
|
|
|
|
|||||||||||||||||
1 |
2 |
|
2 |
3 |
|
1 |
1 |
|
|
|
2 |
4 |
|
|
|
|
|
|
|
|
|
|
||||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 |
= |
V3 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(38.3) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
V1 |
|
|
V4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Подставляя (38.1) и (38.2) в формулу (35.2) и учитывая (38.3), получим |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
m |
RT ln |
V2 |
- |
m |
RT ln |
V3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
Q1 - Q2 |
|
M |
1 |
|
V1 |
|
M |
2 |
V4 |
|
T1 - T2 |
|
|
||||||||||||
h = |
= |
|
|
|
|
|
= |
, |
(38.4) |
|||||||||||||||||||
|
|
|
m |
|
|
|
V2 |
|
|
|||||||||||||||||||
|
|
|
|
|
Q |
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
RT1 ln |
|
|
|
1 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
V1 |
|
|
|
|
|
|
|||
т.е. для цикла Карно КПД действительно определяется только температурами на-
гревателя и холодильника.
Задача 1. Идеальный газ совершает цикл Карно. Работа газа при изотерми-
ческом расширении равна 6 Дж. Найдите работу газа при изотермическом сжатии,
если КПД цикла равен 17%.
Дано: |
|
|
|
Решение |
A1 = 6 Дж |
|
КПД цикла определяется по формуле |
||
η =17% |
|
h = |
Q1 −Q2 |
×100% , |
|
|
|
||
|
|
|
Q1 |
|
A2 = ? |
|
|
||
|
|
|
|
|
|
где |
Q1 – количество теплоты, получаемое газом за цикл от |
||
|
||||
нагревателя; Q2 |
– количество теплоты, отдаваемое газом холодильнику. |
|||
Цикл Карно состоит из двух изотермических и двух адиабатических процессов. Газ получает от нагревателя теплоту при изотермическом расширении,
которая, согласно первому началу термодинамики, равна

Q1 = A1 ,
так как изменение внутренней энергии в изотермическом процессе равно нулю.
Идеальный газ отдает теплоту при изотермическом сжатии. Эта теплота равна
Q2 = A2 .
Тогда КПД цикла Карно равно
h = A1 − A2 ×100% .
A1
Выразим работу изотермического сжатия
A = A |
|
- |
|
h |
= A |
100% - h |
||
1 |
|
|
|
|
. |
|||
|
|
100% |
||||||
2 1 |
|
|
100% |
1 |
|
|||
Подставим числовые значения
A2 = 6 Дж×100% −17% = 5 Дж . 100%
Задача 2. Идеальный газ совершает цикл Карно. Температура нагревателя в
5 раза больше температуры холодильника. Какую часть количества тепла, полу-
чаемого за один цикл от нагревателя, газ отдает холодильнику?
Дано: |
|
|
|
Решение |
|||
|
T1 |
|
= 5 |
КПД любого цикла определяется выражением |
|||
|
T2 |
h = |
Q1 − Q2 |
×100% . |
|||
|
|
||||||
|
|
|
|
||||
|
|
|
|
|
|
||
|
Q |
= ? |
|
Q1 |
|||
|
2 |
|
|
|
|
||
|
Q1 |
Для цикла Карно КПД можно определить по формуле |
|||||
|
|
||||||
|
|
|
|
h = |
T1 − T2 |
×100% . |
|
|
|
|
|
|
|||
|
|
|
|
|
T1 |
||
Тогда для цикла Карно можно записать
Q1 − Q2 = T1 − T2 или Q2 = T2 .
Q1 |
T1 |
Q1 T1 |
Подставим числовое значение отношения температур
Q2 = 1 .
Q1 5

Задача 3. Идеальный газ совершает цикл Карно. Температура нагревателя равна 500 К, температура холодильника равна 290 К. При изотермическом расши-
рении газ совершает работу 150 Дж. Найдите КПД цикла и количество тепла, ко-
торое газ отдает холодильнику при изотермическом сжатии.
Дано: |
|
|
|
|
Решение |
|
T1 = 500 К |
КПД цикла Карно можно определить по формуле |
|||||
T = 290 К |
h = |
T1 |
−T2 |
×100% . |
||
2 |
|
|
||||
|
T1 |
|||||
A1 =150 Дж |
|
|
|
|
||
|
|
|
|
|
||
|
Подставим числовые значения |
|||||
η = ? Q2 = ? |
||||||
|
|
|
|
|
||
|
h = |
500 К −290 К |
×100% = 42% . |
|||
|
||||||
|
|
|||||
500К
Сдругой стороны, КПД этого цикла можно определить выражением
h = A1 − A2 ×100% .
A1
Выразим отсюда работу газа при изотермическом сжатии
A = A |
|
- |
|
h |
= A |
100% - h |
||
1 |
|
|
|
|
. |
|||
|
|
100% |
||||||
2 1 |
|
|
100% |
1 |
|
|||
Поскольку при этом процессе Q2 = A2 , то можно записать, что
Q2 = A1 100% −η . 100%
Подставим числовые значения
Q2 = 150 Дж×100% −42% = 87 Дж. 100%
