
- •2. Обратные реакции- реакции протекающие в прямом и обратном направлениях.
- •2. Растворы- гомогенные смеси переменного состава.
- •2. Слабые электролиты- электролиты той диссоциции которых в растворах меньше еденицы и уменьшается с ростом концентрации(вода, некоторые кислоты, основаия ****-элементов)
- •2.Сильные электролиты- электролиты, * которых в растворах равна 1 и почти не зависит от концентрации раствора.
- •2. Измерение электронных потенциалов: с помощью нвэ и спомощью электродов сравнения
- •2. Полярная связь – один из атомов сильнее притягивает электрон, электронная пара при этом смещается в сотрону эотго атома.Эо- характеристика полярности связи.
- •2. Сильные электролиты- электролиты, ,* которых в растворах равна 1 и почти не зависит от концентрации раствора
Б-1 1. ОВР- реакция идущая с изменением степени окисления.
Восстановитель- в-во отдающие свои электроны в процессе реакции. (В-ва имеющие малую ЭО-Me;H2;С2; анионы, атомы которых находятся в низкой СО – Cl, H 2PO4, углеводороды, азотоводороды, бороводороды)
Окислитель- в-во принимающее электроны(простые в-ва, атомы которых имеют высокую ЭО, например, галогены и кислород, соединения кислорода- пероксид; соединения благородных газов- KrF6; катионы и анионы, содержащие атомы с высокой СО- Fe, Pb, Ce, NO3, CrO4, ClO4)
Метод электронного баланса: УЧИТЫВАЮТСЯ
Сумма электронов, отдаваемых всеми восстановителями, которая равна сумме электронов, принимаемых всеми окислителями
Число одноименных атомов левой части, равна правой
Число молекул воды или ионов гидроксидов
Стадии:
Установление исходных в-в и продуктов реакций
Определить СО элементов в исходных в-вах и продуктах реакции
Определить число электронов, отдаваемых восстановителем и принимаемых окислителем, и коэффициент при восстановителях и окислителях
Определить коэффициент при всех исходных в-вах и продуктах реакций, исходя из баланса атомов в правой и в левой части.
2. Кинетическое уравнение хим. реакции
![]()
![]()
![]() B
и D
B
и D
К- константа скорости реакции. Не зависит: От концентрации реагентов
Зависит: От их природы и температуры
Размерность К зависит от порядка реакции.
Мерой неупорядочности состояния системы служит термодинамическая функция- ЭНТРОПИЯ
![]() R-
молярная постоянная
R-
молярная постоянная
W- термодинамическая вероятность системы
Мерой вероятности благоприятных соударений является энтропия активации. Для того чтобы активные молекулы прореагировали при соударении, оно должно быть пространственно благоприятно.
Благоприятное. Неблагоприятное
![]()
K-это число благоприятных соударений
активных молекул гарантированно приводящих
к реакции
Б-2 1. Атом- часть элемента обладающая всеми свойствами данного вещества.
Молекула наименьшая частица вещества,, сохраняющая все свойства данного вещества. Эквивалент- такое количество вещества, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Моль- количество вещества системы, которое содержит столько определенных структурных элементов(молекул, атомов, ионов) сколько атомов содержится в 0,012 кг углерода. Валентность- способность атома данного элемента присоединять к себе определенное количество атомов водорода.
Постоянства свойства: Каждое химически чистое соединение всегда имеет один и тот же количественный состав независимо от способа его получения.
Кратных отношений: Предложен Дамтоном- если два элемента образуют между собой несколько различных соединений, то на одну и туже массу одного из них приходится такие массы другого, которые относятся между собой, как простые целые числа.
Эквивалентов: Предложил Рихтер- Все вещества реагируют в эквивалентных отношениях.
Авагадро: В равных объемах любых газов, взятых при одной и той же температуре и при одинаковых давлениях, содержится одно и то же количество молекул.
2. Обратные реакции- реакции протекающие в прямом и обратном направлениях.
Хим. равновесие- энтальпийный и энтропийный факторы уравнены.
![]() -условие
равновесия.
-условие
равновесия.
Химическая реакция имеет динамический характер. Скорость реакции в прямом направление равна скорости в обратном направлении.
Коэффициент химической реакции равен-
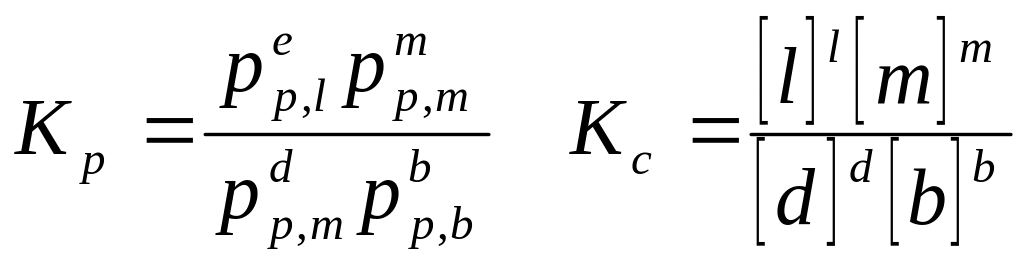
![]()
Смещение равновесия- процесс изменения концентрации, вызванный нарушением равновесия.
Б-3 1.Электронные оболочки расщеплены на под оболочки. Для характеристики поведения электронов в атоме, введены квантовые числа:
Главное квантовое число- определяет энергию и размеры электронных орбиталей. Чем выше орбиталь, тем выше энергия.
Орбитальное квантовое число- определяет форму атомной орбитали.
Магнитное квантовое число- характеризует ориентацию орбитали в пространстве.
Спиновое квантовое число- каждый электрон характеризуется собственным механическим моментом движения, который получил название спина. Проекция спины:******88
В 1925 Паули постулировал принцип запрета:
В атоме не может быть двух электронов, обладающих одним и тем же набором квантовых чисел n, l, m на каждой орбитали не может быть более двух электронов с антипараллельными спинами.
2. Химические реакции протекающие на грани раздела фаз называются гетерогенными химическими реакциями. Если скорости прямой и обратной гетерогенной химической реакции становятся одинаковыми, то наступает химическое равновесие в гетерогенной системе.
Примеры:
а) Пароводородная конверсия углерода
C(k) + 2H2O=CO2 +2H2
б) Термическое разложение СаСО3
CaCO3(к) = CaO(к) +CO2
Раздел химии, изучающий скорости химических реакций, называется химической кинетикой.
Скоростью гетерогенной реакции называется количество вещества, вступившего в реакцию или образующего при реакции за единицу времени, на единицу площади поверхности фазы (площадь поверхности фазы измерить трудно, поэтому скорость гетерогенной реакции относят не к единице площади поверхности, а к единице массы или объема твердой фазы.
Б-4 1. Формула:
1s2;2s2;2p6;3s2;3p6;4s2;3d10;4p65s2;4d10;5p6;6s2;4f14;5d10;6p6;7s2;5f14;6d10;7p6
Распределение валентных электронов
1 |
Ns1 |
Ns1(n-1)d10 |
2 |
Ns2 |
Ns2(n-1)d10 |
3 |
Ns2np1 |
Ns2(n-1)d1 |
4 |
Ns2np2 |
Ns2(n-1)d2 |
5 |
Ns2np3 |
Ns2(n-1)d3 |
6 |
Ns2np4 |
Ns2(n-1)d4 |
7 |
Ns2np5 |
Ns2(n-1)d5 |
8 |
Ns2np6 |
Ns2(n-1)d6-8 |
Правило Хунда: Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально
2. Растворы- гомогенные смеси переменного состава.
Растворитель- компонент, концентрация которого выше концентрации других компонентов
Идеальный раствор- называется раствор, в котором не происходя химической реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы
а) химическая(гидратная) теория растворов Менделеева: в основе которой лежит представления о взаимодействии Растворного вещества с растворителем.
б) Физическая (теория электролитической диссоциации) теория Аринуса: при растворение в воде электролиты распадаются (диссоциирует) на положительные и отрицательные заряженные ионы; катионы и анионы
а)растворы – это химические соединения
Эффект при растворении: изменение окраски: изменение оъема(контракция): тепловой эффект
б) Растворы – это механические смеси: Переменный состав: проявление свойств компонентов
Б-5 1. Периодический закон Менделеева: Свойства элементов , а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атома.
Периодическая система элементов состоит из периодов, групп, подгрупп.
Период- последовательный ряд элементов, размещенный в порядке возрастания заряда ядра атома.
В системе 8 групп, что соответствует максимальному числу электронов во внешних под оболочках: группы делятся на : главные(основные) и побочные подгруппы. К главным подгруппам относятся подгруппы элементов второго периода:Li, Be, B.C, N, O, F и подгруппа благородных газов. К побочным подгруппам принадлежат d и f элементы.
2. Термодинамика растворения.
1 разрушение кристаллической решётки(дробление вещества)- физический процесс.
2 Гидратация растворенных частиц- химический процесс.
Растворение – это сопряженный физико- химический процесс. Вещества с хорошо растворенной кристаллической решеткой(Na2SO3) растворяются с поглощением тепла. С плохой или не имеющей её, соответственно наоборот. Состав раствора может выражаться разными способами: безразмерными единицами(долей процентов) и размерными- концентрациями.
Массовая доля.![]()
Молярная доля:
![]()
Моляльная концентрация:
![]()
Не зависит от температуры
Эквивалентная концентрация:
![]()
Молярная концентрация
Титр раствора
Б-6 1. Энергия ионизации- энергия необходимая для удаления одного моля электронов от одного моля атомов какого-либо элемента. (первая энергия ионизации)
Электронная ионизация характеризует восстановительную способность элемента. Электронная ионизация возрастает по периоду.
Сродство к электрону(*******)
Это энергия выделяющаяся или поглощающаяся при присоединии одного электрона к нейтральному атому. *- мера неметалличности атома
ЭО- это величина одновременно характеризует металлические и неметаллические свойства атомов.
Л. Полинг: это способность атома притягивать общие электронные пары, приобретая при этом отрицательный заряд.
Атомный радиус- атомы не имеют точных границ из-за корпускулярно-волновой характеристики электрона. Можно условно принять за радиус атома теоритически рассчитанное значение расстояние от ядра до наиболее удаленного максимума электронной плотности.
2. з-н Дальтона о давление пара над раствором: Суммарное давление равно сумме парциальных давленив том случае, если компоненты не взаимодействуют.
З-ны Рауля:
1 закон о давление пара над раствором нелетучего газа: Понижение давления пара над раствором нелетучего газа пропорцианально его мольной доле-***
2 закон о температуре киперия и замерзания растворов:Растворы закипают при более высокой и замерзают при более низкой температуре, по сравнению с растворителем.
Ааааааа*******
З-н Ван-Гоффа для осмотического давления: Осмотическое давление- внутренне давление раствора пропорцианальное концентрации растворенного вещества. Проявляется в виде остмоса. Остмос- односторонняя диффузия компонентов раствора. Для остмотического давления можно применять уравнения восстановления идеального газа:
ОООООООООО******
Б-7 1. Химическая связь – это электронная пара с антипаралельными спинами.
1916г. – Льюис – теория ковалентной связи
1916г. – Коссель- ионная связь
1927г. – Гайтлер и Лондон. Теория химической связи. Они провели первый квантовый механический расчет модели:
кккккк
кккккк Гайтлер и Лондон расчитывали как изменяется в системе из 2-х
атомов водорода при уменьшение расстояния между ними.
Из термодинамики известно, что устойчевой системе соответствует минимум энергии.
При образовании связи происходит перекрывание электронных облаков и молекула стягивается к общему центру, вплоть до равновеского расстояния между ядрами.
2. Электролитическая диссоциация- распад в-ва на ионы. Очищенная вода обладает незначительной электропроводностью, возрастающей с повышению температуры. Растворы многих веществ неподчиняются законвм Рауля, Вант-Гоффа, Дамтона, а имено величины **сильно завышенны. Все эти растворы проводят электрический ток.
Закон Рауля и Вант-Гоффа выполняются и для растворов электролитов, если внести поправку на диссоцицию. *- изотопический коэффициент.
Формулы***********
Б-8 1. Длина химической связи – межядерное расстояние
Энергия(почность)- это энергия неоюходимая для гомологического разрыва связи.
Направленность- выражается в том, что связь ориентированна в пространстве определенным образом, а именно
А) Вдоль линии соединяющих центры
Б) Препендикулярно этой линии
В) *************
Насыщенность- выражается в том, что атом образует огромное количество связей. Принцип: При образовании связи каждый электрон перекрывается с другим одни электронном. Насыщение равно высшей валентности.
Кратность- Число общих электронных пар.
