
- •Краткая история открытия и изучения ферментов
- •Строение и свойства ферменты.
- •Общие и отличительные свойства ферментов и неорганических катализаторов
- •Механизм ферментативного действия
- •Кинетика ферментативных реакций
- •Влияние температуры
- •Влияние кислотности среды
- •Влияние концентрации фермента
- •Влияние концентрации субстрата
- •Активаторы ферментов
- •Ингибиторы ферментов
- •Классификация и номенклатура ферментов
- •Характеристика классов ферментов
- •Изоферменты и их роль
- •Локализация ферментов и регуляция их активности
- •Применение ферментов в сельском хозяйстве, промышленности, медицине, науке и технике
- •Области применения растворимых ферментных препаратов
- •Иммобилизованные ферменты
- •Перспективы применения иммобилизованных ферментов в пищевой промышленности
- •Применение иммобилизованных ферментов в медицине
- •Использование иммобилизованных ферментов для синтеза аминокислот
- •Синтез аналогов пенициллина
Классификация и номенклатура ферментов
Согласно классификации, разработанной Международной комиссией по ферментам и принятой в 1961 году, все ферменты разделяют на шесть классов в зависимости от характера катализируемых реакций:
Оксидоредуктазы. Катализируют окислительно-восстановительные реакции.
Трансферазы. Катализируют реакции переноса группировок от одного соединения на другое.
Гидролизы. Ускоряют гидролитическое расщепление веществ.
Лиазы. Катализируют реакции негидролитического расщепления с образованием двойных связей или реакции присоединения групп к двойным связям.
Изомеразы. Катализируют реакции изомеризации соединений.
Лигазы (синтетазы). Ускоряют реакции синтеза с использованием энергии макроэргических соединений.
Классы делятся на подклассы, последние - на подподклассы или группы, внутри которых ферментам присвоен порядковый номер. Каждый фермент имеет свой индивидуальный четырехзначный шифр, первая цифра которого обозначает класс, вторая - подкласс, третья - подподкласс, четвертая - порядковый номер фермента.
Ферменты могут иметь систематические (рациональные) и рабочие (тривиальные) названия. Систематические названия, предложенные Международной комиссией, включают названия субстратов (их указывают через двоеточие) и характер катализируемых реакций. Если фермент катализирует реакцию, при которой одновременно идут два превращения, то в наименовании фермента второе превращение дается в скобках.
Характеристика классов ферментов
Оксидоредуктазы [1]
Оксидоредуктазы - ферменты катализирующие окислительно-восстановительные реакции. При их участии протекают такие важнейшие физиологические процессы как дыхание и фотосинтез, происходят превращения жирных кислот, фенольных соединений, витаминов и других веществ.
Окислительно-восстановительные реакции в живых организмах осуществляются за счет переноса протонов, электронов или присоединения кислорода. Оксидоредуктазы, катализирующие перенос водорода, имеют тривиальное название дегидрогеназы. Систематические названия ферментов этого класса составляют по схеме: донор водорода : акцептор водорода - оксидоредуктаза. В тех случаях, когда донор водорода точно не установлен, используют термин редуктаза. Реакции прямого присоединения кислорода к субстрату катализируют ферменты оксигеназы. Все ферментативные ОВР обратимы.
Класс оксидоредуктазы подразделяется на подклассы в зависимости от того, какие группировки подвергаются окислению. В основу деленния на подподклассы положен химизм акцептора водорода (таблица 1).
Таблица 1.
Ферменты класса Оксидоредуктазы
|
Подкласс |
Подполклас |
Название ферментов |
|
1.1. (действующие на СН-ОН группу доноров) |
1.1.1. (с НАД+ или НАДФ+ в качестве акцептора) |
алкогольдегидрогеназа (Zn2+), малат дегидрогеназа, изоцитрат дегидрогеназа, лактат дегидрогеназа, глюкозо-6-фосфат дегидрогеназа, глицерин-3-фосфат дегидрогеназа |
|
1.1.3. (с О2 в качестве акцептора) |
глюкоза оксидаза | |
|
1.2. (действующие на альдегидные или кето-группы доноров)
|
1.2.1. (с НАД+ или НАДФ+ в качестве акцептора) |
глицеральдигид-фосфат дегидрогеназа
|
|
1.2.4. (с дисульфидами в качестве акцептора) |
пируват дегидрогеназа, -кетоглутарат дегидрогеназа (содержат тиаминпирофосфат) | |
|
1.3. (действующие на СН-СН- группу доноров) |
1.3.1. (с НАД+ или НАДФ+ в качестве акцептора) |
Еноил-АПБ-редуктаза |
|
1.3.99. (с другими акцепторами) |
Сукцинатдегидрогеназа (флавопротеид, ФАД) | |
|
1.4. (действующие на CH-NH2- группу доноров) |
1.4.1. (с НАД+ или НАДФ+ в качестве акцептора) |
Глутамат дегидрогеназа |
|
1.6. (действующие на НАДН и НАДФН) |
(с ФАД в качестве акцептора) |
Дегидрогеназы восстановленных НАД и НАДФ |
|
1.9. (действующие на гем-содержащие доноры) |
1.9.3. (с кислородом в качестве акцептора) |
Цитохром с оксидаза |
|
1.10. (действующие на дифенолы и родственные им группы доноров) |
1.10.2. (с цитохромом с в качестве акцептора) Сu-протеиды |
Убихинон-цитохром с редуктаза Ортодифенолоксидаза Парадифенолоксидаза Аскорбинатоксидаза
|
|
1.11. Действущие на пероксид водорода в качестве акцептора |
Fe-протеиды |
Каталаза, Пероксидаза |
|
1.13. Действующие на один донор с включением молекулярного кислорода (оксигеназы) |
1.3.11. (с включением 2-х атомов кислорода)
|
Триптофан 2,3-диоксигеназа липоксигеназа |
|
1.14. Действующие на пару доноров с включением молекулярного кислорода (оксигеназы) |
1.14.16. (с восстановленным птеридином в качестве донора и включением одного атома кислорода) |
Фенилаланин 4-монооксигеназа |
|
1.17. Действующие на СН2 - группу |
1.17.4. (с дисульфидами в качестве акцептора) |
Рибонуклеозид-дифосфат редуктаза |
|
1.18. Действующие на восстановленный ферредоксин в качестве донора |
|
Нитрогеназа |
Дегидрогеназы - двухкомпонентные ферменты, имеющие пиридиновые (НАД+ и НАДФ+) и флавиновые (ФАД и ФМН) коферменты. НАД+ (никотинамиддинуклеотид) имеет в составе одного нуклеотида пиридиновое производное - амид никотиновой кислоты (витамин РР) и рибозу, в состав другого входит азотистое основание аденин и рибоза (или фосфорный эфир рибозы). Оба нуклеотида соединены через остатки фосфорной кислоты. В состав НАД+ и НА.ДФ+ находятся во всех типах клеток, причем НАД содержится обычно в значительно больших количествах по сравнению с НАДФ+. НАДФ+ входит не два, а три остатка фосфорной кислоты (рисунок 1).
|
|
|
Амид никотиновой кислоты |
|
Остатки
фосфорной кислоты |
Рибоза | |
|
Аденин
Рибоза |
| |
|
Рисунок 1. Никотинамиддинуклеотид (НАД+ или NAD+) | ||
Каталитические свойства НАД+- и НАДФ+- содержащих дегидрогеназ определяются пиридиновым кольцом, к одному из углеродных атомов которого при восстановлении присоединяются один протон и один электрон (атом водорода). Второй электрон присоединяется к положительно заряженному атому азота. Остающийся протон переходит в окружающую среду и используется затем в последующих реакциях. Восстановленную форму НАД+ и НАДФ+ обозначают соответственно НАД·Н + Н+ и НАДФ·Н + Н+.
Коферменты ФАД (FAD) - флавинадениндинуклеотид и ФМН (FMN) - флавинмононуклеотид - являются производными витамина В2 - рибофлавина. Флавиновые ферменты связывают водород, присоединяя два атома водорода к двум атомам азота в изоаллоксазиновой группировке с соответствующей перегруппировкой двойных связей (рисунок 2, 3).
|
|
| |
|
Витамин В2 |
Остаток фосфорной кислоты | |
|
Рисунок 2. Флавинадениндинуклеотид (ФАД) |
Рисунок 3. Флавинмононуклеотид (ФМН) | |
Открыто более 80 флавиновых ферментов. Они катализируют окисление полуацеталей в лактоны, спиртов в альдегиды, аминов в имины, насыщенных ЖК в ненасыщенные ЖК, НАДН в НАД+. В состав флавиновых ферментов могут входить металлы, образуя гем (альдигидоксилаза, ксантиноксидаза) или железоцентры.
По характеру действия дегидрогеназы делятся на анаэробные и аэробные (оксидазы). Аэробные передают отщепляемый от окисляемого субстрата водород непосредственно на кислород воздуха, а анаэробные - на промежуточные переносчики (обычно аэробные дегидрогеназы). Пиридиновые дегидрогеназы - ферменты анаэробные, среди флавиновых встречаются как анаэробные так и аэробные (оксидазы).
Ниже приведены примеры ферментов, участвующих в некоторых окислительно-восстановительных превращениях, лежащих в основе фотосинтеза, дыхания, брожения и др.
Глицеральдигид-3-фосфат дегидрогеназа (1.2.1.12) катализирует одну из важнейших реакций гликолиза (анаэробного этапа дыхания) -окисление глицеральдигид-3-фосфата до 1,3-дифосфоглицериновой кислоты по схеме:
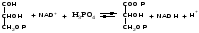
Фермент является олигомером - состоит из 4-х субъединиц, каждая из которых содержит НАД+ и SH-группу (радикал цистеина), входящую в состав активного центра. Реакция происходит через промежуточное образование тиоэфира между окисляемой альдегидной группой и SH-группой.
Малатдегидрогеназа (1.1.1.37) в цикле Кребса катализирует превращение малата (яблочной кислоты) в оксалацетат (щавелевоуксусную кислоту):

Изоцитратдегидрогеназа (1.1.1.42) - один из ферментов цикла Кребса, катализирующий превращение изоцитрата (изолимонной кислоты) в щавелевоянтарную кислоту:

*Глицерол-3-фосфат-дегидрогепаза (1.1.1.8) катализирует превращение глицерол-З-фосфата в фосфодиоксиацетон.:

В обратной реакции образуется глицерол-З-фосфат, используемый в биосинтезе фосфоглицеридов и жиров.
*Алкогольдегидрогеназа (1.1.1.2) катализирует превращение этилового спирта в уксусный альдегид (способствует окислению пива, вина и других спиртосодержащих напитков):
СН3СН2ОН + NADF+ СН3СОН + NADF Н + Н+
Сукцинатдегидрогеназа (1.3.99.1), является флавиновой анаэробной дегидрогеназой, катализирующей в цикле Кребса окисление сукцината (янтарной кислоты) до фумарата (фумаровой кислоты):
СООН-СН2-СН2-СООН + FAD СООН-СН=СН-СООН + FAD.Н2
В цепи окислительно-восстановительных реакций, например, при окислительном фосфорилировании, восстановленные формы флавиновых дегидрогеназ могут передавать водород не только кислороду, но также полифенолоксидазный и цитохромной системам.
* Полифенолоксидаза (1.14.18.1) является Сu-протеидом, окисляющим моно-, ди-, и трифенолы в соответствующие хиноны. содержится в грибах и высших растениях. Потемнение поверхности разрезанного яблока или клубня картофеля, плодов и овощей при сушке, при скручивании и завядании чайного листа объясняется окислением полифенолов и дубильных веществ полифенолоксидазой.

Полифенолоксидазой можно назвать фермент * тирозиназу, окисляющую аминокислоту тирозин с образованием темно-окрашенных соединений - меланинов (в грибах, ржаной муке). Потемнение макарон при сушке также объясняется высокой активностью тирозиназы в некоторых партиях пшеничной муки.
Цитохромная система включает более двадцати цитохромов (a, b, c и др.) и цитохромоксидазу (a3). Цитохромы состоят из железопорферина (гема), связанного с белком (рис. 3). Все они участвуют в окислительно-восстановительных реакциях (в окислительном и фотосинтетическом фосфорилировании) и служат переносчиками электронов.
Fe3+ + e- Fe2+
Цитохромоксидаза (1.9.3.1) активирует кислород путем присоединения к нему электронов. Является сложным ферментом, содержащим Сu.
* Пероксидаза
(1.11.1.7.) - железосодержащий фермент,
осуществляющий окисление органических
соединений перекисью водорода. При этом
образуются комплексные соединения,
перекись активируется и приобретает
способность действовать как акцептор
водорода. Пероксидаза окисляет полифенолы
и некоторые ароматические амины. В
качестве перекиси могут выступать
соединения с двойными связями при их
окислении: терпены, каротиноиды,
ненасыщенные жирные кислоты.
Рисунок 3. Простетическая группа цитохрома с.
* Каталаза (1.11.1.6.) расщепляет перекись водорода на воду и кислород. Каталаза содержит Fe в составе гематина, её ингибируют HCN, H2S, фториды.
* Аскорбинатоксидаза (1.10.3.3) - Сu-протеид, содержащий до 0,24 % меди, окисляет аскорбиновую кислоту (витамин С) до дегидроаскорбиновой кислоты. Особенно активна аскорбинатоксидаза в тыкве, капусте, кабачках.

* Альдегидоксидаза ( ) относится к флавиновым ферментам, она окисляет уксусный альдегид до уксусной кислоты:
СН3-СОН + Н2О + О2 СН3-СООН + Н2О2
Лактатоксидаза ( ) - флавиновый фермент, содержащийся в ... и окисляющий лактат (молочную кислоту) в ацетат (уксусную кислоту):
СН3 СНОН СООН + О2 СН3-СООН + СО2 + Н2О
* Глюкозооксидаза (1.1.3.4) содержится в различных плесневых грибах. Она получена в кристаллическом виде, содержит две молекулы ФАД и 15 % углеводов. Фермент легко окисляет глюкозу до глюконовой кислоты.
* Липоксигеназа (липоксидаза) (1.13.11.12) окисляет некоторые ненасыщенные жирные кислоты и образуемые ими сложные эфиры. Этот фермент хорошо окисляет линолевую и линоленовую кислоты с образованием гидроперекисей, которые потом сами могут окислять другие жирные кислоты, а также каротиноиды и витамин А, аминокислоты, хлорофилл, витамин С. Эти процессы происходят во время сушки и хранения различных растительных продуктов. Прогоркание муки и круп связано с действием липоксигеназы.
* Нитратредуктаза (1.6.6.1) и нитритредуктаза (1.6.6.4) играют очень важную роль в азотном обмене растений. Первый восстанавливает нитраты до нитритов, а второй - нитриты до аммиака. Донором протонов и электронов в этих реакциях является НАДН (или НАДФН):
HNO3 + NADH + H+ HNO2 + H2O + NAD+
HNO2 + 3 NADH + 3 H+ NH3 + 2 H2O + NAD+
Нитратредуктаза состоит из двух частей, диафоразной, содержащей ФАД, и терминальной, содержащей молибден. Нитритредуктаза являются флавинсодержащим железосерным белком.
Таким образом, железо и медь, входящие в состав многих оксидаз, при наличии их в среде (используемая для переработки или хранения посуда), способствуют быстрому окислению, потемнению и порчи продукции растениеводства. Однако снижение активности окислительно-восстановительных реакций в растениях из-за недостатка этих микроэлементов, снижает их устойчивость к болезням, урожайность и качество продукции. Недостаток в почве таких микроэлементов как молибдена, магния, марганца, железа и меди, являющихся активаторами ферментов нитрат-восстанавливливающей системы растений, приводит к снижению содержания белков и накоплению токсичных для человека и животных нитратов и нитритов.
Трансферазы [2]
Трансферазы - ферменты, катализирующие реакции переноса отдельных групп или молекул.
Систематическое название ферментов этого класса образуется следующим образом: донор акцептор - транспортируемая группа - трансфераза. Часто используют н цифровую приставку для указания положения, к которому присоединяется переносимая группа.
Выделено 8 подклассов - по химизму переносимых групп.
2.1. Переносят одноуглеродные остатки: метильные, оксиметильные, формильные, карбоксильные и др. Пример: метилтрансферазы, катализирующие перенос метальных групп, принимают участие в синтезе холина (лецетины), пуринов, пиримидинов, НК. Коферментами являются фолиевая к-та и вит. В12.
2.2. Переносят альдегидные и котонные остатки. Сюда относятся ферменты: транскетолаза (переносит 2-углеродный фрагмент) н трансальдолаза (переносит 3-углеродный фрагмент). Эти ферменты участвуют в пентозном цикле дыхания, в фотосинтетическом цикле Кальвина.
2.3. Ацилтрансферазы - ферменты, переносящие остатки уксусной к-ты СН3СО-, а также остатки жирных кислот. Это двухкомпонентные ферменты, в состав которых входит кофермент А. При переносе остатков уксусной кислоты в реакции участвует ацетилкофермент А (СН3СОS-КоА), а при переносе остатков жирных кислот - ацилкофермент А (R-СОS-КоА). С их участием идет синтез лимонной к-ты, жирных кислот, каучука и др. в-в. ацетилглюкозамина, ацетилхолина.
2.4. Гликозилтрансферазы - переносчики остатков моносахаридов. Эти ферменты участвуют в синтезе полисахаридов и имеют в качестве небелковой части нуклеозиддифосфатсахара (НДФС). Показать рисунок !
К числу гликозилтрансфераз относят ферменты, которые были известны под названием фосфоризаз, широко распостраненных у растений, животных и микроорганизмах. Представителем является крахмальная фосфорилаза - -глюканфосфорилаза (2.4.1.1), катализирующая превращение крахмала в гл.-1-фосфат, перенос глюкозы на фосфат:
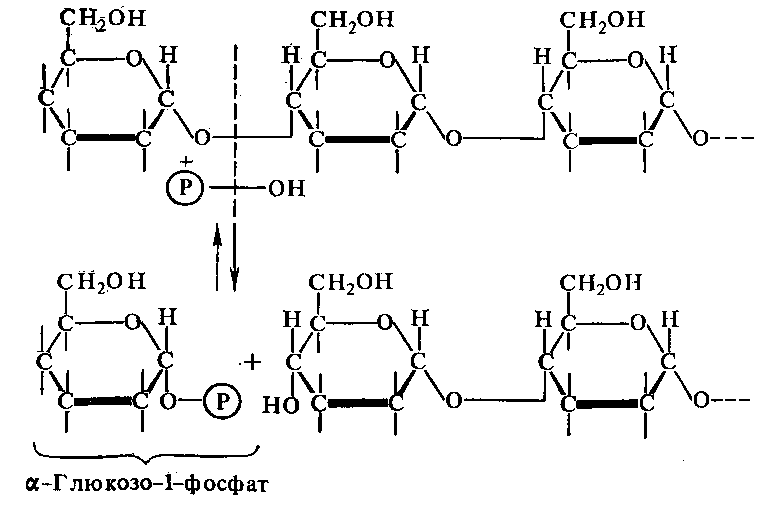
Фосфоролитическое расщепление нуклеозидов также идет при участии этих ферментов.
2.6. Переносят группы, содержащие азот. К этому подклассу относятся важнейшие ферменты азотного обмена - аминотрансферазы. Аминотрансферазы катализируют межмолекулярный перенос аминогруппы между аминокислотами и кетокислотами в процессе реакции переаминирования, идущими по схеме:
R1 R2 R1 R2
CHNH2 + CO = CO + CHNH2
COOH COOH COOH COOH
Аминотрансферазы-
двухкомпонентные ферменты, активной
группой которых является фосфорилированное
производное
витамина
В6
(пиридоксина).

2.7. Переносят группы, содержащие фосфор (фосфатрансферазы или киназы). Эти ферменты переносят фосфатный остаток от АТФ на различные акцепторы, пирофосфатный остаток пирофосфотрансферазы), а также более сложные группировки, содержащие фосфатный остаток (нуклеотидилтрансферазы и др.).
Фермент гексокиназа (2.7.1.1) ускоряет фосфорилирование гексоз (глюкозы и фруктозы).
Фермент фосфофруктокиназа (2.7.1.11) катализирует фосфорилирование фруктозо-6-фосфата во фруктозо-1,6-дифосфат (смотри уч.: Плешков, 1987; стр.68)
Фермент фосфоглюкомутаза (2.7.5.1) катализирует взаимное обратимое превращение глюкозо-1-фосфата и глюкозо-6-фосфата
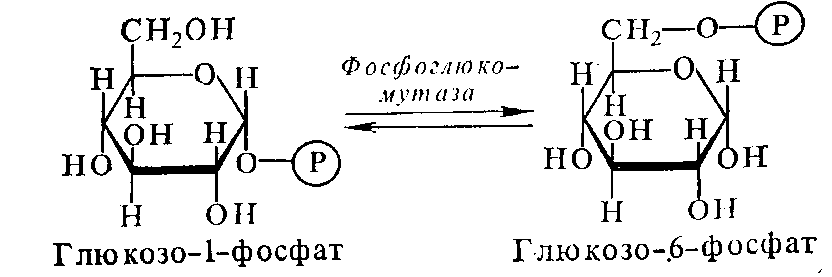
2.8. Переносят группы, содержащие серу. В этот подкласс входят, в частности, КоА-трансферазы, переносящие остатки кофермента А.
Гидролизы [3]
Ферменты этого класса катализируют гидролиз, а иногда и синтез сложных соединений с участием воды:
RR1 + HOH = ROH + R1H
Систематическое название ферментов класса гидролаз составляется из названия субстрата и через тире слова гидролиза. Отщепляемые группы могут быть указаны после названия субстрата, например аденозин - аминогидролаза. Класс гидролаз делится на одиннадцать подклассов.
3.1. Гидролизуют сложноэфирные связи (эстеразы, фосфатазы, нуклеазы).
3.1.1. Липазы - катализируют расщепление жиров - триацилглицеринов по схеме:

где R1, R2 и R3 - остатки жирных кислот.
В растениях липазы широко распространены: обмен жиров в клетках в значительной степени связан с активностью этих ферментов. У каждого вида растений есть свои собственные липазы, значительно различающиеся по свойствам (растворимость, оптимум рН и т. д.), однако в отличие от многих других ферментов специфичность липаз очень низка и любая липаза может расщеплять всякий жир. Действие липазы имеет большое значение при хранении муки и круп, особенно содержащих большое ко-во жира (пшено). При повышенной влажности этих продуктов и повышенной температуре хранения липаза быстро расшепляет глицериды с образованием свободных жирных кислот, что приводит к повышению кислотности и его быстрому прогорканию.
К эстеразам относят также пектинэстеразу или пектазу (3.1.1.11) - осуществляющих гидролитическое расщепление пектиновых вв. до галактуроновой к-ты и метилового спирта.
3.1.2.Г и д р о л а з ы т и о л о в ы х э ф и р о в. Например, ацетил- КоА-гидролаза (3.4.2.1), катализирующая расщепление ацетилкофермента А:
СН3СОS-KoA + H2O СН3СOОH + HS-KoA
3.1.3. Гидролазы фосфомоноэфиров катализируют отщепление остатка фосфорной кислоты от соединений типа R - 0- P. К таким соединениям относят, например, фосфорные эфиры сахаров - глюкоза-б-фосфат, глюкоза-1-фосфат, фруктоза- 1 ,6 -дифосфат и др. Соответствующие ферменты носят названия глюкозо-6-фосфатаза (3.1.3.9), глюкоза-1-фосфатаза (3.1.3.10), гексозодифосфатаза, (3.1.3.11) н т. д. Схемы реакций, катализируемые этими ферментами, можно представить следующим образом:
3.1.4. Гидролазы фосфодиэфиров. К этой группе ферментов относятся дезоксирибонуклеаза, (3.1.4.5) и рибонуклеаза (3.1.4.9), которые катализируют расщепление соответственно ДНК и РНК.
3.2. Гидролизуют гликозильные связи. Среди этих ферментов в растениях наиболее распространены гидролизы гликозидов, катализирующие гидролитическое расщепление углеводов и гликозидов. К этим ферментам относятся - и -амилазы (3.2.1.1 и 3.2.1.2), ускоряющие расщепление крахмала (-амилаза содержится в слюне, пищеварительном соке выделяемом поджелудочной железой, проросшем зерне пшеницы, ржи, ячменя), целлюлаза (3.2.1.4), катализирующая расщепление целлюлозы, инулаза, (3.2.1.7), расщепляющая полисахарид инулин, полигалактуроназа, -глюкозидаза (3.2.1.20), расщепляющая -гликозидную связь в дисахаридах и гликозидах (тождественнен мальтазе, превращающей дисахарид мальтозу в две молекулы глюкозы), -глюкозидаза 3.2.1.21), расщепляющая ди- и полисахариды и гликозиды (целобиозу, амигдалин, арбутин и др.), -фруктофуранозидаза (сахараза, инвертаза) (3.2.1.26), катализирующая распад сахарозы, -галактозидаза (3.2.1.23), участвующая в расщеплении дисахарида лактозы на молекулы галактозы и глюкозы, хитиназа. Схему действия гидролаз гликозидов можно представить на примере гидролиза сахарозы:
сахароза + H2O
= глюкоза + фруктоза.


3.4. Гидролизуют пептидные связи (пептид-гидролазы).
Систематической
номенклатуры для ферментов данного
подкласса нет, так как специфичность
этих ферментов перекрывается. В этом
подклассе различают ряд подподклассов
ферментов, в частности отщепляющие
N-концевые
аминокислоты (аминопептидазы),
 С-концевые аминокислоты (карбоксипептидазы),
С-концевые аминокислоты (карбоксипептидазы),
 гидролизующие дипептиды (дипептидазы),
несколько подподклассов пептид-гидролаз,
расщепляющих белки (пептидил-пептидгидролазы,
протеиназы
или протеолитические
ферменты ).
гидролизующие дипептиды (дипептидазы),
несколько подподклассов пептид-гидролаз,
расщепляющих белки (пептидил-пептидгидролазы,
протеиназы
или протеолитические
ферменты ).
Пептидазы (3.4.) или протеолитические ферменты, катализируют гидролитическое расщепление пептидных - С-N- связей в белках или пептидах по схеме: RCO-NHR1 + H2O = RCOOH + R1NH2
где R и R1 - остатки аминокислот или пептидов.
Субстратами пептидаз являются белки и пептиды, которые расщепляются на пентиды меньшей молекулярной массы или до свободных аминокислот.
Известно несколько десятков ферментов этого типа, из которых наиболее хорошо изучены ферменты желудочного сока - пепсин ( 3 4.4.1) , трипсин ( 3.4.4.4) и химотрипсин (3.4. 4 .5 ) , а также растительный фермент папаин (3.4.4.10). Все они представляют собой однакомпонентные ферменты; получены в кристаллическом состоянии и достаточно хорошо изучены. Протеиназы являются эндопептидазами и гидролизуют белки до пептидов разной величины. В зависимости от строения активного центра выделяют следующие подклассы протеиназ.
3.4.21. Сериновые протеиназы - содержат в активном центре серин, необходимый для катализа. Сюда относятся химотрипсин, трипсин - протеиназы желудочно-кишечного тракта, тромбин, плазмин - протеиназы крови.
3.4.22. Тиоловые протеиназы - содержат в активном центре цистеин. Это, в основном, растительные протеиназы, например папаин из млечного сока дынного дерева. Некоторые тканевые протеиназы (катепсин В и др.).
3.4.23. Кислые протеиназы - содержат в активном центре две карбоксильные группы, оптимум рН их действия от 1 до 5. К этому подклассу принадлежат пепсин, реннин (химозин), катепсин D, пеницилопепсин.
3.4.24. Металлопротеиназы.
3.4.99. Протеиназы с неизвестным механизмом катализа.
3.5. Гидролизуют С-N-связи, отличные от пептидных. В частности, сюда относятся ферменты, расщепляющие амидные связи - дезамидазы.
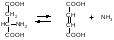
Дезамидазы (3.5.1 и 3.5.3) катализируют гидролитическое дезаминирование амидов. Реакция идет по схеме:
![]()
Эти ферменты играют важную роль в азотном обмене.
Аспарагиназа (3.5.1.1) и глутаминаза (3.5.1.2) - ферменты, которые катализируют гидролитическое расщепление соответственно аспарагина и глутамина:

К этой группе ферментов относится уреаза (3.5.1.5), которая катализирует гидролитическое расщепление мочевины:
![]()
Уреаза (3.5.1.5) содержится во многих растениях, особенно ее много семенах сои. Она очень специфична, действует только на мочевину. Уреаза - первый фермент, который был получен в кристаллическом состоянии.
Дезаминазы (3.5.3. и 3.5.4.) - ферменты, катализирующие гидролитическое дезаминирование азотистых оснований и нуклеотидов, входящих в состав нуклеиновых кислот, а также дезаминирование некоторых других соединений. Пой действием дезаминаз реакции идут по следующей схеме:
![]()
Аргиназа (3.5.3.1) катализирует гидролитическое расщепление Д-аргинина на орнитин и мочевину. Оптимальная тзона для действия аргиназы при рН 10. Активируется солями марганца (возможно содержит).
3.6. Гидролизуют кислотно-ангидридные связи. В этот подкласс входят неорганическая полифосфатазы, катализирующие отщепление фосфорной кислоты от полифосфатов. Среди этих ферментов важную роль играют пирофосфатаза (3.6.1.1) действующая но схеме: H4P2O7 + H2O 2H3PO4
аденозинтрифосфатаза или АТФаза (3.6.1.3), катализирующая отщепление фосфорной кислоты от АТФ:
АТФ + Н2О = АДФ + H3PO4
3.7.Гидролизуют С-С-связи. Например, оксалоацетаза, ускоряющая гидролитическое расщепление оксалоацетата до оксалата и ацетата.
Лиазы [3]
Лиазы катализируют отщепление от субстратов тех или иных групп без участия воды или фосфорной кислоты. В результате действия этих ферментов образуются двойные связи. Лиазы могут участвовать в реакциях присоединении отдельных групп или радикалов к двойным связям (воды, СО2, NH3).
Класс лиаз делят на семь подклассов. Это деление основано за том, каков тип подвергающейся разрыву связи между отщепляемой группой и остатком молекулы.
Систематические названия ферментов этого класса образуют из названия субстрата, затем указывают отщепляемую группу и через дефис добавляют слово лиаза.
4.1. С-С-Лиазы (углерод-углерод-лиазы) - многочисленные ферменты, катализирующие отщепление или присоединение углекислоты. Отщепление углекислоты от органических соединений часто происходит в процессах обмена веществ в растениях. Ферменты этого типа носят название карбоксилаз или декарбоксилаз.
Пируватдекарбоксилаза (4.1.1.1) катализирует отщепление СО2 от пировиноградной кислоты:
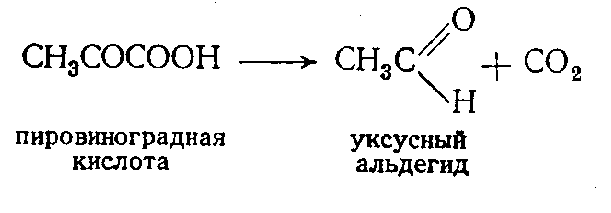
Кроме пировиноградной кислоты, она может катализировать отщепление углекислоты и от других а-кетокислот с образованием соответствующих альдегидов. Пируватдекарбоксилаза - двухкомпонентный фермент. В состав его активной группы входит производное витамина В1 - тиаминпирофосфат.
В процессе фотосинтеза важнейшую роль играет фермент рибулезодифосфаткарбоксилаза (4.1.1.39), катализирующий реакцию:

ФЕП-карбоксилаза (4.1.4.31)
Глутаматдекарбоксилаза (4.1.1.15) участвует в декорбоксилировании глутаминовой кислоты.
Аспарат-1-декарбоксилаза отщепляет СО2 от аспарагиновой кислоты с образованием новой аминокислоты в-аланина:
![]()
Это также двухкомпонентный фермент, активная группа которого представляет фосфорилированное производное витамина В6.
Декарбоксилазы аминокислот (4. 1.1 ) участвуют в отщеплении углекислоты от аминокислот. В результате образуются соответствующие амины:

При декарбоксилировании
АК лизина
лизиндекарбоксилазой
(4.1.1.18) образуется амин кадаверин
 ,
а при декарбоксилировании орнитина
образуется петресцин
,
а при декарбоксилировании орнитина
образуется петресцин
 .
Оба вещества являются токсичными
(трупные яды).
.
Оба вещества являются токсичными
(трупные яды).
Фруктозодифосфатальдолаза, или альдолаза (4.1.2.13) расщепляет шестиуглеродный фруктозо-1,6-дифосфат на две триозы - 3-фосфоглицериновый альдегид и фосфодиоксиацетон (фотосинтез, дыхание, спиртовое бражение):
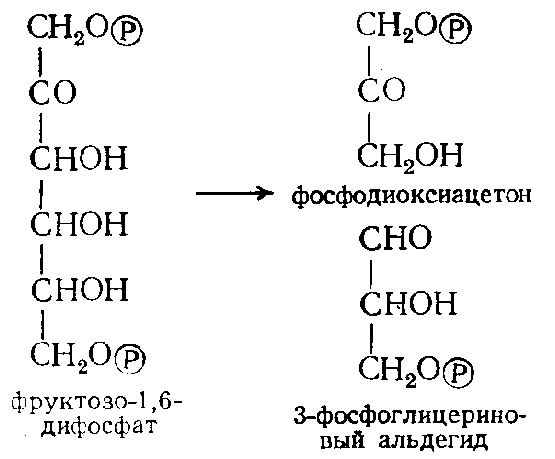
Лиазы кетокислот (4. 1 .3) катализируют расщепление и образование различных кетокислот. Среди ферментов этого подкласса важное значение имеет цитрат-синтаза (4.1.3.7), с участием которой происходит образование лимонной кислоты в цикле ди- и трикарбоновых кислот:

4.2. С-О-Лиазы (углерод-кислород-лиазы), или гидролиазы, - многочисленная группа ферментов, которая катализирует отщепление от субстрата водорода и гидроксила, образующих затем воду.
Карбонат-гидро-лиаза или угольная ангидраза (4.2.1.1) расщеплфет угольную кислоту на СО2 и воду: Н2СО3 СО2 + Н2О
К этой группе ферментов относится фумарат-гидратаза (4.2.1.2) отщепляющая воду от яблочной кислоты с образованием фумаровой кислоты:
![]()
Фосфопируват-гидротаза (4.2.1.11) или енолаза участвует в превращении 2-ФГК в 2-ФЕПК при гликолизе и спиртовом бражении.
Цитрат(изоцитрат)
- гидро-лиазы (4.2.1.3)
катализирует взаимное обратимое
превращение лимонной, изолимонной и
цис-аканитовой кислот:

4.3. С-N-Лиазы. Катализируют присоединение и отщепление азотистых соединений.
Фермент аспартат-аммиак-лиаза (4.3.1.1) или аспартаза катализирует взаимное превращение аспарагиновой и фумаровой кислот:
Изомеразы [4]
Изомеразы катализируют превращения органических соединений в их изомеры. Изомеризация происходит вследствие внутримолекулярного перемещения атомов, атомных группировок, остатков фосфорной кислоты, различных радикалов.
Систематическое название ферментов этого класса образуют по схеме: субстрат-тип реакции изомеризации-изомераза. При внутримолекулярном переносе групп ферменты имеют тривальные названия мутазы, а в реакциях инверсии групп у хиральных центров - рацемазы и эпимеразы.
В 5-м классе выделено шесть подклассов.
5.1. Рацемазы и эпимеразы. Рецемазы катализируют взаимные превращения D- и L-изомеров, эпимеразы - реакции эпимеризации, заключающиеся в изменении взаимного расположения атомов водорода и гидроксила у одного из ассиметричных атомов углерода. Одним из ферментов этого подкласса является рибулозо-5-фосфат-3-эпимераза (5.1.3.1), катализирующая превращение ксилулозо-5-фосфата в рибулезо-5-фосфат:

ксилоза рибулоза
5.2.Цис-транс-изомеразы.
5.3. Внутримолекулярные
оксидоредуктазы. Эти
ферменты катализируют взаимное
превращение альдоз и кетоз, котонных и
енольных групп, перемещают С=С-связи. К
ним относятся триозофосфат-изомераза
(превращение ФГА в ФДОА),
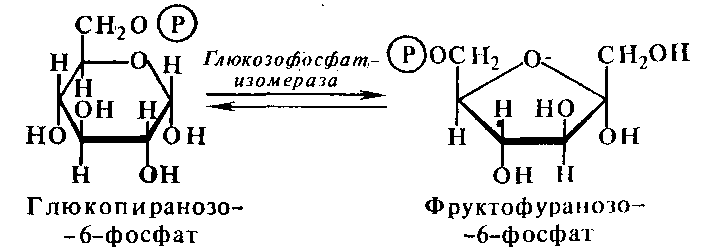
 глюкозофосфат-изомераза
(превращение глюкозо-6-фосфата во
фруктозо-6-фосфат).
глюкозофосфат-изомераза
(превращение глюкозо-6-фосфата во
фруктозо-6-фосфат).
Известно более 20
ферментов, катализирующих превращение
альдоз и кетоз.

5.4. Внутримолекулярные трансферазы - осуществляют внутримолекулярный перенос ацильных, фосфорильных и др. групп. Примером фермента этого подкласса является D-фосфоглицерат-2,3-фосфомутаза, катализирующая превращение 3-ФГК (3-фосфо-D-глицерат) в 2-ФГК (2-фосфо-D-глицерат):
Лигазы (синтетазы) [6].
Систематическое название образуется по схеме: А:В лигаза (образующая АДФ),
где А и В - соединяющиеся молекулы, в скобках указывается продукт расщепления нуклеозидтрифосфата, который использовался в данной реакции как источник энергии.
Весь класс делится на пять подклассов в зависимости от того, между какими атомами образуются связи.
6.1. Образуют С-О-связи. Такой тип связи возникает при действии аминоацил-тРНК-синтетаз, активирующих аминокислоты и передающих их на т-РНК.
6.2. Образуют С-S-связи. Ферменты этого подкласса катализируют присоединение различных кислотных остатков от КоА. Ацетил- КоА-синтетаза катализирует реакцию: АТФ + CH3COOH + HS-КоА = АМФ + H3PO4 + CH3COO-KoA.
6.3. Образуют С-N-связи. Эти ферменты участвуют, например, в синтезе различных амидов: аспарагинсинтетаза, глутаминсинтетаза.
Аспарагиновая кислота + АТФ = аспарагин + АДФ + H3PO4
6.4. Образуют С-С-связи. Сюда относятся карбоксилазы. Эти Ф при участии АТФ катализируют присоединение СО2 к различным органическим кислотам, т.е. реакции удлиннения углеродной цепочки. Эти ферменты содержат витамин биотин. Одним из представителе таких ферментов является пируваткарбоксилаза (6.4.1.1):
ПВК + СО2 + АТФ + Н2О ЩУК + АДФ + Н3РО4










