
- •Міністерство освіти і науки україни
- •Модуль 1. Механіка. Молекулярна фізика і термодинаміка Лабораторна робота № 1 вивчення криволінійного руху
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи
- •Результати вимірювань і вихідні дані для розрахунку похибок
- •Характеристики засобів вимірювання
- •Питання для самоперевірки
- •Лабораторна робота № 2 визначення моменту інерції системи на прикладі маятника обербека
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи
- •Результати вимірювань та вихідні дані для розрахунку похибок
- •Характеристики засобів вимірювання
- •Обчислення похибок прямих вимірювань
- •Обчислення похибки непрямого вимірювання
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення коефіцієнта тертя кочення
- •Теоретичні відомості
- •Порядок виконання роботи
- •Результати вимірювань і вихідні дані для розрахунку похибок
- •Коефіцієнти тертя кочення
- •Питання для самоперевірки
- •Лабораторна робота № 4 визначення відношення питомих теплоємностей газів методом адіабатичного розширення
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи
- •Результати вимірювань та вихідні дані для розрахунку похибок
- •Обчислення похибки непрямого вимірювання
- •Питання для самоперевірки
- •Модуль 2. Електрика та магнетизм Лабораторна робота № 5 дослідження електростатичного поля
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Лабораторна робота № 6 електровимірювальні прилади. Вимірювання електричного струму
- •Теоретичні відомості
- •Порядок виконання роботи
- •Характеристики нешунтованих амперметрів
- •Результати вимірювань та розрахунки для еталонного і шунтованого амперметрів
- •Питання для самоперевірки
- •Лабораторна робота № 7 визначення горизонтальної складової вектора магнітної індукції магнітного поля землі
- •Теоретичні відомості
- •Порядок виконання роботи
- •Результати вимірювань та вихідні дані для розрахунку похибок
- •Питання для самоперевірки
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додатки
- •Основні одиниці sі
- •Похідні одиниці sі, що мають спеціальні назви
- •Коефіцієнти Стьюдента
- •Характеристики мір
- •Характеристики приладів
- •Властивості натуральних логарифмів
- •Грецький алфавіт
Питання для самоперевірки
Дати визначення силі тертя.
Назвати види тертя.
У якому випадку на тіло діє сила тертя спокою ? Як вона спрямована ?
Чому дорівнює сила тертя ковзання ?
Від чого залежить коефіцієнт тертя ковзання ?
Навести графік залежності сили тертя від зовнішньої сили.
Чому дорівнює сила тертя кочення ?
Дати визначення коефіцієнту тертя кочення (fk).
Від чого залежить коефіцієнт тертя кочення ?
Як пов’язана робота сил тертя кочення з енергією кульки ?
Лабораторна робота № 4 визначення відношення питомих теплоємностей газів методом адіабатичного розширення
Мета роботи: вивчити метод визначення відношення питомих теплоємностей повітря, визначити експериментально та теоретично числове значення відношення cp/cv, обчислити похибки вимірювання.
Прилади та обладнання: балон об’ємом 20л, водяний диференційний манометр зі шкалою, насос.
Теоретичні відомості
Питомою теплоємністю речовини називається фізична величина, що дорівнює кількості теплоти, яку необхідно надати одиниці маси речовини для підвищення її температури на 1K.
Для газів ця величина залежить від умов, при яких проходить нагрівання – при сталому об’ємі чи при сталому тиску, і тому розрізняють відповідно питому теплоємність при сталому об’ємі cv та питому теплоємність при сталому тиску cp. Величини cv і cp мають різні значення для одного й того ж газу, оскільки кількість теплоти, надана газу при різних умовах, розподіляється по-різному. Згідно з першим принципом термодинаміки під час нагрівання при сталому об’ємі вся теплота витрачається тільки на збільшення внутрішньої енергії речовини, а під час нагрівання при сталому тиску підведена теплота витрачається на збільшення внутрішньої енергії газу та на виконання роботи проти зовнішніх сил.
Безпосередньо виміряти cp і, особливо, cv важко, оскільки теплоємність газу становить мізерну долю теплоємності посудини, в якій міститься газ, тому вимірювання виконується неточно. Простіше виміряти відношення cp/cv, яке надасть величину показника адіабати – . Величина cp/cv = входить до рівняння Пуассона, яке описує адіабатичний процес зміни стану ідеального газу:
pV = const. (1)
Співвідношення cp/cv = залежить тільки від числа ступенів вільності руху молекул, які входять до складу газу:
![]() ,
,
де i – число ступенів вільності руху.
Для одноатомного газу i=3, двохатомного i=5, трьохатомного та багатоатомного i=6.
Опис методу
Метод, який використовується в даній роботі був запропонований Клеманом і Дезормом. В його основі – використання адіабатичного розширення газу.
Адіабатичним називається процес, який проходить без теплообміну з навколишнім середовищем. Перший принцип термодинаміки для адіабатичного процесу записується наступним чином:
A + U = 0, або A = – U,
де A – робота, виконана газом;
U – зміна внутрішньої енергії газу.
З цієї формули видно, що робота по розширенню газу виконується за рахунок зміни внутрішньої енергії газу; температура газу при цьому знизиться. Під час же адіабатичного стискання газу його температура підвищиться. Якщо об’єм газу змінюється досить швидко, то внаслідок того, що теплопровідність газу невелика, процес можна розглядати як дуже близький до адіабатичного.
Прослідкуємо за послідовністю процесів, що відбуваються у даному лабораторному експерименті та виведемо формулу для обчислення .
Рис.
1.
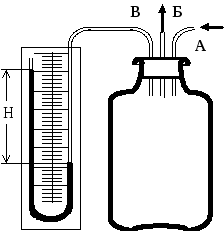
Швидке розширення газу можна вважати адіабатичним. Тому, відкриваючи кран на короткий час, протягом якого тиск всередині балону досягне атмосферного, можна вважати, що газ перейшов до нового стану, який характеризується параметрами p2, V2, T2 < T1 (рис. 2, точка 2). При цьому температура T2 газу після адіабатичного розширення буде меншою від T1. Параметри станів 1 та 2 зв’язані рівнянням адіабатичного процесу.
Через 2-3 хвилини після перекривання крану газ у балоні нагрівається до температури навколишнього повітря T1. Але оскільки під час цього нагрівання об’єм V2 залишається незмінним, то тиск у балоні підвищується до значення p3. Новий стан газу характеризується параметрами p3, V2, T1
(рис. 2, точка 3).
Порівнявши кінцевий стан газу (точка 3) з початковим (точка 1), бачимо, що вони знаходяться при однаковій температурі. Отже, за законом Бойля – Маріотта: p3V2 = p1V1. (2)
Рис.
2.

Виконаємо деякі перетворення в цьому рівнянні. Піднесемо його до степеня і поділимо на рівняння (1):
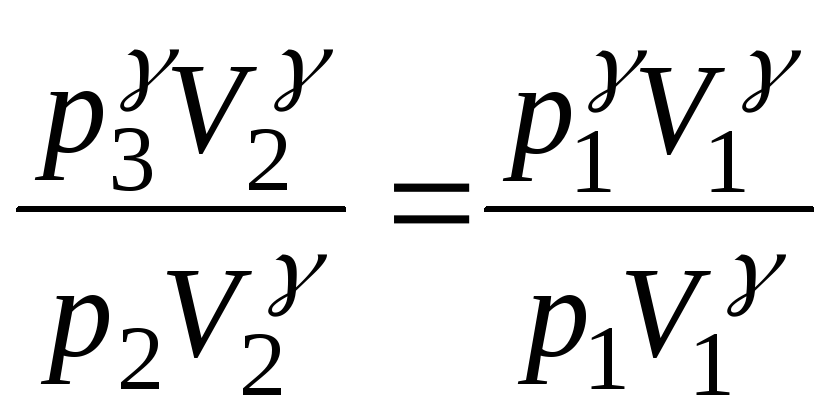
![]()
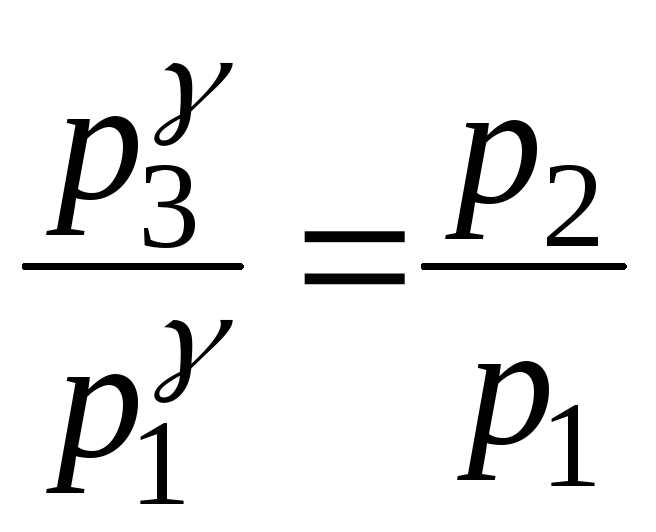
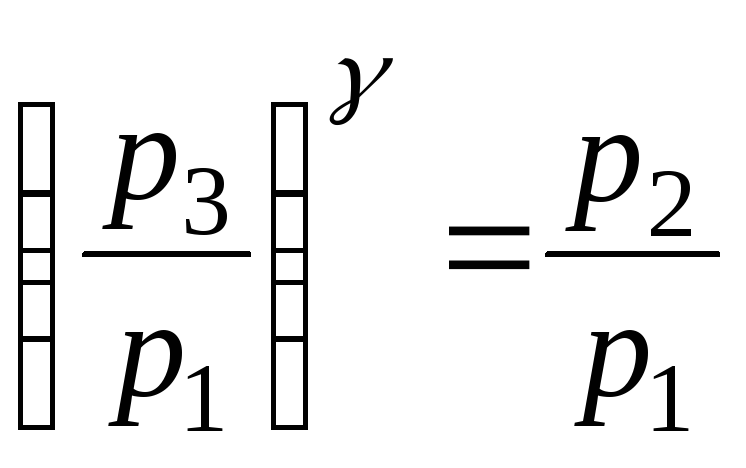 . (3)
. (3)
Візьмемо натуральний логарифм від рівняння (3):
![]() ,
, ![]() . (4)
. (4)
Умови експерименту надають змогу спростити розрахункову формулу. А саме, якщо позначити початковий тиск у балоні p1, початкову різницю рівнів рідини в манометрі H, то:
p1 = p2 + bH, (5)
де p2 – атмосферний тиск;
b – коефіцієнт переходу від різниці рівнів рідини до тиску.
Для тиску p3 різницю рівнів позначимо h, тоді:
p3 = p2 + bh. (6)
Визначивши
![]() з рівняння (5) і підставивши його в
рівняння (6), отримаємо:
з рівняння (5) і підставивши його в
рівняння (6), отримаємо:
p3 = p1 – b(H–h). (7)
Підставивши p2 (з рівняння (5)) і p3 (з рівняння (7)) у рівняння (4), знайдемо:
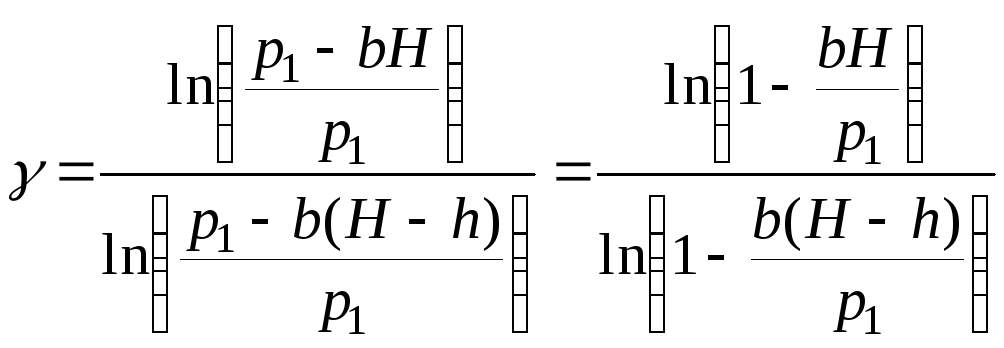 .
.
Величини
![]() та
та![]() набагато менші за одиницю, тому,
використавши наближену формулу
ln(1–x)–x,
справедливу для малих
набагато менші за одиницю, тому,
використавши наближену формулу
ln(1–x)–x,
справедливу для малих
значень
x,
отримаємо: 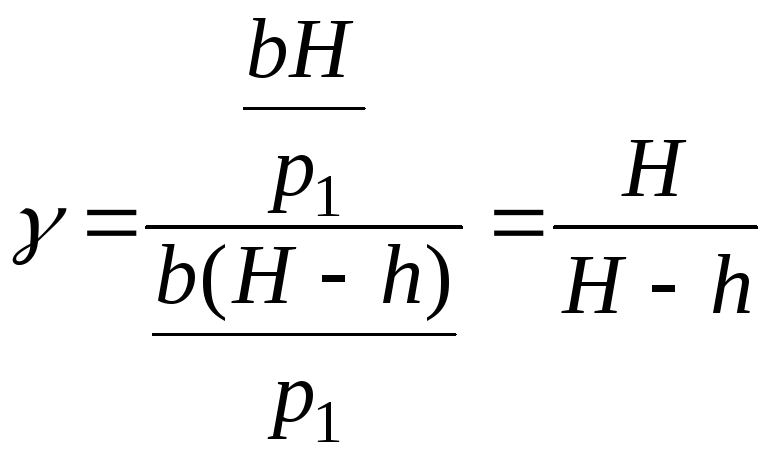 . (8)
. (8)
Таким чином, формула (8) є робочою формулою для розрахунку .
