
- •Часть 1
- •Общие методические указания
- •Указания к самостоятельной работе с учебными пособиями
- •Указания к решению задач
- •Указания к оформлению и выполнению контрольныхработ
- •Раздел 1. Физические основы механики
- •Раздел 2. Колебания и волны.
- •Раздел 3. Молекулярная физика и термодинамика.
- •Раздел 4. Электродинамика
- •Краткие теоретические сведения и основные формулы Физические основы классической механики
- •Кинематика частицы и абсолютно твердого тела
- •Динамика частицы.
- •Работа и энергия
- •Динамика твердого тела
- •Механические колебания.
- •Молекулярная физика.
- •Основы термодинамики.
- •Электростатика
- •Постоянный электрический ток
- •Примеры решения задач Кинематика частицы и абсолютно твердого тела Динамика частицы и механической системы.
- •Колебания и волны.
- •Основы молекулярной физики и термодинамики
- •Электродинамика
- •Контрольная работа 1
Основы молекулярной физики и термодинамики
Задача
1.
Двухатомный
идеальный газ с молярной массой М
находится при температуре
![]() .Используя
функцию распределения молекул
идеального газа
по относительным
скоростям
.Используя
функцию распределения молекул
идеального газа
по относительным
скоростям
![]() :
:![]() ,
где
,
где![]() ,
,![]() скорость
теплового движения молекул,
скорость
теплового движения молекул,![]() наиболее
вероятная скорость молекул,определите
(в процентах) вероятность того, что
молекулы
идеального газа
имеют скорости теплового движения в
интервале от
наиболее
вероятная скорость молекул,определите
(в процентах) вероятность того, что
молекулы
идеального газа
имеют скорости теплового движения в
интервале от
![]() до
до![]() .
.
Дано:![]() ,
,![]() ,
,![]() .
.
Определить:![]() .
.
Решение.
Число
![]() молекул,
относительные скорости которых находятся
в пределах от
молекул,
относительные скорости которых находятся
в пределах от![]() до
до![]() ,
определяется выражением
,
определяется выражением![]()
![]() ,
,
где
![]() число
молекул в объеме газа,
число
молекул в объеме газа,![]() – функция распределения,
– функция распределения,![]() –заданный
малый интервал скоростей. Искомая
вероятность будет равна
–заданный
малый интервал скоростей. Искомая
вероятность будет равна![]() .
.
Учитывая
малость интервала относительных
скоростей, можно считать, что мы ищем
величину
![]() ,
где
,
где![]() ,
,![]() ,
поэтому
,
поэтому
![]() .
Подставляя числовые значения исходных
величин, получим
.
Подставляя числовые значения исходных
величин, получим![]() ;
;![]() .
.
Ответ:
При заданных
значениях М и
![]() вероятность
обнаружить молекулы идеального газа
со скоростями, находящимися в интервале
от
вероятность
обнаружить молекулы идеального газа
со скоростями, находящимися в интервале
от
![]() до
до![]() равна
равна
![]() .
.
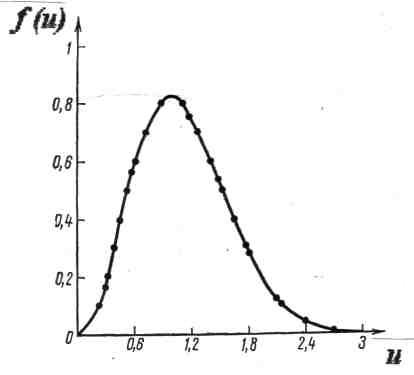
Примечание.
Таким
же методом можно определить вероятность
того, что молекулы
идеального газа
имеют скорости теплового движения в
любом конечном интервале относительных
скоростей от
![]() до
до![]() .
Для этого необходимо разбить этот
интервал
.
Для этого необходимо разбить этот
интервал![]() на
некоторое число
на
некоторое число![]() интервалов
интервалов![]() ,
т.е. принять, что
,
т.е. принять, что![]() и
провести вычисления вышеизложенным
методом, т.е. найти вероятности
и
провести вычисления вышеизложенным
методом, т.е. найти вероятности![]() .
Искомая вероятность
.
Искомая вероятность![]() .
.
З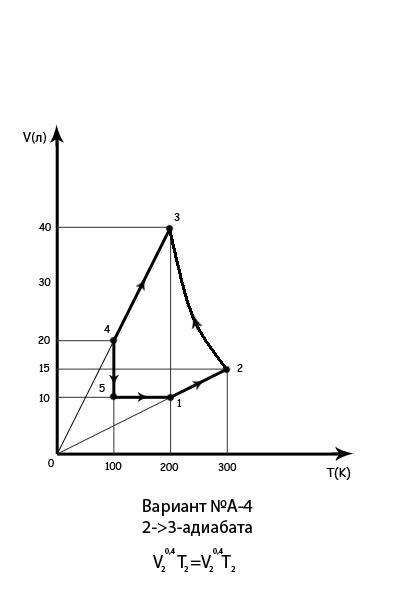 адача
2.
Идеальный двухатомный газ (молекулы с
жесткой связью,
адача
2.
Идеальный двухатомный газ (молекулы с
жесткой связью,
![]() находится в состоянии 1, параметры
которого показаны на графике (см. рис.).
Путем последовательного применения
изопроцессов:
находится в состоянии 1, параметры
которого показаны на графике (см. рис.).
Путем последовательного применения
изопроцессов:![]()
![]()
![]()
![]()
![]() газ переводится в исходное состояние
(совершает цикл – круговой замкнутый
процесс). Укажите, как называется каждый
из этих изопроцессов. Для каждого из
указанных процессов определите:
газ переводится в исходное состояние
(совершает цикл – круговой замкнутый
процесс). Укажите, как называется каждый
из этих изопроцессов. Для каждого из
указанных процессов определите:
изменение
внутренней энергии
![]() совершенную работу
совершенную работу![]() переданное количество теплоты
переданное количество теплоты![]() изменение энтропии
изменение энтропии![]() ;
а так же работу, совершенную газом
;
а так же работу, совершенную газом![]() за
весь цикл, и КПД цикла
за
весь цикл, и КПД цикла![]()
Дано:
![]()
![]()
![]()
![]()
![]()
Определить:
![]()
![]()
![]() и
и![]() (для каждого процесса);
(для каждого процесса);![]() и
и![]()
Решение.
1)Процесс
![]() – изобарный, из уравнения Менделеева
– Клапейрона
– изобарный, из уравнения Менделеева
– Клапейрона![]() ,
где
,
где![]() количество
вещества,
количество
вещества,![]() молярная
газовая постоянная, находим
молярная
газовая постоянная, находим![]()
![]() На
основании первого закона термодинамики:
На
основании первого закона термодинамики:![]() где
где![]() количество
теплоты полученное газом,
количество
теплоты полученное газом,![]() – изменение внутренней энергии газа,
– изменение внутренней энергии газа,![]() – работа газа при изобарном расширении.
Изменение
энтропии газа в изобарном процессе
определяется выражением:
– работа газа при изобарном расширении.
Изменение
энтропии газа в изобарном процессе
определяется выражением:
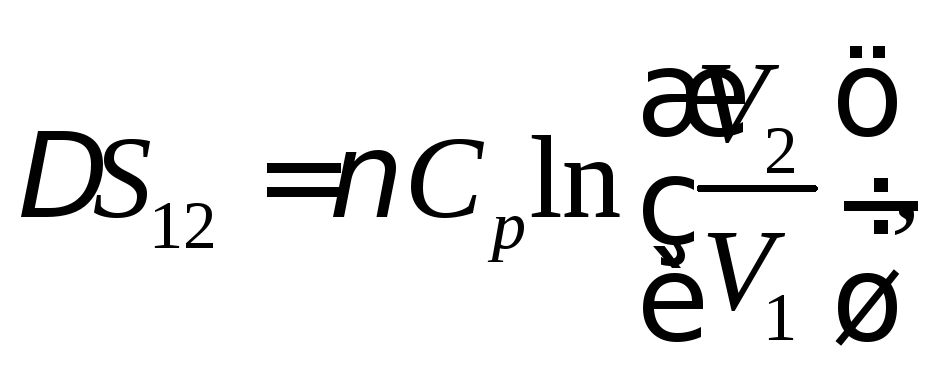 где
где![]() изобарная
теплоемкость газа,
изобарная
теплоемкость газа,![]() – число степеней свободы (двухатомный
газ). Подставив числовые значения,
найдем:
– число степеней свободы (двухатомный
газ). Подставив числовые значения,
найдем:
![]()
![]()
![]() ,
,
![]()
2)
Процесс
![]() – адиабатный, поэтому
– адиабатный, поэтому![]() и
и![]() Работа расширения газа в адиабатном
процессе
Работа расширения газа в адиабатном
процессе![]() где
где![]() изохорная
теплоемкость газа, а изменение внутренней
энергии газа
изохорная
теплоемкость газа, а изменение внутренней
энергии газа![]()
Подставив числовые значения, найдем:
![]()
![]()
Процесс
 изобарный.
изобарный.
3)
Процесс
![]() изобарный.
Из уравнения Менделеева – Клапейрона
изобарный.
Из уравнения Менделеева – Клапейрона![]() ,
находим
,
находим![]()
![]() Аналогично
пункту [1] определим в этом процессе
изменение внутренней энергии
Аналогично
пункту [1] определим в этом процессе
изменение внутренней энергии![]() ,
работу газа
,
работу газа![]() и
изменение энтропии
и
изменение энтропии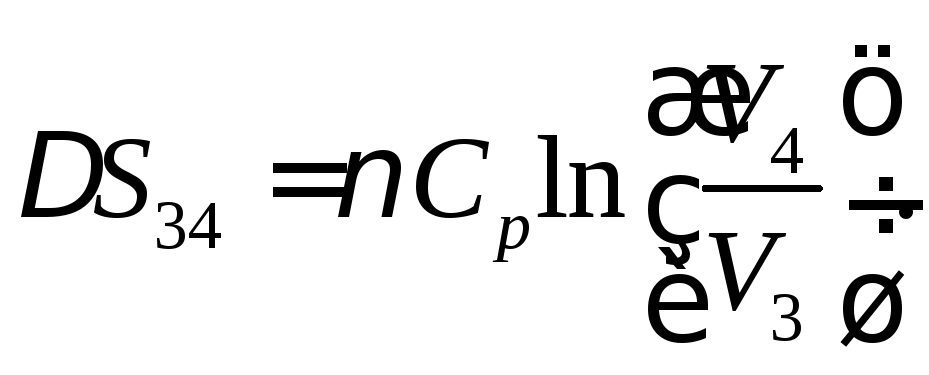 Подставив числовые значения, найдем:
Подставив числовые значения, найдем:
![]()
![]()
![]() ,
,
![]()
4)
Процесс
![]() изотермический,
поэтому изменение внутренней энергии
в этом процессе
изотермический,
поэтому изменение внутренней энергии
в этом процессе![]() количество теплоты и работа
количество теплоты и работа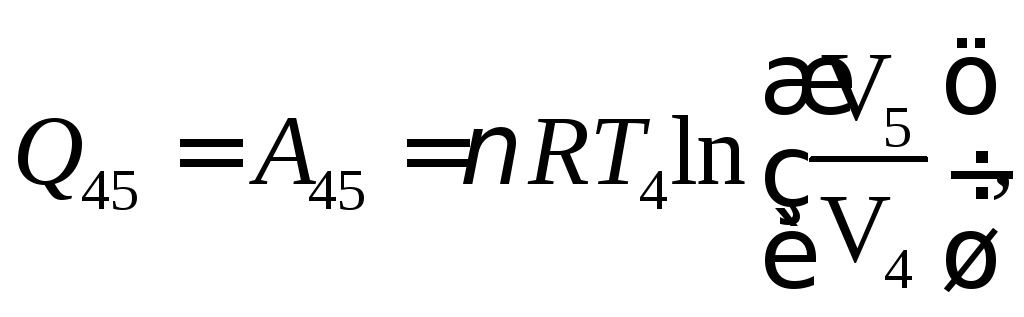 а
изменение энтропии
а
изменение энтропии
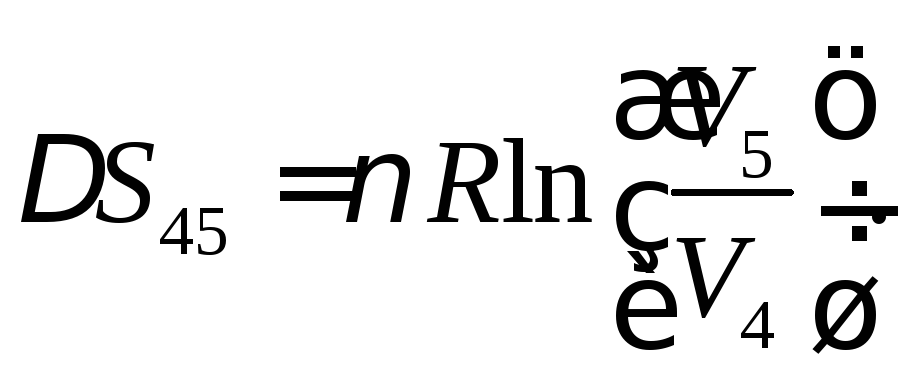 Подставив
числовые значения, найдем:
Подставив
числовые значения, найдем:
![]()
![]() ,
,![]()
5)
Процесс
![]() изохорный,
поэтому работа газа
изохорный,
поэтому работа газа![]() количество
теплоты и изменение внутренней энергии
количество
теплоты и изменение внутренней энергии![]() а изменение энтропии
а изменение энтропии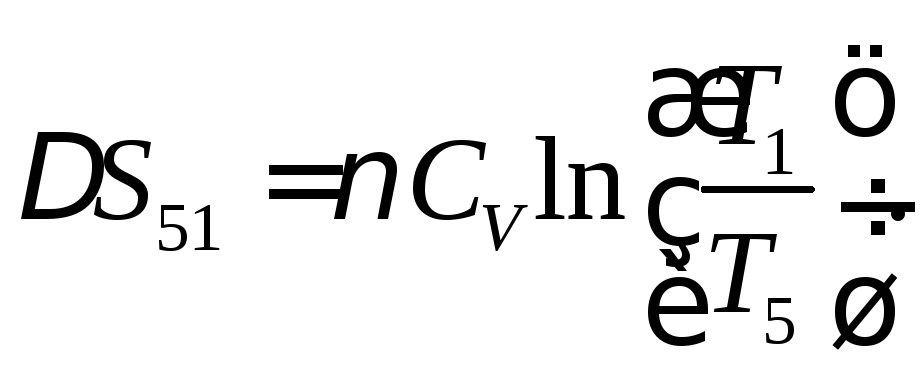 Подставив числовые значения, найдем:
Подставив числовые значения, найдем:![]()
![]()
Работа
цикла
![]()
![]()
КПД
цикла
![]()
![]() или
или![]()
Подставив
числовые значения, можно убедиться, что
для всего цикла
![]() и
и![]()
Задача
3. Найти
среднюю кинетическую энергию ![]() поступательного движения одной молекулы
кислорода при температуре
поступательного движения одной молекулы
кислорода при температуре ![]() ,
а также кинетическую энергию
,
а также кинетическую энергию ![]() поступательного движения всех молекул,
содержащих
поступательного движения всех молекул,
содержащих ![]() кислорода.
кислорода.
Решение. Средняя кинетическая энергия поступательного движения одной молекулы любого газа равна
![]() ,
,
где
![]() – постоянная Больцмана. Подставляя в
значенияk
и температуры, находим
– постоянная Больцмана. Подставляя в
значенияk
и температуры, находим
![]() .
.
Кинетическую
энергию поступательного движения всех
молекул найдём, если умножим среднюю
энергию ![]() одной молекулы на число N
молекул, которое можно определить из
соотношения
одной молекулы на число N
молекул, которое можно определить из
соотношения
![]() ,
,
где
![]() – число Авогадро,
– число Авогадро,![]() – молярная масса кислорода. Таким
образом,
– молярная масса кислорода. Таким
образом,
![]() ,
,
где
![]() – универсальная газовая постоянная.
Подставляя в числовые значения, находим
– универсальная газовая постоянная.
Подставляя в числовые значения, находим
![]() .
.
Ответ:
![]() ;
;![]() .
.
Задача
4.
Вычислить удельные теплоёмкости при
постоянном объёме
![]() и при постоянном давлении
и при постоянном давлении![]() неона и водорода, принимая эти газы за
идеальные.
неона и водорода, принимая эти газы за
идеальные.
Решение. Удельные теплоёмкости идеальных газов выражаются формулами:
![]() ,
,
![]() ,
,
где i – число степеней свободы молекулы газа;
M – молярная масса.
Для
неона (одноатомный газ)
![]() и молярная масса
и молярная масса![]() .
.
Произведём вычисления:
![]() ,
,
![]() .
.
Для
водорода (двухатомный газ)
![]() и молярная масса
и молярная масса![]() .
Тогда
.
Тогда
![]() ,
,
![]() .
.
Ответ:
Для неона
![]() ,
,![]() ;
;
для
водорода
![]() ,
,![]() .
.
Задача
5. Разрядная трубка
гелий-неонового лазера объёмом ![]() заполняется смесью гелия и неона с
парциальными давлениями
заполняется смесью гелия и неона с
парциальными давлениями
![]() и
и![]() ,
соответственно. Определить внутреннюю
энергию газов.
,
соответственно. Определить внутреннюю
энергию газов.
Решение. Внутреннюю энергию идеального газа можно определить из соотношения
![]() ,
,
где
![]() – удельная теплоёмкость газа при
постоянном объёме,T
– температура газа, m
– масса газа. Так как внутренняя энергия
является аддитивной величиной, то для
смеси газов она равна
– удельная теплоёмкость газа при
постоянном объёме,T
– температура газа, m
– масса газа. Так как внутренняя энергия
является аддитивной величиной, то для
смеси газов она равна
![]() ,
,
где
![]() ,
,![]() – массы гелия и неона,
– массы гелия и неона,![]() ,
,![]() – их удельные теплоёмкости.
– их удельные теплоёмкости.
Для удельной теплоёмкости идеального газа имеем формулу
![]() ,
,
где
![]() – молярная газовая постоянная, i
– число степеней свободы молекулы газа.
Так как газы гелий и неон являются
одноатомными, то для них
– молярная газовая постоянная, i
– число степеней свободы молекулы газа.
Так как газы гелий и неон являются
одноатомными, то для них
![]() .
Поэтому их удельные теплоёмкости равны
.
Поэтому их удельные теплоёмкости равны
![]() ,
,
![]() .
.
Подставляя выражение в выражение для внутренней энергии , находим
![]() ,
,
откуда
![]() ,
,
![]() .
.
Парциальные давления каждого газа в смеси газов удовлетворяют уравнению Клапейрона-Менделеева, т.е.
![]() ,
,
![]() .
.
Подставляя правые части уравнений в уравнения , получаем
![]() ,
,
![]() .
.
Произведём вычисления:
![]() ,
,
![]() .
.
Внутренняя энергия смеси газов равна
![]() .
.
Ответ:
![]() ;
;![]() ;
;![]() .
.
Задача
6.
Двухатомный газ занимает объём ![]() и находится под давлением
и находится под давлением ![]() .
Газ сжимается адиабатически до некоторого
объёма
.
Газ сжимается адиабатически до некоторого
объёма ![]() и давления
и давления ![]() .
Затем он охлаждается при
.
Затем он охлаждается при
![]() до первоначальной температуры, причём
его давление становится равным
до первоначальной температуры, причём
его давление становится равным![]() .
Построить график этого процесса. Найти
объём
.
Построить график этого процесса. Найти
объём ![]() и давление
и давление ![]() .
.
Р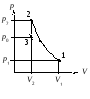 ешение.
Исходя из данных условия задачи, построим
график процесса, который изображён на
рисунке.
ешение.
Исходя из данных условия задачи, построим
график процесса, который изображён на
рисунке.
Запишем уравнение Клапейрона-Менделеева для газа в состояниях 1, 2 и 3:
![]() ,
,
![]() ,
,
![]() ,
,
где m – масса газа;
– молярная масса газа.
По условию задачи состояния 1 и 2 связаны соотношением
![]() ,
,
а для состояний 2 и 3 имеют место условия
![]() ,
,
![]() ,
,![]() .
.
Постоянная адиабаты определяется как
![]() ,
,
где
![]() – удельная теплоёмкость газа при
постоянном объёме;
– удельная теплоёмкость газа при
постоянном объёме;
![]() –удельная
теплоёмкость газа при постоянном
давлении;
–удельная
теплоёмкость газа при постоянном
давлении;
i – число степеней свободы молекулы газа.
Молекула
двухатомного газа имеет 5 степеней
свободы,
![]() .
Следовательно, постоянная адиабаты для
такого газа равна
.
Следовательно, постоянная адиабаты для
такого газа равна
![]() .
.
Так как
в уравнениях ![]() и
и ![]() ,
то левые части первого и третьего
уравнений равны, т.е.
,
то левые части первого и третьего
уравнений равны, т.е.
![]() ,
,
откуда
находим объём
![]() :
:
![]() .
.
Давление
![]() найдём из уравнения адиабаты
найдём из уравнения адиабаты
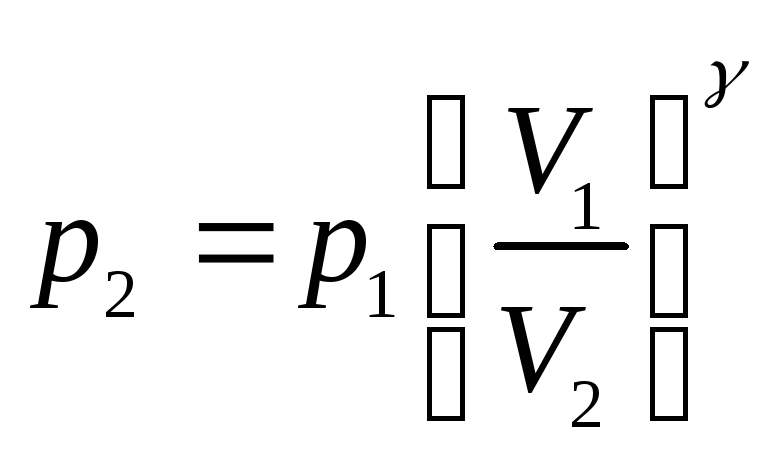 .
.
Произведём вычисления:
![]() .
.
Ответ:
![]() ;
;![]() ,
где для двухатомного газа
,
где для двухатомного газа![]() .
.
Задача
7.
Газ, совершая цикл Карно,
к.п.д. которого ![]() ,
при изотермическом расширении производит
работу
,
при изотермическом расширении производит
работу ![]() .
Какова работа, совершаемая газом при
изотермическом сжатии?
.
Какова работа, совершаемая газом при
изотермическом сжатии?
Решение. КПД цикла Карно определяется по формуле
![]() ,
,
где
![]() – теплота, полученная от теплоотдатчика,
равная работе, совершаемой газом при
расширении,
– теплота, полученная от теплоотдатчика,
равная работе, совершаемой газом при
расширении,![]() – количество тепла, отданное газом
холодильнику, равное работе, совершаемой
над газом при его сжатии. Поэтому работа
газа при его сжатии будет отрицательной
и равной
– количество тепла, отданное газом
холодильнику, равное работе, совершаемой
над газом при его сжатии. Поэтому работа
газа при его сжатии будет отрицательной
и равной![]() .
Таким образом, из получаем
.
Таким образом, из получаем
![]() .
.
Ответ:
![]() .
.
