
- •Часть 1
- •Общие методические указания
- •Указания к самостоятельной работе с учебными пособиями
- •Указания к решению задач
- •Указания к оформлению и выполнению контрольныхработ
- •Раздел 1. Физические основы механики
- •Раздел 2. Колебания и волны.
- •Раздел 3. Молекулярная физика и термодинамика.
- •Раздел 4. Электродинамика
- •Краткие теоретические сведения и основные формулы Физические основы классической механики
- •Кинематика частицы и абсолютно твердого тела
- •Динамика частицы.
- •Работа и энергия
- •Динамика твердого тела
- •Механические колебания.
- •Молекулярная физика.
- •Основы термодинамики.
- •Электростатика
- •Постоянный электрический ток
- •Примеры решения задач Кинематика частицы и абсолютно твердого тела Динамика частицы и механической системы.
- •Колебания и волны.
- •Основы молекулярной физики и термодинамики
- •Электродинамика
- •Контрольная работа 1
Основы термодинамики.
Число степеней свободы– это количество независимых переменных (координат), с помощью которых можно однозначно задать положение механической системы в пространстве. Число степеней свободы также равно числу независимых движений, которые может совершать механическая система. Для одноатомной молекулы газа число степеней свободыi=3, для двухатомной молекулы с жёсткой связьюi=5,для многоатомного газаi=6.
Внутренняя энергия многоатомного газаU представляет собой суммарную кинетической энергии теплового движения всех ее молекул и их потенциальной энергии взаимодействия.
Средняя энергия теплового движения молекул
![]()
Внутренняя энергия многоатомного идеального газа равна
![]()
Внутренняя энергия макросистемы зависит только от термодинамического состояния этой системы. Внутренняя энергия является однозначной функцией состояния термодинамической системы и не зависит от способа перехода этой системы в данное состояние.
Количество теплоты Q (теплота)–энергия, переданная макросистеме путем теплообмена, т.е. в результате процесса передачи энергии от одного тела другому без совершения работы. Единица количества теплоты – джоуль (Дж).
Теплоёмкостью С системы называется величина, равная отношению сообщённого системе количества тепла δQк изменению температуры системыdT
![]()
Удельная теплоёмкость с– теплоёмкость единицы массы вещества
![]()
Молярная теплоёмкость С– теплоёмкость одного моля.
С=Мс
Зная удельную или молярную теплоёмкость системы, можно определить количество теплоты, полученной системой.
Элементарная работа δА сил давления газа при малом изменении dV его объема равна
δА=рdV
где p – давление газа.
Полную работу А, совершаемую газом при изменении его объёма от V1 доV2 , найдём с помощью интегрирования
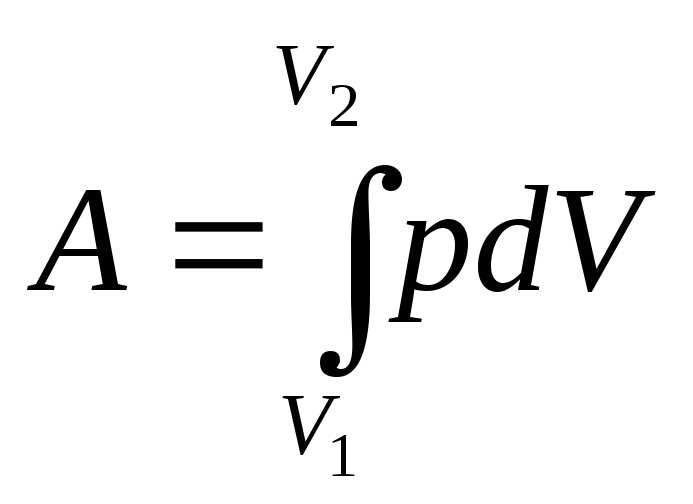
Графически работа определяется по площади заштрихованной фигуры (рис. 8)
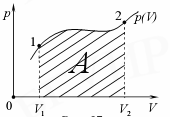
Рис. 8.
Работа зависит от процессов, протекающих в газе.
При изохорном процессе (V= const) А=0.
При изобарном расширении (p= const) A = p(V2-V1).
При изотермическом расширении (T= const)
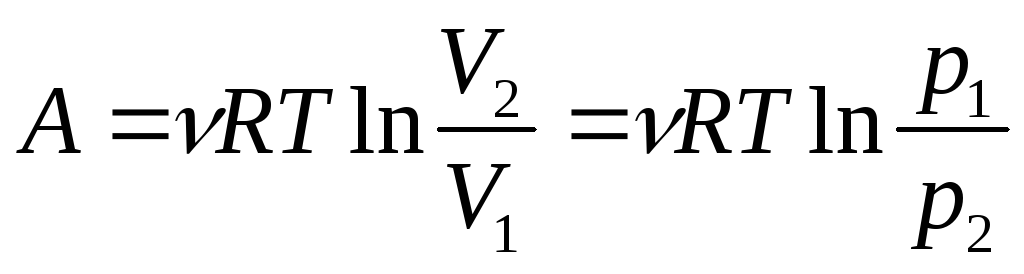 .
.
В основу термодинамики положены законы, являющиеся обобщением опытных фактов. Их называют начала термодинамики.
Первое началотермодинамики – закон сохранения энергии применительно к тепловым процессам. Количество теплоты Q, переданное макросистеме, идет на изменение ее внутренней энергииdU и на совершение работы A над внешними телами.
Математическое выражение I начала термодинамики в дифференциальной форме (для элементарного термодинамического процесса) имеет вид:
δQ= dU + δA.
Применение первого начала к изопроцессам.
Изохорный процесс. Количество теплоты, переданное газу идёт только на приращение его внутренней энергии Q=ΔU=CvdT, гдеCv- молярная теплоёмкость газа при постоянном объёме.
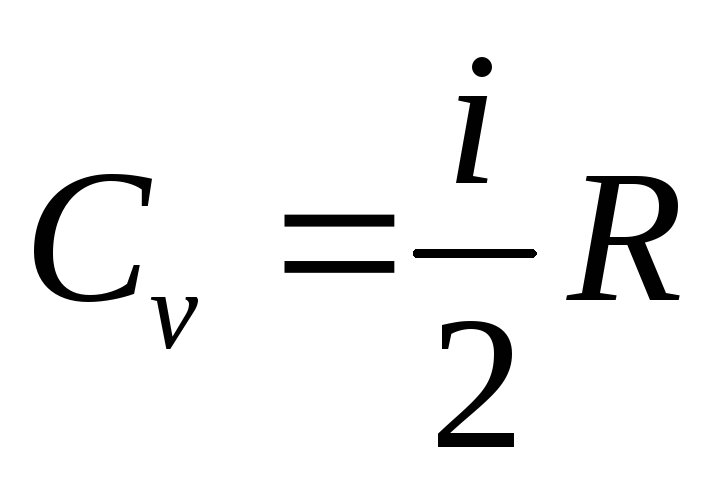 .
.Изобарный процесс. Количество теплоты Q, переданное газу при изобарном процессе, идет на приращение внутренней энергии ΔUгаза и на совершение работы A его силами давления:

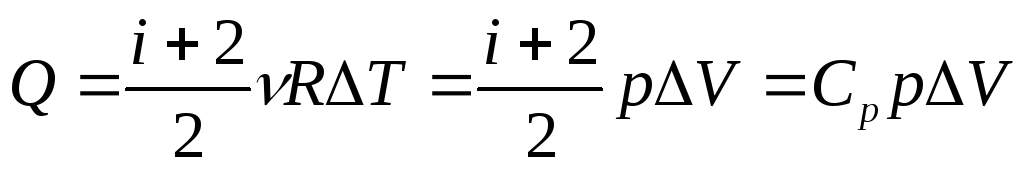 ,
гдеСp–
теплоёмкость при постоянном давлении.
,
гдеСp–
теплоёмкость при постоянном давлении.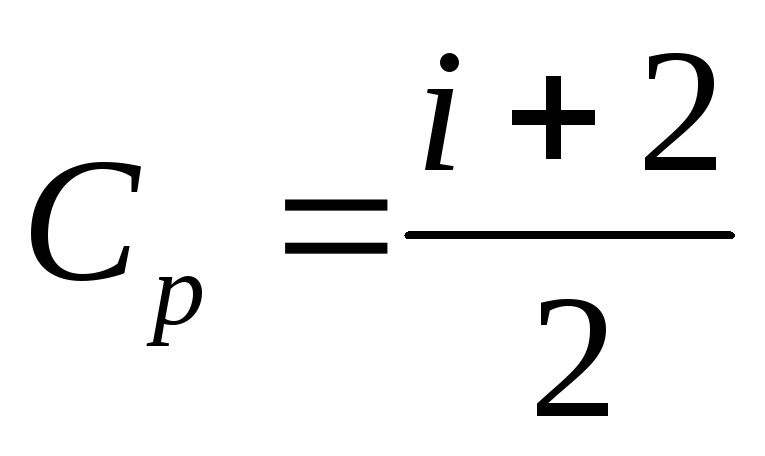 .
РазностьСp-Cv=Rназывают уравнением Майера.
.
РазностьСp-Cv=Rназывают уравнением Майера.Изотермический процесс. Количество теплоты Q, переданное газу при изотермическом процессе, идет только на совершение работы A силами давления этого газа: A= Q .
Адиабатический (адиабатный) процесс. Это - процесс, протекающий без обмена с окружающей средой. Уравнение адиабатного процесса (уравнение Пуассона):
![]()
где
![]() -адиабатическая постоянная или
коэффициент Пуассона.
-адиабатическая постоянная или
коэффициент Пуассона.
Адиабата (рис.9, кривая 2) на координатной плоскости pVидет круче изотермы ( кривая 1).
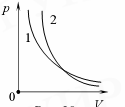
Рис. 9.
Первое начало термодинамики имеет вид: А = - ΔU, т.е. работа системы совершается за счёт уменьшения внутренней энергии.
Круговым процессом (или циклом)называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. На рV -диаграмме цикл (рис.10) изображается замкнутой кривой, где участок 1→2 соответствует расширению, а 2→1– сжатию газа.
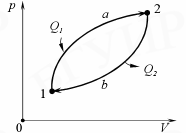
Рис. 10.
Тепловой двигатель(машина) – периодически действующее устройство, преобразующее теплоту в механическую работу. Любой тепловой двигатель
работает по круговому процессу (циклу).
Карно показал, что наиболее экономичным является двигатель, работающий по обратимому круговому циклу, состоящему из двух изотерм и двух адиабат (рис.11).

Рис. 11.
1→2 – газ изотермически (T1=const ) расширяется, получая от нагревателя с температурой T1количество тепла Q1,
2→3 – газ адиабатически расширяется, охлаждаясь до температуры Т2,
3→4 – газ изотермически (T2=const) сжимается, отдавая холодильнику количество во теплоты Q2;
4→1 - газ адиабатически сжимается, при этом его температура увеличивается до Т2.
Теоремы Карно.
1.КПД цикла Карно с идеальным газом η зависит только от температуры нагревателя и температуры холодильника.
![]()
![]()
2.КПД любого теплового двигателя η1не может превышать КПД теплового двигателя, работающего по циклу Карно в том же интервале температур:
η1 ≤η
КПД любого теплового двигателя можно также определить, как величину, равную отношению работы А, совершённой системой, к количеству тепла, полученному от нагревателя.
![]()
II начало термодинамикиопределяет направление процессов, происходящих в природе и связанных с превращением энергии
II начало термодинамики (формулировка Р. Клаузиуса, 1850 г.): невозможен процесс, единственным конечным результатом которого был бы переход теплоты от менее нагретого тела к телу более нагретому.
II начало термодинамики (формулировка У.Томсона (Кельвина), 1851 г.):
невозможны круговые процессы, единственным и конечным результатом кото-
рых было бы превращение всего полученного тепла целиком в работу.
Энтропия системы
S.Это величина,
которая является функцией состояния
системы. Энтропия характеризует
направление протекания самопроизвольных
процессов в замкнутой термодинамической
системе. Дифференциал этой величины
![]() .
.
При переходе системы из состояния 1 в состояние 2
![]() .
.
В замкнутой системе
для обратимых процессов
![]() =0,
для необратимых -
=0,
для необратимых -![]() ›0.
›0.
Изменение энтропии в процессах идеального газа:
Изохорный (V=const)
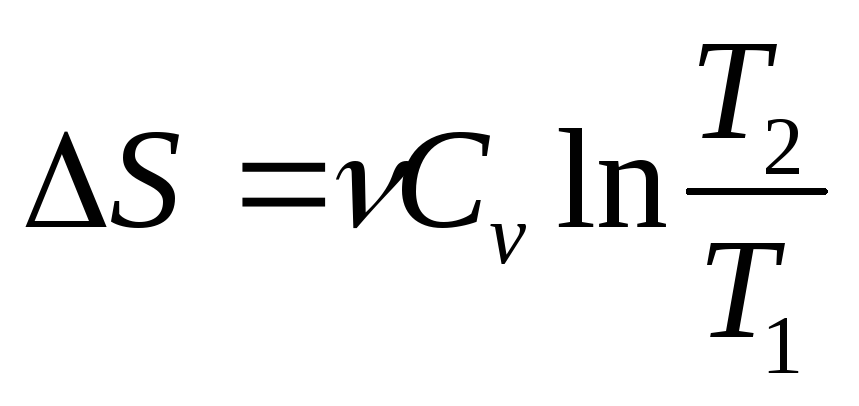 ;
;Изобарный (р=const)
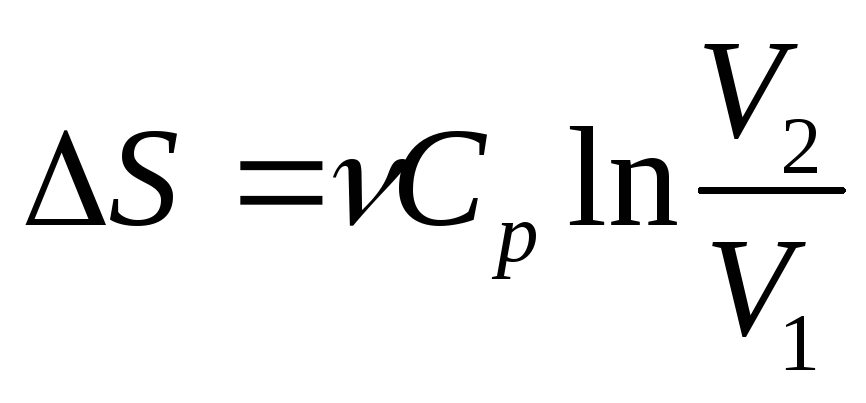 ;
;Изотермический (Т= const)
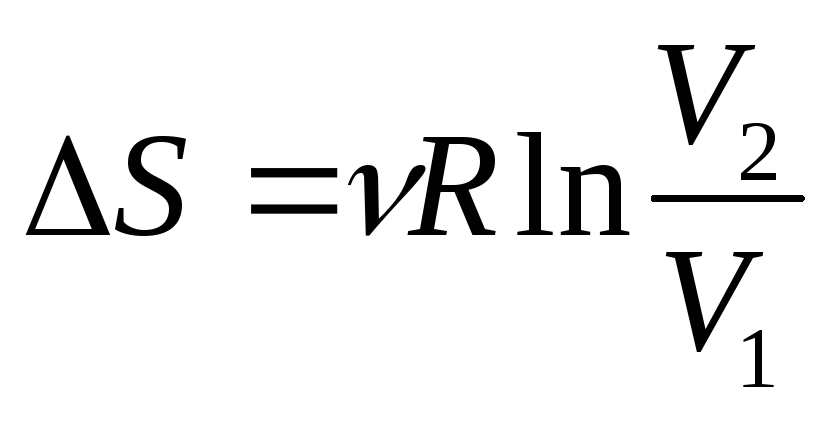 ;
;Адиабатический ΔS = 0.
Статистическое толкование энтропии. Число способов, которыми может быть реализовано данное термодинамическое состояние называетсятермодинамической вероятностью W. Как показал Больцман, энтропия пропорциональна натуральному логарифму W:
![]() ,
,
где k-постоянная Больцмана.
Принцип возрастания энтропии. Любой необратимый процесс в замкнутой системе протекает так, что энтропия системы возрастает.
Третье начало термодинамики.Энтропия всех систем в состоянии равновесия стремится к нулю при приближении температуры системы к абсолютному нулю.
![]()
Это утверждение носит название теоремы Нернста-Планка.
