
- •Предисловие
- •Введение молекулярная физика и термодинамика
- •1. Основы молекулярно-кинетической теории газов
- •1.1. Основное уравнение кинетической теории газов
- •1. 2. Вероятность
- •1.3. Распределение Максвелла
- •1.4. Экспериментальная проверка закона распределения.
- •1.5. Распределение Больцмана. Барометрическая формула.
- •1.6 Распределение Гиббса
- •1.7 Средняя длина свободного пробега молекул
- •1.8 Распределение энергии по степеням свободы.
- •1.9 Явления переноса
- •Соотношения между коэффициентами переноса
- •2 Термодинамика
- •2.1Первое начало термодинамики
- •2.2. Теплоемкость идеальных газов и адиабатный процесс
- •2.3 Энтропия
- •2.4 Второе начало термодинамики
- •2.5 Цикл Карно и кпд тепловой машины
- •3.1 Реальные газы
- •Вопросы Основные понятия молекулярной физики.
- •Молекулярно-кинетическая теория идеального газа
- •I – е начало термодинамики
- •II – е начало термодинамики
- •Фазовое равновесие и фазовые превращения
- •Примеры решения задач.
- •27 Библиографический список
- •Приложение Математические постоянные
- •Интегралы
- •Основные интегралы и соотношения кинетической теории газов.
- •Таблицы
3.1 Реальные газы
Уравнение Клапейрона-Менделеева для идеального газа не описывает поведение газа при высоких давлениях и при температурах близких к сжижению. Независимо от формы молекул газа, свободный для их движения объем всегда меньше объема сосуда, в котором газ находится. В случае реальных газов необходимо учитывать и силы взаимодействия между молекулами. Следовательно, если в уравнении Клапейрона-Менделеева V представляет объем, свободный для движения молекул, то в случае реальных газов этот объем будет (V-b), где b - поправка на размеры молекул.
Внутреннее давление p, создаваемое силами взаимодействия между молекулами, направлено так же, как и внешнее давление - внутрь газа и будет пропорционально как числу притягивающих n, так и числу притягиваемых n молекул в единице объема газа:

где а - характерный для газа коэффициент связи молекул; V - объем киломоля газа. Таким образом, уравнение состояния реального газа - уравнение Ван-дер-Ваальса для киломоля газа имеет вид
![]() (3.1.1)
(3.1.1)
Рассмотрим изменения в кривых изотерм уравнения состояния pV=RT, которые обусловлены поправками, введенными в уравнении Ван-дер-Ваальса. На рис.(3.1.1 ) в координатах p и V различные кривые показывают, каким образом давление меняется при изменении объема для различных значений температуры. Каждая точка соответствует условию равновесия для данного вещества. Штрихованные кривые описывают поведение идеального газа, а сплошные - реального. Кривые такого рода называют изотермами.
Рис.3.1.1.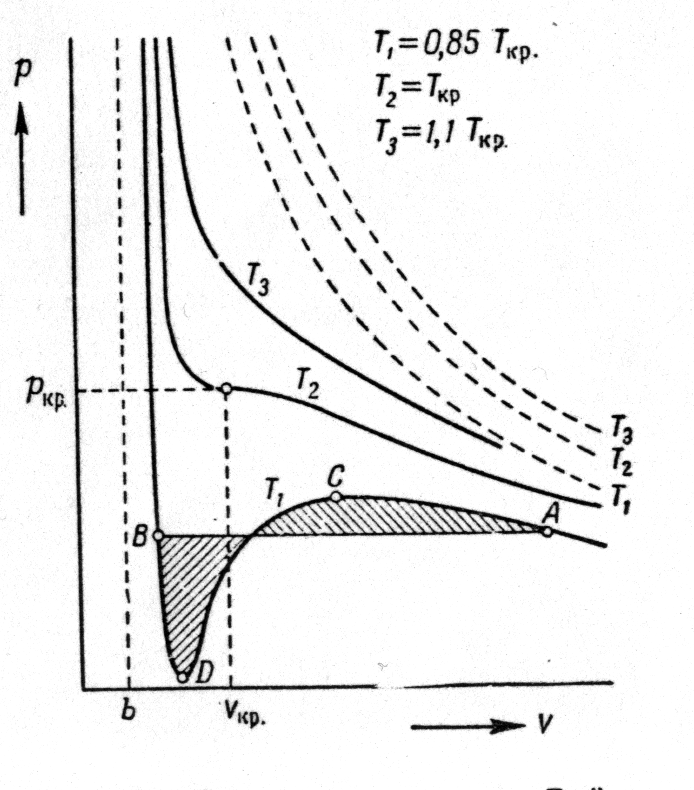
При достаточно низких температурах (кривая приТ1) поправка a/V2 играет существенную роль, и давление проходит через максимум в точке С.
Кривая при Т2 отвечает условиям так называемой критической температуры, на которой имеется точка перегиба (ркр,Vкр) - критическая точка. При температурах выше критической даже при повышении давления газ не переходит в жидкое состояние. При температурах ниже критической с повышением давления газ переходит в жидкое состояние.
Параметры критической
точки (pкр,
Vкр,
Tкр)
можно рассчитать из условий того, что
касательная к изотерме в ней идет
горизонтально -
![]() ,
и критическая точка является точкой
перегиба
,
и критическая точка является точкой
перегиба![]()
Таким образом, имеем:
![]()
![]()
![]()
Из этих трех уравнений можно определить три параметра критической точки
Vкр=3b, pкр=a/(27b2), RTкр=8a/(27b).
При достаточно высоких давлении и температуре ниже критической газ переходит в жидкое состояние. Если температура выше критической, газ в жидкое состояние не переходит. Для некоторых веществ критические температуры указаны в таблице …..
Связь состояния вещества с термодинамическими параметрами может быть представлена на диаграмме состояния в координатах р и Т, которую называют фазовой диаграммой. На рис. 3.1.2 представлена фазовая диаграмма для воды (обратите внимание на то, что шкалы не линейны).
Рис.3.1.2

На этой диаграмме имеет место пересечение трех кривых: сублимация (переход твердого вещества в пар) -т-п, плавления -т-ж, и кипения - ж-п. Точка пересечения этих трех кривых называется тройной точкой, которая соответствует условиям равновесного сосуществования трех фаз - газообразной, жидкой и твердой. Примеры параметров тройной точки приведены в таблице…..
При равновесных фазовых превращениях соблюдается, так называемое правило Гиббса.
Количество фаз n, находящихся в равновесии n k+2, где k - число компонентов в термодинамической системе. Число фаз не может превышать число компонентов более, чем на два.
Пользуясь правилом фаз, можно рассчитать количество независимых переменных, при которых сохраняется фазовое равновесие, число
i= k-n+2
называется числом степеней свободы или числом независимых параметров состояния термодинамической системы. В частности для одного компонента k=1, nmax=3 - газ, жидкость и твердое состояние в тройной точке.
Когда одно вещество (k=1) находится в фазовом равновесии (n=2), тогда i=1 и давление связано с температурой посредством уравнения Клапейрона-Клаузиуса, связывающего наклон кривой равновесия фаз dp/dT, с изменением энтропии S и изменением объема V обеих фаз при данных температуре и давлении
![]()
где L12- скрытая теплота перехода из первой фазы во вторую, когда обе фазы, находятся в равновесном состоянии. Если V- молярный объем, тогда L - скрытая теплота для моля, если же V - удельный объем, L - удельная теплота перехода. Уравнение Клапейрона-Клаузиуса действительно при фазовых переходах первого рода для чистых веществ.
Когда жидкость
или твердое тело переходит в газообразное
состояние, давление насыщенного пара
над ними с увеличением температуры
возрастает:
![]() В случае перехода из твердого состояния
в жидкое (плавление) для большинства
веществ увеличение давления приводит
к повышению температуры плавления.
Однако некоторые вещества (вода, гелий,
германий, кремний и др.) обладают
аномальными свойствами, и для них
повышение давления приводит к понижению
температуры плавления. Пользуясь
уравнением Клапейрона-Клаузиуса, можно
рассчитать давление насыщенного пара
над жидкостью или твердым телом при
определенной температуре
В случае перехода из твердого состояния
в жидкое (плавление) для большинства
веществ увеличение давления приводит
к повышению температуры плавления.
Однако некоторые вещества (вода, гелий,
германий, кремний и др.) обладают
аномальными свойствами, и для них
повышение давления приводит к понижению
температуры плавления. Пользуясь
уравнением Клапейрона-Клаузиуса, можно
рассчитать давление насыщенного пара
над жидкостью или твердым телом при
определенной температуре
![]() ,
,
где р0 - некоторая постоянная.
