
- •Предисловие
- •Введение молекулярная физика и термодинамика
- •1. Основы молекулярно-кинетической теории газов
- •1.1. Основное уравнение кинетической теории газов
- •1. 2. Вероятность
- •1.3. Распределение Максвелла
- •1.4. Экспериментальная проверка закона распределения.
- •1.5. Распределение Больцмана. Барометрическая формула.
- •1.6 Распределение Гиббса
- •1.7 Средняя длина свободного пробега молекул
- •1.8 Распределение энергии по степеням свободы.
- •1.9 Явления переноса
- •Соотношения между коэффициентами переноса
- •2 Термодинамика
- •2.1Первое начало термодинамики
- •2.2. Теплоемкость идеальных газов и адиабатный процесс
- •2.3 Энтропия
- •2.4 Второе начало термодинамики
- •2.5 Цикл Карно и кпд тепловой машины
- •3.1 Реальные газы
- •Вопросы Основные понятия молекулярной физики.
- •Молекулярно-кинетическая теория идеального газа
- •I – е начало термодинамики
- •II – е начало термодинамики
- •Фазовое равновесие и фазовые превращения
- •Примеры решения задач.
- •27 Библиографический список
- •Приложение Математические постоянные
- •Интегралы
- •Основные интегралы и соотношения кинетической теории газов.
- •Таблицы
1.3. Распределение Максвелла
В равновесном состоянии в системе, состоящей из огромного числа частиц, например в некотором объеме газа, при отсутствии внешних воздействий не происходит макроскопических изменений: параметры системы остаются постоянными. Постоянным остается и среднее значение скорости молекул. Ответ на вопрос, сколько молекул, или какая их часть движется с определенной скоростью в данный момент, был теоретически получен Максвеллом.
Введем понятие пространства скоростей. Для каждой молекулы откладываем компоненты ее скорости по трем взаимно перпендикулярным осям (рис. 1.3.1).

Каждая точка в пространстве скоростей соответствует одной молекуле с определенной скоростью. Вектор скорости идет от начала координат к рассматриваемой точке.
Рассмотрим, как будут распределены молекулы, содержащиеся в единичном объеме газа по скоростям.
Эти молекулы будут изображаться совокупностью из n точек. Из-за столкновений молекул какие-то точки будут выходить из элемента объема, а другие входить в него. Однако среднее число точек в данном элементе объема сохраняется.
Закон Максвелла описывается некоторой функцией f(v), которая называется функция распределения молекул по скоростям. Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, т.е.
![]() ,
откуда
,
откуда
![]() .
.
Применяя методы теории вероятностей, Максвелл нашел эту функцию:
![]() (1.3.1)
(1.3.1)
Из формулы видно, что конкретный вид функции зависит от рода газа (от массы молекулы m0) и от параметра состояния (температуры T).
График функции f(v) приведен на рис.1.3.2. Функция f(v) начинается от нуля, достигает максимума при vв и затем асимптотически стремится к нулю. Кривая не симметрична относительно vв.
Распределение Максвелла - это распределение по скоростям молекул идеального газа, находящегося в состоянии термодинамического равновесия.
Интегрируя распределение Максвелла, можно рассчитать средние величины. Средний квадрат скорости (средняя квадратичная скорость)

Рис.1.3.2.
Рис.1.3.2
![]() 1.3.2)
1.3.2)
С vв
![]() откуда следует, что
откуда следует, что
![]() (1.3.3)
(1.3.3)
Для того, чтобы найти число молекул, обладающих скоростями в интервале от v1 до v2, необходимо определить площадь под соответствующим участком кривой (рис.1.3.2.)

При увеличении температуры максимум кривой Максвелла смещается в сторону больших скоростей и вид кривой изменяется. Распределения для двух разных температур приведены на рис.1.3.3. Поскольку площадь, ограниченная кривой, остается неизменной, следовательно, при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.

Рис.1.3.3 Т1 Т.
Среднее значение абсолютной величины скорости (среднее значение скорости равно нулю, так как отрицательное и положительное значения компонент равноправны) определяется по формуле
![]() (1.3.4)
(1.3.4)
Таким образом, скорости, характеризующие состояние газа:
наиболее вероятная
 ;
;средняя скорость
 ;
;средняя квадратичная
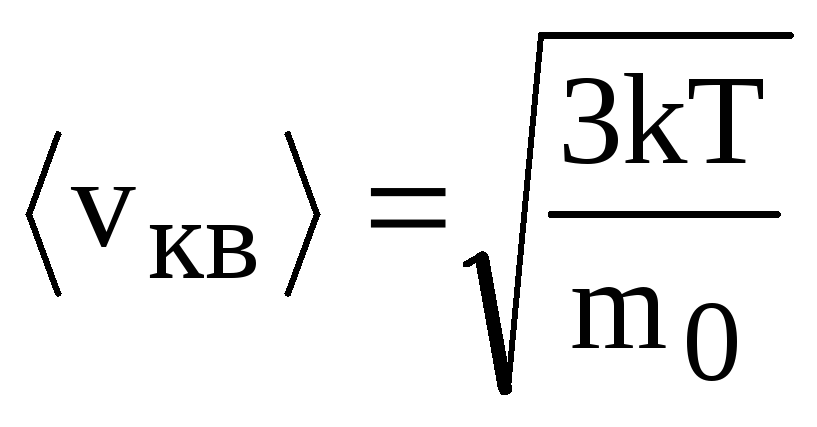 .
.
Эти скорости связаны соотношением
vВ : v : vкв 1:1,13:1,22,
то есть средняя квадратичная скорость имеет наибольшую величину.
Исходя их распределения молекул по скоростям, перейдя к новой переменной Е=m0v2/2, можно получить функцию распределения молекул по энергиям
 (1.3.5)
(1.3.5)
Тогда средняя кинетическая энергия молекулы идеального газа равна
 (1.3.6)
(1.3.6)
Для того, чтобы рассчитать количество молекул N, скорости которых находятся в промежутке от v до v+v, удобно ввести относительную скорость u=v/vВ, где vВ - наиболее вероятная скорость. Тогда N - число молекул, относительные скорости которых находятся в интервале u, u+u, т.е. v/vв, v+v/vВ, где должно быть vv. Таким образом, имеем
![]()
где N - полное число молекул газа, N/N - относительное число (доля) молекул, имеющих скорости в интервале u, u+u. График этой зависимости соответствует рис.1.3.2, если по оси абсцисс отложить u, а по оси ординат величину N/(Nu) - функцию распределения.
Пример7. Определить среднеквадратичную скорость молекул азота при температуре 27С. Как зависит средне квадратичная скорость от молекулярной массы и температуры?
Т=300К, =28 кг/кмоль, k=1,3810-23Дж/град.
Решение.
![]() где
где![]()
![]() ;
;
Таким образом
![]()
Средняя квадратичная скорость прямо пропорциональна корню квадратному из температуры и обратно пропорциональна корню квадратному из молекулярной массы.
