
2. Характеристика протеїногенних амінокислот
Для розуміння хімічної структури і властивостей білків важливе значення має вивчення хімічної природи і властивостей їх елементарних ланок - амінокислот. У природі виявлено багато різних амінокислот, проте до складу більшості білків їх входить лише 20. Близько 10 амінокислот зустрічається у білках досить рідко. Всі амінокислоти, що входять до складу білків, часто називають протеїногенними. Решта амінокислот входить до складу фізіологічно активних речовин (гормонів, коферментів, антибіотиків), або знаходиться в органах та тканинах тварин і рослин у вільному стані - непротеїногенні.
Усі амінокислоти, які виявлено в складі білка, синтезуються в рослинних організмах. В організмі людини і тварин синтезується лише частина протеїногенних амінокислот, а деякі з них утворюються в недостатній кількості для нормального синтезу білка. У зв'язку з цим усі протеїногенні амінокислоти поділяють на три групи: незамінні, напівнезамінні і замінні.
Незамінні амінокислоти - це такі амінокислоти, які в організмі не синтезуються. Тому вони повинні обов'язково поступати в організм ззовні, в основному з їжею. Для організму людини повністю незамінними є вісім амінокислот: валін, лейцин, ізолейцин, треонін, лізин, метіонін, фенілаланін і триптофан.
До напівнезамінних належать амінокислоти, які синтезуються в організмі в недостатній кількості. Такі амінокислоти повинні частково поступати з організм з їжею. Для організму людини такими амінокислотами є аргінін, тирозин і гістидин.
Замінні амінокислоти синтезуються в організмі з цілого ряду органічних сполук, у тому числі з деяких амінокислот. Організм може певний час обходитися без таких амінокислот при умові, що з їжею поступатимуть речовини, з яких синтезуються замінні амінокислоти.
Амінокислоти - похідні карбонових кислот аліфатичного або ароматичного ряду, в молекулах яких один чи кілька атомів водню заміщені на аміногрупу. Залежно від того, біля якого вуглецевого атома заміщено атом водню, розрізняють -, -, - амінокислоти.
В амінокислотах, які входять до складу білків, аміногрупа розміщена біля α-вуглецевого атома, тобто усі вони є α-амінокислотами. Загальну формулу амінокислот можна записати так:
![]()
Амінокислоти відрізняються між собою лише хімічною природою радикалів. Радикал – це угруповання атомів у молекулі амінокислоти, що зв’язане з α-вуглецевим атомом, яке не бере участі у формуванні остова поліпептидного ланцюга, Радикалами є залишки жирних кислот, ароматичні ядра, різні гетероцикли та ін.
З білків виділено також амінокислоти, які містять більше ніж одну амінну або карбоксильну групу. При наявності у складі амінокислоти двох аміногруп одна з них розміщується в -положенні, а друга – в ω-положенні, тобто біля першого вуглецевого атома з протилежного кінця від α-аміногрупи. Крім того, із продуктів гідролізу білків виділено амінокислоти, які містять групу —NН замість групи —NН2 і дістали назву імінокислот.
Виділені з білків амінокислоти – це безбарвні, кристалічні речовини, переважна більшість яких добре розчинна у воді і погано розчинна в органічних розчинниках. Усі амінокислоти плавляться при температурі, вищій ніж 200°С, причому деякі з них при нагріванні розкладаються.
Амінокислоти є оптично активними сполуками. Тому кожна молекула амінокислоти може бути правообертаюча, яку позначають знакам плюс. (+), або лівообертаюча, яку позначають знаком мінус (–).
Конфігурацію амінокислот визначають у порівнянні з гліцериновим альдегідом. Відомо D- I L-форми гліцеринового альдегіду:

D (+)-Гліцєриновий L(-)-Гліцериновий
альдегід альдегід
Якщо розташування атома водню біля вуглецю в -положенні амінокислоти подібне до розташування водню в тому самому положенні D-гліцеринового альдегіду, то амінокислота належить до D-ряду. Якщо ж розміщення атома водню амінокислоти відповідає L-формі гліцеринового альдегіду, то і амінокислота належить до L-ряду:

D-Амінокнслота L-Амінокислота
D-форма гліцеринового альдегіду завжди обертає площину поляризації вправо (+), а L-форма – вліво (–). Однак для деяких сполук, у тому числі і амінокислот, знаки D і L не співпадають з напрямом обертання площини поляризації. Разом з тим слід підкреслити, що знаки D і L характеризують не оптичну активність амінокислот, а належність їх до групи споріднених сполук, які мають однакову просторову конфігурацію біля -вуглецевого атома.
Амінокислоти – це амфотерні сполуки, які містять дві протилежні за властивостями функціональні групи – карбоксильну та амінну. Тому за звичайних умов можлива взаємодія між аміно- і карбоксильною групами амінокислот (у водних розчинах або у кристалічному стані):
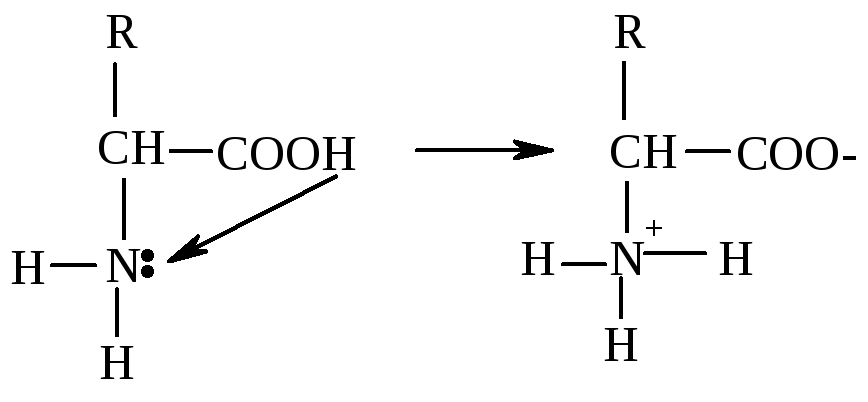
За цих умов молекула амінокислоти перетворюється на диполярний іон (цвіттеріон), який має два протилежних заряди – негативний, утворений внаслідок відщеплення позитивно зарядженого протона від карбоксильної групи, і позитивний, утворений внаслідок приєднання протона до аміногрупи. У результаті внутрішньомолекулярної взаємодії утворюється нейтральна сполука – внутрішня сіль амінокислоти, тому розчини амінокислот у більшості випадків мають нейтральний характер і на індикатори не діють (за винятком амінокислот, які містять у складі молекул кілька аміно- чи карбоксильних груп).
Амінокислоти в розчинах виявляють властивості амфотерних електролітів. Залежно від рН середовища вони можуть мати кислотні або лужні властивості. Так, у кислому середовищі (при надлишку іонів Н+) дисоціація карбоксильної групи пригнічується, молекула амінокислоти при цьому набуває позитивного заряду і реагує як катіон:

У лужному середовищі, під дією іонів ОН─, іонізація аміногрупи пригнічується, молекула амінокислоти набуває негативного заряду, тобто реагує як аніон:
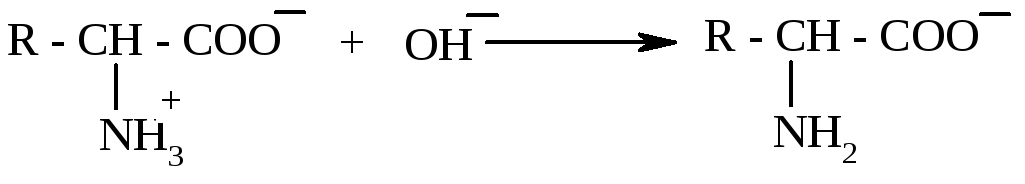
Значення рН середовища, при якому загальний сумарний заряд амінокислоти дорівнює нулю, має назву ізоелектпричної точки. Наявність у складі молекул амінокислот аміно- і карбоксильних груп зумовлює їх участь у хімічних реакціях, характерних для цих груп.
