
4. Будова білків
Вивчення будови цих природних біополімерів досить складне завдання, оскільки воно охоплює такі питання, як вивчення кількісного та якісного амінокислотного складу, порядку розміщення амінокислот у молекулах, дослідження конформації білкових молекул та локалізацій зв'язків, що стабілізують молекули і забезпечують їхній нативний стан. Над розв'язанням кожного із цих питань протягом тривалого часу працювали вчені багатьох країн світу. Було висловлено цілий ряд гіпотез і припущень щодо компонентів та будови білкових молекул.
Наприкінці XIX ст. російський учений О.Я.Данилевський висловив припущення, що молекули білків складаються з однотипних, подібних за будовою ланок. Досліджуючи білки та продукти неповного їх гідролізу, він помітив, що вони забарвлюються в синьо-фіолетовий колір при доливанні лужного розчину сульфату міді. Таке саме забарвлення утворювалось і при додаванні даного розчину до біурету – сполуки, що утворюється при нагріванні сечовини внаслідок відщеплення аміаку:
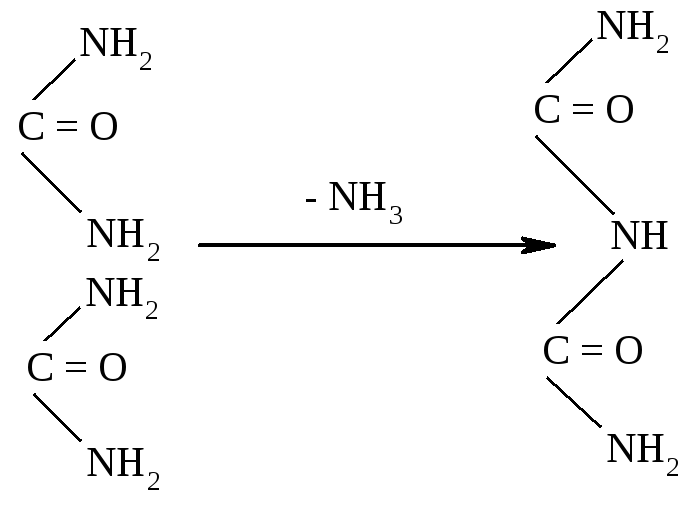
Сечовина Біурет
Оскільки О.Я.Данилевський вважав, що біуретова реакція зумовлена чергуванням груп —СО—NН—, то він зробив припущення, що подібне угруповання є також у білках та продуктах неповного їх гідролізу.
Значний внесок щодо будови білків вніс і німецький учений Е.Фішер. При проведенні кислотного і ферментативного гідролізу білків він встановив, що основними продуктами гідролізу білків є амінокислоти; при гідролізі білків руйнуються зв'язки між групами —СО—NН—; утворення груп —СООН і —NН2 відбувається у співвідношенні 1:1; усі білки дають біуретову реакцію, що свідчить про наявність в їх складі —СО—NН— - зв'язків. Ці зв'язки Е.Фішер назвав пептидними.
Характеристика зв'язків амінокислот у молекулах білка. Для нативних білків, що мають специфічні фізико-хімічні та біологічні властивості, характерним є наявність нижчих та вищих рівнів структури. Для кожного рівня структури характерні певні види зв’язків, за рахунок яких відбувається надійна стабілізація білкових молекул.
Згідно з загальними положеннями структура білків є результатом дії таких сил: пептидних зв'язків (-СО—NН-) між амінокислотами; дисульфідних зв'язків, які утворюються між залишками амінокислоти цистеїну; водневих зв'язків між киснем карбонільної і воднем імінної груп пептидних угруповань; гідрофобної взаємодії.
Отже, стабілізація структури білкової молекули забезпечується за рахунок ковалентних зв'язків та сил слабкої взаємодії. При цьому в стабілізації кожного виду структури вирішальна роль належить одному із зв'язків, а решта відіграють допоміжну роль. Так, ковалентні зв’язки (сили міцної взаємодії) забезпечують стабілізацію первинної і третинної структур (пептидний та дисульфідний зв'язки). Решта видів структури стабілізується за рахунок сил слабкої взаємодії водневих та іонних зв'язків, сил Ван-дер-Ваальса, гідрофобної взаємодії тощо.
Пептидний зв’язок. Цей зв'язок утворюється внаслідок взаємодії карбоксильної групи однієї амінокислоти з аміногрупою іншої амінокислоти. Сполуки, які при цьому утворюються, називаються пептидами. Схематично даний процес можна записати так:
Н2N–CH2–COOH + NH2–CH–COOH→Н2N–CH2–CO–NH–CH–COOH
I I
CH3 CH3
Гліцин Аланін Дипептид (гліцил-аланін)
Н 2N
–
CH2
–
CO
–
NH
–
CH
–
COOH
+
Н2N
– СН –
COOH →
2N
–
CH2
–
CO
–
NH
–
CH
–
COOH
+
Н2N
– СН –
COOH →
I I
CH3 CH2 – SH
Дипептид (гліцил-аланін) Цистеїн

→ Н2N – CH2 – CO – NH – CH – CO – NН – СН – COOH
I I
CH3 CH2 – SH
Трипептид (гліцил-аланіл-цистеїн)
Утворений трипептид може взаємодіяти з наступною амінокислотою, утворюючи тетрапептид, пентапептид і т. д.
Залежно від кількості залишків амінокислот, які беруть участь у реакції поліконденсації, утворені сполуки називаються ди-, три-, тетра- або поліпептидами. Багато дослідників вважає, що сполуки, коефіцієнт поліконденсації яких знаходиться у межах 20, називаються олігопептидами. Якщо до складу молекули входить 20-50 залишків амінокислот, то вони називаються поліпептидами. Поліпептиди, до складу яких входить понад 50 залишків амінокислот і мають молекулярну масу понад 6 тис. Да, належать до білків.
Поліпептидні ланцюги побудовані з великої кількості залишків амінокислот, наприклад, молекула білка інсуліну побудована з 51 залишку амінокислот, рибонуклеази – 124, трипсиногену – 234, гемоглобіну – 574 і т. д. Пептидний зв’язок є досить жорстким і має плоску транс-конфігурацію. Він є основою утворення пептидних ланцюгів, з яких побудовано молекули білка.
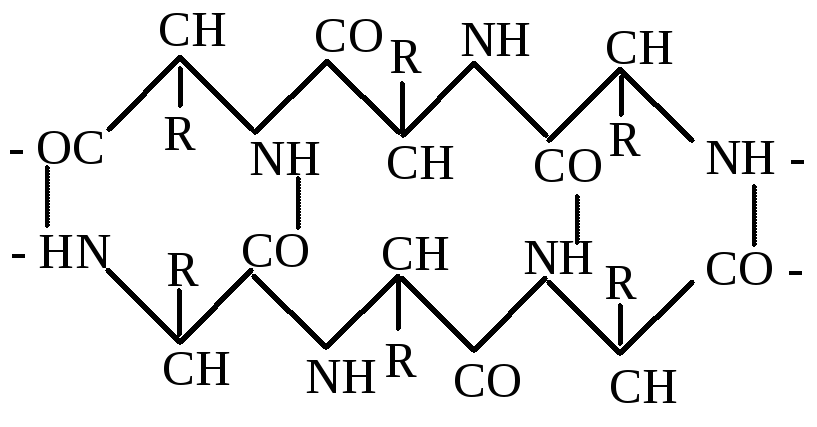
Встановлено, що молекули білків можуть складатися з одного або кількох поліпептидних ланцюгів – двох, чотирьох, шести і т. д., переважно з парної кількості. У молекулах білка крім пептидного зв’язку є також інші зв’язки – водневий, дисульфідний, іонний та гідрофобний. Вони мають важливе значення при утворенні відповідних структур білка.
Водневий зв'язок досить поширений у хімічних сполуках. Він утворюється між ковалентно зв’язаним атомом водню, який має частковий позитивний заряд, та іншими ковалентно зв’язаними атомами, що мають негативний заряд. У молекулах білка водневий зв'язок найчастіше утворюється при взаємодії атома водню імінної групи залишку однієї амінокислоти а атомами кисню карбонільної групи залишку іншої амінокислоти:
В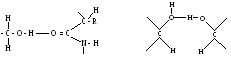 одневий
зв'язок у молекулі білка може бути
внутрішньоланцюговим
(з'єднує
окремі витки однієї спіралі) і міжланцюговим
(з'єднує різні
поліпептидні
ланцюги). У нативних білках цей тип
зв'язку може
утворюватися
не
лише між воднем і киснем пептидних груп,
а й між іншими
функціональними
групами поліпептидного ланцюга:
одневий
зв'язок у молекулі білка може бути
внутрішньоланцюговим
(з'єднує
окремі витки однієї спіралі) і міжланцюговим
(з'єднує різні
поліпептидні
ланцюги). У нативних білках цей тип
зв'язку може
утворюватися
не
лише між воднем і киснем пептидних груп,
а й між іншими
функціональними
групами поліпептидного ланцюга:
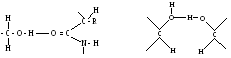
Водневий зв'язок, на відміну від інших зв'язків, досить слабкий. Енергія цього зв'язку дорівнює 6 кДж, тоді як, наприклад, енергія зв’язку між атомами вуглецю становить близько 250 кДж. Тому водневий зв'язок легко утворюється і легко руйнується при звичайних умовах. Він відіграє важливу роль в утворенні вторинної, третинної і четвертинної структур білка.
Дисульфідний зв'язок. До складу переважної більшості білків входять залишки амінокислоти цистеїну. Цей досить міцний ковалентний зв'язок утворюється внаслідок відщеплення атомів водню від сульфгідрильних груп двох амінокислотних залишків цистеїну. Дисульфідний зв'язок, як і водневий, може бути внутрішньоланцюговим (а) і міжланцюговим (б).
Схему утворення дисульфідного зв'язку можна показати так:
а)
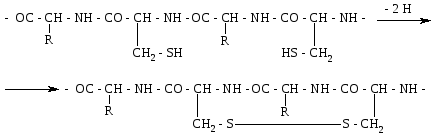
б)
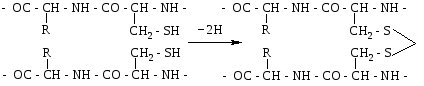
Велика кількість дисульфідних зв'язків є також у білках сполучної і покривної тканин та в білках, які мають високу біологічну активність.
Дисульфідні зв'язки мають важливе значення в формуванні третинної структури білків. Руйнування цих зв'язків призводить до дестабілізації даного рівня структури і втрати білком його біологічної активності.
Іонний зв'язок утворюється при наявності у поліпептидних ланцюгах молекул білків залишків моноамінодикарбонових і диаміномонокарбонових кислот. Вільні карбоксильні та амінні групи цих залишків амінокислот перебувають переважно в іонізованому стані, в результаті чого між ними виникає електростатична взаємодія.
Іонний зв’язок відіграє важливу роль при утворенні третинної і, можливо, четвертинної структур білків.
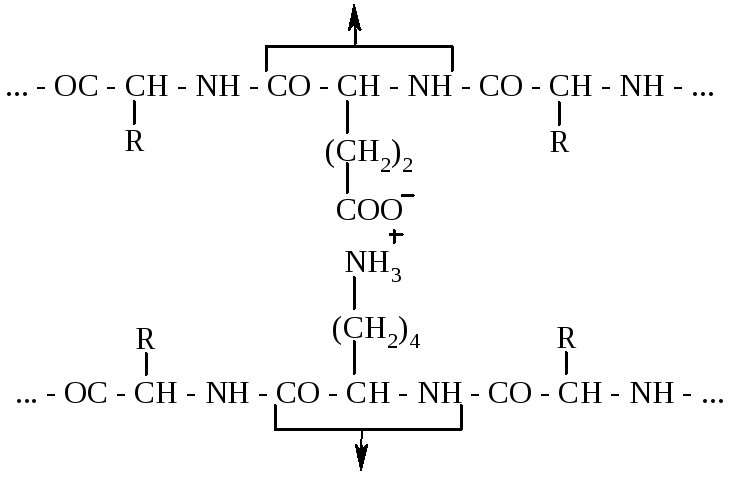 Залишок
глутамінової кислоти
Залишок
глутамінової кислоти
Залишок лізину
Гідрофобний зв'язок утворюється внаслідок міжмолекулярної взаємодії (сил Ван-дер-Ваальса) між гідрофобними (неполярними) радикалами таких амінокислот, як аланін, валін, лейцин, ізолейцин, фенілаланін тощо:
Гідрофобний зв'язок має важливе значення для стабілізації третинної і четвертинної структур білків.

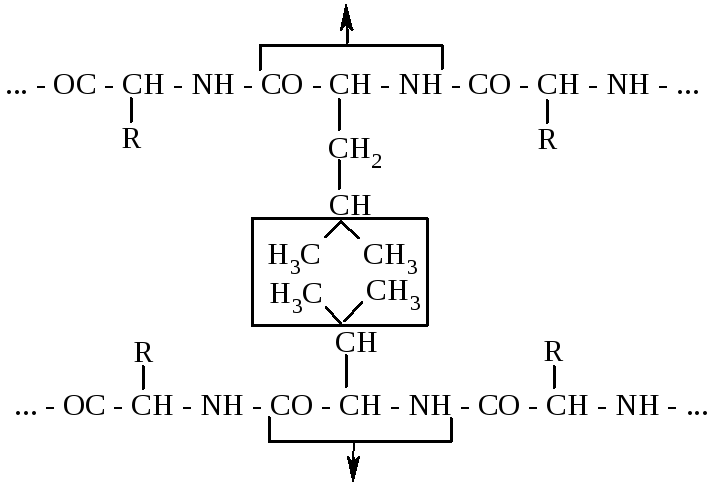 Залишок
лейцину
Залишок
лейцину
Залишок валіну
Для повного уявлення будови білків важливе значення має не тільки вивчення їх кількісного та якісного амінокислотного складу і способів зв'язку амінокислот в їх молекулах, а й цілого ряду інших питань. Особливо важливим є дослідження послідовності розміщення залишків амінокислот у поліпептидних ланцюгах, тобто первинної структури білка. Остання визначає тривимірну структуру поліпептидних ланцюгів, яка називається конформацією білка. Це термодинамічний, найбільш стійкий стан поліпептидних ланцюгів.
Про білки, які мають нормальну конформацію, кажуть, що вони перебувають у нативному (природному) стані. Від конформації білкової молекули залежить її біологічна функція.
Отже, згідно з сучасними уявленнями, у білках розрізняють чотири рівні структури – первинну, вторинну, третинну і четвертинну.
Первинна структура білків
Первинна структура білків – важлива їх характеристика, яка визначає властивості, функції, біологічну роль та просторову конфігурацію нативних білків. Під первинною структурою розуміють порядок розміщення або чергування залишків амінокислот в одному або кількох поліпептидних ланцюгах. Вона характеризується такими ознаками: природою амінокислот, які входять до складу молекули; кількістю амінокислот; порядком розміщення залишків амінокислот у поліпептидному ланцюгу. Первинна структура білка стабілізується пептидними (ковалентними) зв'язками.
Поліпептидний ланцюг з характерною для нього первинною структурою має N- і С-кінцеві амінокислоти. N-кінцевою амінокислотою називається амінокислота поліпептидного ланцюга з вільною аміногрупою, а С-кінцевою амінокислотою – з вільною карбоксильною групою. Нумерацію залишків амінокислот починають з N-кінцевої амінокислоти і закінчують С-кінцевою амінокислотою. Схематично поліпептидний ланцюг записують так:
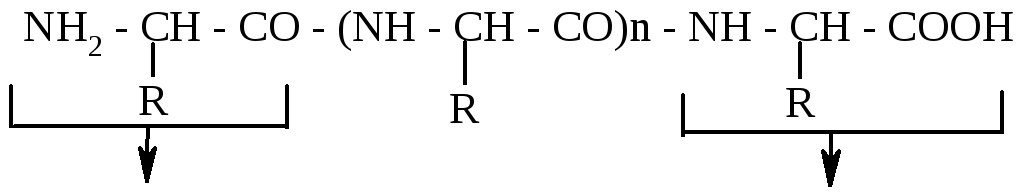
N-кінцева амінокислота С-кінцева амінокислота
Властивості і функції білків залежать не лише від кількісного та якісного складу мономерних ланок – амінокислот, а й від порядку розміщення їх, причому заміна чи перегрупування амінокислот у первинній структурі викликає втрату певних функцій і відповідних біологічних властивостей.
У білках відсутня певна загальна закономірність чергування залишків амінокислот, яка була б характерна для всіх білків. Вісімнадцять, амінокислот і два аміди, що входять до складу білків, багаторазово повторюються в складі білкових молекул, причому в різних білках співвідношення між ними неоднакове. Проте встановлено, що в поліпептидних ланцюгах білків, а також на різних ділянках одного поліпептидного ланцюга зустрічаються фрагменти ( ди-, три-, тетрапептиди) однакові, або подібні за порядком чергування амінокислот, тобто для первинної структури білків характерним є принцип структурної подібності.
Першим білком, у поліпептидному ланцюзі якого детально вивчений якісний і кількісних склад та послідовність розміщення залишків амінокислот, був інсулін. За ці дослідження англійському біохіміку Ф.Сенгеру в 1958 році було присуджено нобелівську премію.
Нині повністю розшифровано первинну структуру ферментів рибонуклеази, пепсину, хімотрипсину, карбоксипептидази, білків, які входять до складу цитохромів, гемоглобіну та цілого ряду інших.
Успішне вивчення первинної структури білків умовило їх хімічний синтез. В останні роки синтезовано білки інсулін, рибонуклеазу та багато інших, причому всі вони мають властиву для білків біологічну активність.
Вторинна структура. Під вторинною структурою молекули білка розуміють просторову конфігурацію поліпептидного ланцюга.
 Відомо,
що існує тільки невелика кількість
білків
поліпептиди яких перебувають у вигляді
лінійних
ланцюгів. Використовуючи рентгеноструктурні
методи дослідження, встановили,
що переважна більшість білків мають
поліпептидні ланцюги, скручені у вигляді
спіралі.
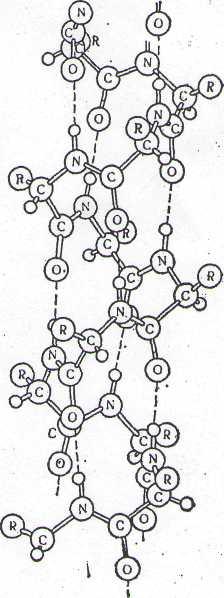
Вважають, що найбільш можливим типом
спіралі є так звана -спіраль
(рис ), на існування
якої вперше вказали Полінг і Корі. Як
видно
з рисунка, -спіраль
є правою спіраллю, оскільки
вона закручується (на відміну від лівої
спіралі)
зліва направо. На один завиток припадає
3,6
амінокислотних залишки, радикали яких
направлені
назовні.
Відомо,
що існує тільки невелика кількість
білків
поліпептиди яких перебувають у вигляді
лінійних
ланцюгів. Використовуючи рентгеноструктурні
методи дослідження, встановили,
що переважна більшість білків мають
поліпептидні ланцюги, скручені у вигляді
спіралі.
Вважають, що найбільш можливим типом
спіралі є так звана -спіраль
(рис ), на існування
якої вперше вказали Полінг і Корі. Як
видно
з рисунка, -спіраль
є правою спіраллю, оскільки
вона закручується (на відміну від лівої
спіралі)
зліва направо. На один завиток припадає
3,6
амінокислотних залишки, радикали яких
направлені
назовні.
Рис.
ралі
Рис.1.
Модель -
спіралі(за
Полінгом
і
Корі).
Поряд з цим встановлено, що поліпетидні ланцюги в молекулах білка спіралізовані не повністю. Такі випадки зустрічаються дуже рідко. Для кожного білка характерний певний ступінь спіралізації поліпептидного ланцюга. Наприклад, для білка гемоглобіну ступінь спіралізації становить 75, альбуміну курячого яйця - 45, а для рибонуклеази тільки 17%. Наведені дані свідчать про те, що в білкових молекулах поряд із спіралізованими ділянками поліпептидного ланцюга існують і лінійні.
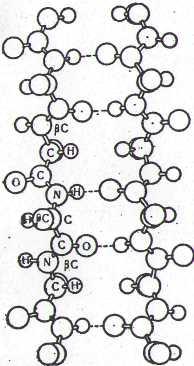
В останні роки встановлено, що крім -спіралі може існувати інша впорядкована конфігурація поліпептидних ланцюгів, відома під назвою -структури (рис. 2). Для її утворення поліпептидні ланцюги повинні бути до певної міри витягнутими і розміщеними паралельно. Стабілізація -структури, як і -спіралі, відбувається за рахунок водневих зв'язків. Ця структура властива для таких білків, як: фіброїн (білок шовку), кератин (білок сполучної тканини), міозин (білок м'язів) та деяких інших.
Зараз відомо ряд білків, які в одній молекулі містять ділянки а- і -структури.
Отже, розглянувши вище -спіраль і -структуру вони складають другий порядок або рівень організації структури білкової молекули, тобто вторинну структуру, важливу роль в утворенні якої відіграють водневі зв'язки.
Третинна структура. Вона характеризується певною конфігурацією спіралізованих і лінійних ділянок поліпептидних ланцюгів у просторі. Іншими словами, третинна структура - це укладання вторинних структур поліпептидних ланцюгів з утворенням клубків різної форми.
Рис.2
Модель -структури
поліпепти дів.
 росто
укладаються зутворенням
структури, яка близька до сферичної, а
укладання їх проходить через цілий ряд
точно визначених
станів з утворенням унікальної
конфігурації
молекули білка. Про це свідчить той
факт,
що незначне порушення третинної
структури
білка, як правило, приводить до втрати
його
біологічних властивостей. В
утворенні і стійкості третинної структури
білка важливу роль відіграють
водневі, дисульфідні, гідрфобні та іонні
зв'язки. Особливо велике значення
в формуванні третинної структури
білкової молекули мають перші
три види зв'язків. Серед них високою
міцністю відзначається дисульфідний
зв'язок, який є ковалентним.
росто
укладаються зутворенням
структури, яка близька до сферичної, а
укладання їх проходить через цілий ряд
точно визначених
станів з утворенням унікальної
конфігурації
молекули білка. Про це свідчить той
факт,
що незначне порушення третинної
структури
білка, як правило, приводить до втрати
його
біологічних властивостей. В
утворенні і стійкості третинної структури
білка важливу роль відіграють
водневі, дисульфідні, гідрфобні та іонні
зв'язки. Особливо велике значення
в формуванні третинної структури
білкової молекули мають перші
три види зв'язків. Серед них високою
міцністю відзначається дисульфідний
зв'язок, який є ковалентним.
Важливу роль в утворенні третинної структури відіграють і гідрофобні зв'язки, тобто взаємодія неполярних гідрофобних білкових груп. При формуванні третинної структури білка поліптидні ланцюги укладаються так, щоб максимальна кількість гідрофільних груп залишків амінокислот була назовні, тобто повернута до водного середовища, а гідрофобних - захована всередині структури (глобули). Тепер вважають, що для збереження третинної структури білка і певної просторової конфігурації поліпептидних ланцюгів гідрофобні зв'язки мають більше значення, ніж водневі.
У наш час з'ясовано третинну структуру багатьох білків. Вперше була розшифрована третинна структура білка міоглобіну англійським вченим Кендрю в 1957 р. Крім міоглобіну з'ясована третинна структура таких білків, як гемоглобіну, рибонуклеази, лізоциму, хімотрипсиногену та деяких інших.
Четвертинна структура. Ряд білків складається із двох, чотирьох і більшої кількості індивідуальних поліпептидних ланцюгів. Такі ланцюги з власною третинною структурою називають субодиницями. Взаємне просторове розміщення субодиниць у білковій молекулі і становить четвертинну структуру білка.
Класичним прикладом білка з четвертинною структурою може бути гемоглобін, який побудований із чотирьох субодиниць ( двох - і двох -поліпептидних ланцюгів). Субодиниці, представлені -ланцюгами, містять по 141 амінокислотному залишку, а -ланцюгами - 146. Ці субодиниці, сполучаючись між собою, утворюють молекулу гемоглобіну. Молекулярна маса гемоглобіну дорівнює 68 000, а кожної субодиниці - 17 000.
Другим прикладом білка з четвертинною структурою є складний білок вірусу тютюнової мозаїки з молекулярною масою 40 млн. він побудований з 2 200 однакових субодиниць, молекулярна маса кожної з яких дорівнює 17 500. Субодиниці в білку розміщені по спіралі. Тепер вважають, що майже всі білки з білки з молекулярною масою більшою за 50 000 побудовані з субодиниць.
В утворенні і стабілізації четвертинної структури білків беруть участь гідрофобні, водневі та іонні зв'язки.
Під впливом різних хімічних або фізичних факторів відбувається дисоціація білків на окремі субодиниці. При цьому вони втрачають свою біологічну активність. Факторами, які виключають дисоціацію, можуть бути органічні розчинники, сечовина, зміна рН середовища тощо. Для переважної більшості білків процес дисоціації оборотний. Якщо усунути фактор, який викликає дисоціацію, то субодиниці знову сполучаються між собою з утворенням четвертинної структури білка (рис. 3). При цьому відновлюється також його біологічна активність. Це свідчить про тісний взаємозв'язок між структурою і функцією білка в організмі.
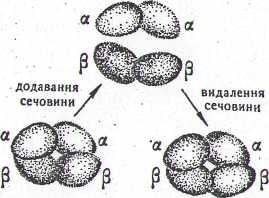
Рис. 3. Схема оборотної дисоціації молекули гемоглобіну
