
5. Будова і значення пептидів
До середини ХХ ст. вважалось що пептиди не є класом самостійних органічних сполук, а являють собою продукти неповного гідролізу білків. Відкриття пептидної будови двох гормонів гіпофізу – окситоцину і вазопресину, які регулюють в організмі скорочення мускулатури, секрецію молока молочними залозами дозволило змінити думку вчених на значення і місце в організмі цієї групи сполук.
Пептиди складаються з невеликої (на відміну від білків) кількості амінокислотних залишків. Назва їх утворюється із назв амінокислот шляхом їх перерахування, з суфіксом –іл, починаючи з NH2-кінцевого залишку. Назва С-кінцевої амінокислоти залишається без змін.
Утворюються пептиди ферментативним способом у кишково-шлунковому тракті з амінокислот білків харчових продуктів. Виявлено велику кількість пептидів з амінокислотною послідовністю, якої не знайдено у природних білках. Багато пептидів мають важливе значення в організмі і синтезуються штучно. Від них також залежать органолептичні і санітарно-гігієнічні властивості харчових продуктів.
Фізіологічне значення і функціональна роль пептидів в організмі дуже різноманітна: це буферна функція дипептидів (карнозин і ансерин) гормональна (меланотропін – стимулює утворення пігментів, соматостатин регулює гормон росту), протекторна (глутатіон захищає вільні SH групи, аскорбінову кислоту від окиснення, знешкоджує пероксидні сполуки, ароматичні вуглеводні, попереджуючи різні захворювання). Пептиди впливають на тонус судин, регулюють мозкову діяльність (страх, біль, сон, пам’ять) - ендорфіни й енкефаліни, які зараз інтенсивно вивчаються. Пептидну природу мають ряд токсинів мікроорганізмів, бджіл, змій, скорпіонів, морських молюсків.
Токсини можуть стати причиною харчових отруєнь при вживанні молочних, м’ясних, рибних та яєчних продуктів, а також салатів і кремових напівфабрикатів із-за порушення санітарних умов технологічної обробки і зберігання.
Ідентифіковані п’ять ентеротоксинів, які продукують бактерії. Staphylococcus aureus і сім нейротоксинів Clostridimn botulinum. Токсини ботулізму продукуються в анаеробних умовах, часто визивають летальні наслідки, але вони інактивуються при t > 80 0C за 15 хв і особливо в кислому середовищі.
Ентеротоксини можуть вироблятися бактеріями Salmonella і Cl. рerfringens, визиваючи розлади кишківника і лихоманку (черевний тиф).
Продукуються токсини частіше у продуктах тваринного походження, багатих білками, які є поживним середовищем бактерій, але можливе їх утворення у стравах з квасолі, горошку, оливок, грибів. Ядовитий гриб бліда поганка містить близько десяти циклічних токсичних пептидів, серед яких відомий α-амонітин.
У харчуванні застосовують петиди, які мають смакові властивості. Зокрема, у виробництві морозива, кремів, безалкогольних напоїв використовується аспартам – метиловий ефір L-аспартілфенілаланіну.
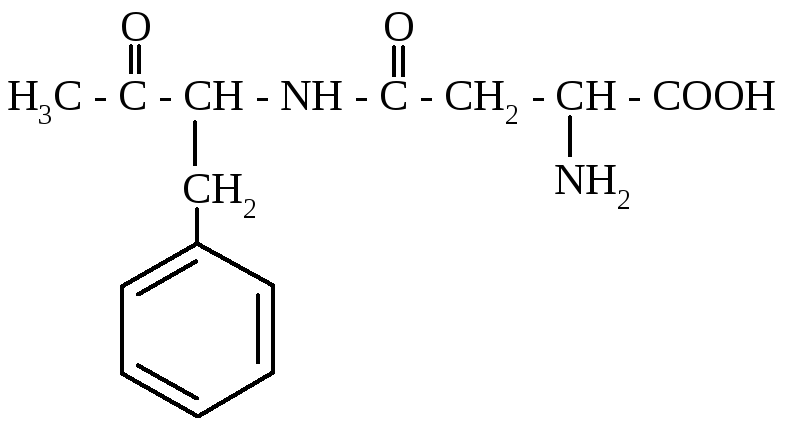
Аспартам солодший за сахарозу у 180 разів, але при тривалому зберіганні і тепловій обробці солодкий смак його зменшується. Гіркі пептиди утворюються при гідролізі білків у сирах, молоці, вони містять 2-8 залишків амінокислот. З часом гіркий смак зникає – відбувається подальший їх гідроліз під дією протеаз молочнокислих бактерій.
Білки (або протеїни) – високомолекулярні нітрогенвмісні органічні сполуки, побудовані із залишків амінокислот, сполучених пептидним та іншими видами зв'язків.
Назва „білки” обумовлена тим що при денатурації (кип’ятінні) цей клас сполук набуває білого кольору, як і білок яйця. Уперше термін «білки» було застосовано французьким фізіологом Ф.Кене у 1747 р. Пізніше, у 1838 р., дослідником Н.Мульдером білки були названі протеїнами (від грец. πρωτειον – перший, найважливіший), що відображає основне біологічне значення цих сполук у життєдіяльності живих організмів. Нині у літературі використовуються обидва терміни.
У природі існує 1010 - 1012 різних білків, таку їх різноманітність забезпечує всього 20 протеїногенних α-амінокислот, які здатні взаємодіяти між собою з утворенням полімерних структур з молекулярною масою від 5 тис. до 1 млн. дальтон (1Д = масі 1 атома водню). Кожен вид живих організмів характеризується індивідуальним набором білків, які спадково закодовані у ДНК.
Просторова структура білків визначає їх біологічні функції в організмі людини і тварин:
структурну (кератин волосся, нігтів, колаген сполучної тканини, еластин, муцини слизових виділень);
каталітичну (ферменти);
транспортну (гемоглобін, міоглобін, альбуміни);
захисну (антитіла, фібриноген крові);
механічну (актин, міозин мязів);
гормональну (інсулін, гормон росту, гастрін);
енергетичну (забезпечують 10-15% енергії людини)
резервну (овольбумін яйця, кезеін молока, ферритин селезінки).
Запасні білки рослинного походження: гліадін пшениці, гордеїн ячменю, зеїн кукурудзи, орізин рису широко розповсюджені у природі.
Білкові речовини беруть участь у багатьох інших процесах організму: збудливість, координація рухів, диференціювання клітин, тобто вони наділені функціями, які не властиві іншим сполукам. Тому їх поглиблене вивчення важливе як в курсі біохімії (в аспекті їх біологічних функцій) так і в курсі харчової хімії, як обов’язкового компоненту харчування та збереження їх біологічної цінності в технологічному процесі.
Білки займають особливе місце у харчуванні людини – вони координують і регулюють всю багатогранність хімічних перетворень, яка забезпечує функціонування організму як єдиного цілого, його взаємозв’язок з навколишнім середовищем.
Всі елементи клітини постійно поновлюються в організмі людини незалежно від віку. У молодому віці швидкість синтезу білків перевищує швидкість їх розпаду, при важких захворюваннях або голодуванні – навпаки. Найшвидше поновлюються білки печінки і слизової оболонки кишківника (до 10 днів) найбільш повільно (до 180 днів) – білки м’язів (міозин), сполучної тканини (колаген), мозку (мієлін).
Період оновлення гормонів – години і хвилини (інсулін). Середня величина Т½ (періоду напівжиття) для білків всього організму складає три тижні. У людини синтезується 500 г білків на день, що в 4-5 раз більше вживання їх із їжею. Це спричиняється повторним використанням продуктів розпаду білків і попередників амінокислот в організмі.
Постійний обмін і поповнення відбувається між тканинними білками і фондом вільних амінокислот, які утворюються при травленні їжі і поступають у кров. При нестачі білків їжі в організмі починається розпад білків тканин (печінки, плазми крові), утворені амінокислоти йдуть на синтез ферментів, гормонів та інших, необхідних для організму біологічно активних сполук. Стан білкового обміну в основному залежить від наявності незамінних амінокислот. Клітини організму людини не можуть синтезувати необхідні білки якщо в організмі відсутня хоч би одна незамінна амінокислота. Синтез білків в організмі порушується також при захворюванні кишково-шлункового тракту, наявності патогенної мікрофлори. Видалення частини амінокислот з організму обумовлює негативний азотистий баланс.
Показник азотного балансу використовується для оцінювання забезпечення людини білковою їжею. Це різниця між кількістю азоту, що надходить і того що виводиться з організму (г/добу). Азотний баланс дорівнює нулю у здорової дорослої людини, що вживає повноцінну їжу. Позитивний баланс у дітей і вагітних жінок. На стан азотного обміну любого організму впливають жири, калорійність їжі, вітаміни (В1, В2, В6, РР та ін.), мінеральні речовини, гормони.
Середня потреба людини в білках постійно досліджується і уточнюється ВОЗ, ФАО. Рекомендовані норми вживання основних харчових речовин залежать від групового поділу населення за віком, статтю, характером праці і звичайно залежать від захворювання. Вони коливаються у межах 70-120 г білка на добу для чоловіків і 60-90 г для жінок або 12-15% від загальної калорійності їжі.
Сьогодні у світі дефіцит повноцінного харчового білка. Вирішення цієї проблеми проводиться у двох напрямах:
розробка раціональних способів зберігання і збуту надлишку продуктів тваринного походження у високорозвинених країнах;
пошук шляхів одержання нових джерел і технологій харчового білка.
Амінокислотний склад еталонного білка ідеально відповідає потребам організму людини стосовно кожної амінокислоти (табл.1).
Таблиця 1.
