
- •Неорганическая химия
- •Лабораторная работа № 1 определение молярной массы эквивалента металла по объему вытесненного водорода
- •Расчет эквивалентной массы металла
- •Лабораторная работа №2 основные закономерности протекания химических реакций
- •Опыт 1. Зависимость скорости химической гомогенной реакции от концентрации реагирующих веществ.
- •Опыт 2. Влияние температуры на скорость гомогенной химической реакции.
- •Опыт 3. Влияние катализатора на скорость гомогенной химической реакции.
- •Опыт 4. Гетерогенный катализ.
- •Опыт 5. Влияние концентрации реагирующих веществ на сдвиг химического равновесия в растворе.
- •Лабораторная работа №3 растворы электролитов
- •Опыт 1. Электропроводность растворов электролитов.
- •Опыт 2. Влияние растворителя на диссоциацию веществ.
- •Опыт 3. Зависимость степени диссоциации от разбавления.
- •Опыт 4. Степень диссоциации солей.
- •Опыт 5. Сравнение химической активности сильных и слабых электролитов.
- •Опыт 6. Химическое равновесие в растворах электролитов (влияние одноименного иона на степень диссоциации электролита).
- •Опыт 7. Реакции в растворах электролитов как реакции их ионов.
- •Опыт 8. Образование осадков и произведение растворимости.
- •Лабораторная работа № 4 гидролиз солей
- •Опыт 1. Определение характера гидролиза.
- •Контрольные вопросы:
- •Лабораторная работа № 5 растворы неэлектролитов
- •Лабораторная работа № 6 комплексные соединения
- •Лабораторная работа № 7 окислительно-восстановительные реакции
- •Литература
Контрольные вопросы:
Что называется гидролизом солей?
Что такое степень гидролиза?
Какие факторы влияют на степень гидролиза? Как можно усилить гидролиз?
Подчиняется ли процесс гидролиза закону действующих масс? Как при этом можно сместить гидролитическое равновесие в системе?
Охарактеризуйте типичные случаи гидролиза солей.
Какие соли не подвергаются гидролизу и почему?
Какой гидролиз называют необратимым?
Лабораторная работа № 5 растворы неэлектролитов
Цель работы: изучить свойства растворов неэлектролитов, научиться определять плотность растворов с помощью ареометра, устанавливать зависимость плотности от концентрации раствора неэлектролита.
Опыт 1. Приготовление раствора заданной концентрации.
Для приготовления 1М раствора глюкозы отмерьте мерной колбой 50 см3 дистиллированной воды и перелейте в стакан емкостью 150 см3. Взвесьте рассчитанное количество глюкозы на технических весах и растворите его в воде.
Рассчитайте массовую долю глюкозы в полученном растворе.
Опыт 2. Определение плотности раствора ареометром.
Раствор глюкозы, полученный в первом опыте, перелейте в цилиндр и определите плотность данного раствора ареометром. Рассчитайте молярную концентрацию и титр раствора. Рассчитайте мольную долю сахара в растворе.
Опыт 3. Изучение зависимости плотности раствора от концентрации.
Приготовьте 2М раствор глюкозы, для чего к раствору, полученному в опыте 1, добавьте предварительно рассчитанное и взвешенное на технических весах дополнительное количество глюкозы. Перемешайте и определите плотность полученного раствора глюкозы ареометром. Сравните с плотностью раствора, полученного в опыте 2. Сделайте вывод. Рассчитайте массовую долю, мольную долю глюкозы, молярную концентрацию и титр полученного раствора.
Опыт 4. Определение повышения точки кипения раствора.
2М раствор, полученный в опыте 3, перелейте в химический стакан и нагрейте до кипения. Одновременно вскипятите в другом стакане дистиллированную воду. Определите термометром температуру кипения дистиллированной воды и раствора глюкозы в воде. Сравните полученные результаты и определите повышение температуры кипения (t0кип ).
Для раствора, полученного в опыте 4, рассчитайте t0кип теоретическое. Определите ошибку эксперимента по формуле:
%
ош. =
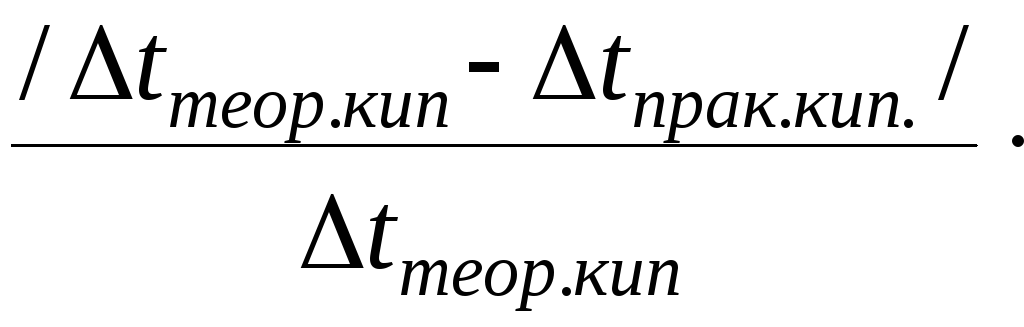 100
100
Для растворов полученных в опыте 1 и 3, рассчитайте значения понижения температуры замерзания и сравните их: рассчитайте величины осмотического давления и сравните их.
Все полученные данные внести в таблицы 1 и 2.
Таблица 1
|
m H2O |
m глюкозы |
|
|
Cm |
CM |
T |
Мольные доли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2
|
m H2O |
m глюкозы |
Cm |
tпракт.кип |
tтеор.кип. |
% ошибки |
tтеор.зам. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сделайте выводы о свойствах растворов неэлектролитов на основе экспериментальных и рассчитанных данных.
Контрольные вопросы:
1. Перечислить основные способы выражения концентрации растворов.
2. Какие факторы влияют на свойства разбавленных растворов?
3. Сформулировать закон Рауля.
4.Что называют криоскопической (эбулиоскопической) постоянной растворителя.
5.Привести примеры охладительных смесей и антифризов. Область их применения.
6.Что называется осмотическим давлением? Сформулировать закон Вант-Гоффа.
