
Органічна хімія, том 1 - Черних В
..pdf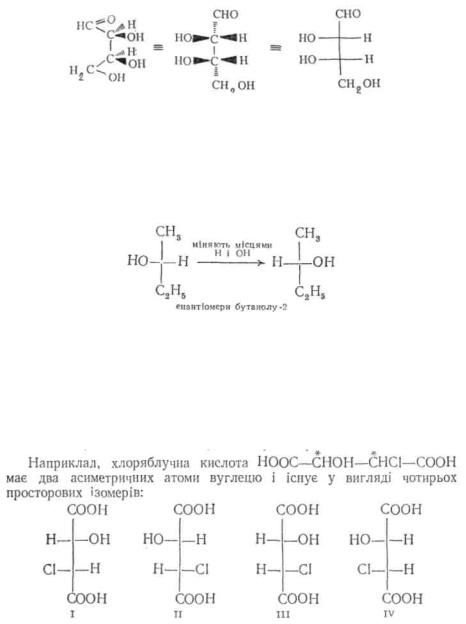
Аналогічні прийоми застосовують при побудові проекцій Фі-шера для молекул, що містять декілька асиметричних атомів вуглецю:
Щоб переконатись, чи молекули є ідентичними, чи різними, необхідно перевірити, суміщаються їх проекційні формули при накладанні, чи ні. Згідно з правилами обернення проекційні формули Фішера не молена виводити з площини креслення, а також обертати у площині на 90°, хоча оберт на 180° у площині креслення дозволяється. Як і у дійсній молекулі, заміна місцями у формулі Фішера двох будьяких замісників при асиметричному атомі вуглещр веде до формули оптичного антиподу:
Сполуки з декількома асиметричними атомами вуглецю. Якщо молекула має декілька асиметричних атомів вуглецю, то число можливих ізомерів збільшується. Загальну кількість стереоізомерів у молекулі вміщує декілька асиметричних атомів вуглецю з різним набором замісників, що можна обчислити за формулою N = 2", де N — кількість ізомерів, η — число асиметричних атомів вуглецю. Так, при наявності у молекулі двох нееквівалентних асиметричних атомів вуглецю число ізомерів дорівнює 22=4, коли міститься три — кількість стереоізомерів дорівнює 23 = 8 і т. д.
У тому, що молекули І—IV неідентичні, легко переконатись, використовуючи метод накладання. Оскільки наведені ізомери не
72
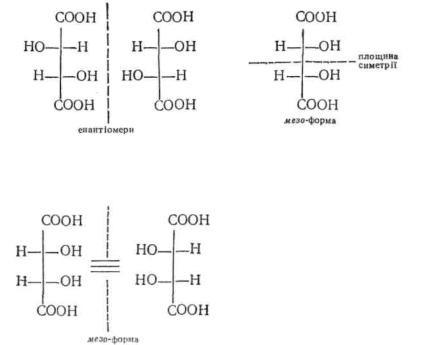
мають площини симетрії, усі вони виявляють оптичну активність. Ізомери І і II, а також III і IV є віддзеркаленням один одного, тобто є енантіомерами. Як уже відзначалось, енантіомери мають однакові фізічні і хімічні властивості та рівне за значенням, але протилежне за знаком питоме обертання. Однак енантіомери І і II відрізняються за фізико-хімічними характеристиками від енантіо-мерів III і IV.
Стереоізомери І і III, І і IV, а також II і III, II і IV не є дзеркальним відбиттям один одного. Вони мають однакову конфігурацію при одному асиметричному атомі вуглецю, але різну при другому. Такі стереоізомери називають діастереомерами. На відміну від енантіомерів, діастереомери мають різні фізичні і хімічні властивості та різне за значенням питоме обертання.
Коли молекула містить два асиметричних атоми вуглецю з однаковим набором замісників, число стереоізомерів зменшується з чотирьох до трьох. У даному випадку один з ізомерів має площину симетрії, тому він сумісний зі своїм дзеркальним відбиттям. Цей ізомер називається .иезо-формою.
Прикладом сказаного мож*е служити винна кислотг що  має лише три ізомери: два енантіомери і одну
має лише три ізомери: два енантіомери і одну
мезо-форму:
Якщо для мезоформи зобразити формально оптичний антипод, то обернувши його проекцію на 180° в площині креслення, одержимо первісну структуру. Це свідчить про те, що дані стереоізомери ідентичні:
Молекула лезо-форми має площину симетрії, отже вона ахіральна, а тому не має оптичної активності. Мезо-форма є типовим
73
прикладом, коли молекула, яка має декілька хіральних центрів, у цілому може бути ахіральною. Кожен з енантіомерів винної кислоти по відношенню до -иезо-форми є діастереомером.
Оптично активні сполуки з іншими асиметричними атомами.
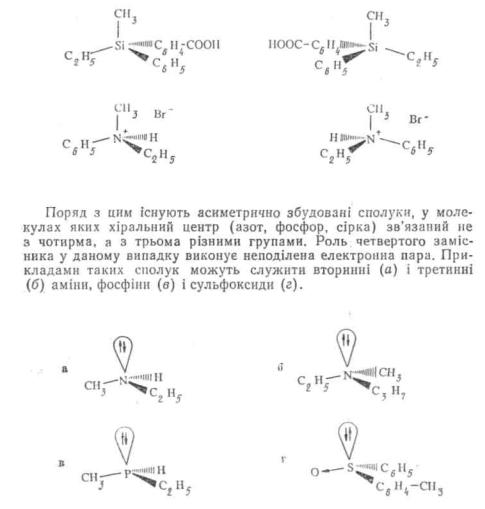
Окрім вуглецю молекула може мати в якості асиметричного центру і інші атоми, зв'язані з чотирма різними замісниками. Це, зокрема, атоми кремнію, азоту, фосфору. Такі молекули виявляють оптичну активність і утворюють стійкі оптичні ізомери, наприклад:
Слід відзначити, що конфігураційні ізомери сполук з тривалентним асиметричним центром вкрай нестійкі. При звичайних умовах відбувається швидко1 протікаючий процес взаємоперетворення
74

енантіомерів один у другого, тому виділити оптично активні ізомери удається лише у рідких випадках.
Окрім розглянутих вище прикладів оптична ізомерія властива також деяким речовинам, що не мають асиметричних атомів.
Номенклатура оптичних ізомерів. Оскільки оптичні ізомери відрізняються один від другого лише конфігурацією молекул і відношенням до поляризованого світла, у номенклатурі їх поряд з назвою, яка відображає хімічну будову, вказується також конфігурація і напрямок обертання площини поляризованого світла.
Відхилення площини площиннополяризованого променю праворуч позначають у назвг оптичного ізомеру знаком (+), а ліворуч—знаком
(—). Щоб сказати, який енантіомер з пари має праве, а який — ліве обертання, необхідно знати дійсне розташування навколо хірального центру, тобто абсолютну конфігурацію молекул. Важливо відзначити, що напрямок і кут обертання площини поляризації не пов'язані будьяким чином з конфігурацією. Визначення абсолютної конфігурації молекул виявилось для хіміків досить складним завданням. Лише у 1951 р. методом рентгеноструктур-ного аналізу було вперше встановлено абсолютну конфігурацію натрій-рубідієвої солі ( + ) - винної кислоти. До цього часу конфігурація оптичних ізомерів встановлювалась методом порівняння зі спеціально обраною стандартною речовиною. Така конфігурація одержала назву відносної. У 1906 р. російським вченим M. O. Розановим в якості стандарту для встановлення відносної конфігурації був запропонований гліцериновий альдегід
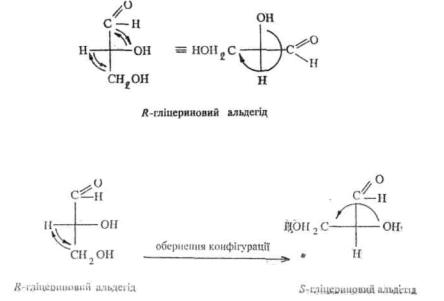
CH2(OH)—CH(OH)—CH = O. Правообертаючому ізомеру гліцеринового альдегіду була довільно приписана абсолютна конфігурація, у фішеровській проекції якої група—OH знаходиться праворуч. Таку конфігурацію позначили буквою D. Лівообертаючому енантіомеру гліцеринового альдегіду відповідно була приписана дзеркальна конфігурація, яку позначили буквою L (группа —OH у проекції Фішера розташована ліворуч):
Гліцериновий альдегід обрано в якості стандарту з тієї причини, що за допомогою ряду хімічних реакцій його можна перетворити у багато інших оптично активних сполук, не торкаючи зв'язку з асиметричним атомом вуглецю.Так, без порушення конфігура-
75

ції хірального центру ( + )-гліцериновий альдегід можна перетворити у
(—)-молочну кислоту. Отже, (—)-молочна кислота буде мати таку ж конфігурацію, що й ( + )-гліцериновий альдегід, тобто /^- конфігурацію:
Цей приклад свідчить про те, що молекули з однаковою конфігурацією необов'язково повинні обертати площину поляризованого світла в одному напрямку.
Аналогічним чином, незалежно від знаку обертання, конфігурація інших оптично активних сполук довільно віднесена до D- або L- гліцеринового альдегіду або відповідно до D- або ^стереохімічного ряду.
Пізніше експериментальним шляхом було встановлено, що довільно приписана ( + )- і (—)-глииериновому альдегіду конфігурація відповідає дійсному розташуванню замісників у просторі, тобто абсолютній конфігурації цих речовин. Цей вдалий збіг дозволив уникнути плутанини у хімічній літературі, тому що встановлена для різних сполук відносна конфігурація набула сили абсолютної.
D, L-Система позначення конфігурації оптичних ізомерів придатна лише для структурно споріднених із гліцериновим альдегідом сполук. До них належать речовини з такою конфігурацією хірального центру, коли у проекції Фішера з одного боку від вертикальної лінії розташований атом водню, а з другого—група OH, NH2, NO2, атом галогену і ін. Якщо вказані замісники перебувають праворуч, молекула має/^-конфігурацію, а якщо ліворуч— /--конфігурацію:
У випадку сполук з декількома хіральними центрами належність ізомерів до D- або L-стереохімічного ряду встановлюють за конфігурацією асиметричного атома вуглецю з найбільшим по-
76

рядковим номером, тобто по нижньому асиметричному атому вуглецю у проекції Фішера:
Виключенням з цього правила є α-амінокислоти, а-гідрокси- кислоти, винна кислота, в яких належність до D- чи L-ряду встановлюють за конфігурацією α-вуглєцевого атома (верхній асиметричний атом вуглецю у проекції Фішера):
Просторове положення однакових замісників у молекулах з двома сусідніми асиметричними атомами вуглецю прийнято позначати у назві ізомеру префіксами трео- і ерітро-. Грео-ізомерами називають речовини, у проекціях Фішера яких однакові замісники при асиметричних атомах вуглецю розташовані з різних боків, епігооізомеоами — з одного 6οκν:
D, L-Система позначення конфігурації, незважаючи на її широке використання, має обмежену область застосування. Іноді сполука містить такі замісники навколо асиметричного центру, що
77
неможливо порівняти конфігурації сполуки і гліцеринового альдегіду. В останній час в органічній хімії все ширше почала застосовуватись запропонована Каном, Інгольдом і Прелогом універсальна номенклатурна система позначення абсолютної конфігурації оптичних
ізомерів — так звана R, S-система.
/?, ^"-Система основана на визначенні напрямку послідовного спадання старшинства замісників, зв'язаних з асиметричним атомом вуглецю.
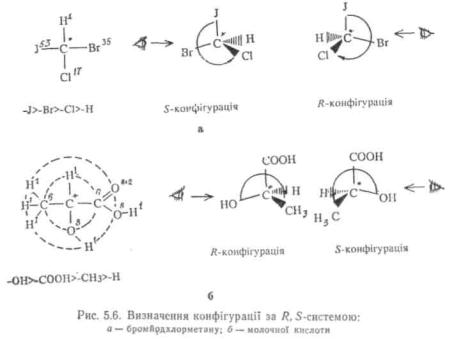
Старшинство замісників встановлюється шляхом підрахунку атомних номерів елемента, спочатку безпосередньо зв'язаних з хіральним центром, а потім, якщо це необхідно, елементів наступних елементних шарів. Чим більший атомний номер, тим старший замісник. Наприклад, у молекулі бромйодхлорметану (рис. 5.6, а) замісники утворюють слідуючий ряд послідовно спадаючого старшинства: J, Br, Cl, H. Якщо два або більше атомів, безпосередньо зв'язаних з асиметричним центром, однакові, то порядок старшинства замісників, у склад яких входять ці атоми, визначається аналогічним чином за другим елементним шаром, тобто шляхом підрахунку суми атомних номерів елементів, безпосередньо зв'язаних з атомами першого шару, причому атомні номери елементів, зв'язаних подвійним зв'язком, подвоюються, а потрійним — потроюються. :
Так; у молекулі молочної кислоти (рис. 5.6, б) за першим елементним шаром (80, 6С, ,H, 6С) видно, що найстаршим замісником
78
є група —OH, а наймолодшим —H. Для вияснення старшинства замісників —COOH і —СНз, що мають у першому шарі однакові атоми (бС), необхідно розглянути другий елементний шар. Сума атомних номерів другого елементного шару СНз-групи=ІЧ-14-+ 1=3, а групи — COOH- 8+8x2=24. Отже, група -COOH старша від групи —СНз, а всі замісники навколо хірального центру молочної кислоти розташовуються у слідуючий ряд послідовно спадаючого старшинства: OH, COOH, CH3, H.
Після встановлення старшинства замісників відповідно до R, S- систєми опис конфігурації стереоізомерів, модель молекули або її стереохімічну формулу розглядають таким чином, щоб наймолодший замісник (найчастіше це атом водню) був найвіддалені-шим віл спостерігача (див. рис. 5.6, б). Якщо при цьому три інші замісники розташовані в просторі так, що їх старшинство послідовно спадає за годинниковою стрілкою, абсолютна конфігурація позначається буквою R (від лат. Rectus — правий), якщо ж старшинство замісників спадає проти годинникової стрілки, конфігурацію позначають буквою 5 (від лат. Sinister — лівий).
Для опису через R, S-систему позначення конфігурацій стереоізомерів, зображених за допомогою проекційних формул Фішера, необхідно шляхом парного числа перестановок замісників перетворити проекцію Фішера таким чином, щоб молодший замісник перебував внизу. Якщо при цьому три інші замісники розташовані у порядку зменшення старшинства за годинниковою стрілкою, сполуку відносять до Я-ряду, якщо проти годинникової стрілки — до 5-ряду. Перетворюючи вказаним способом, наприклад, проекцію D- гліцеринового альдегіду, бачимо, що за R, S-системою він має /^- конфігурацію:
Слід пам'ятати, що непарне число перестановок замісників у проекції Фішера веде до обернення конфігурації:
79
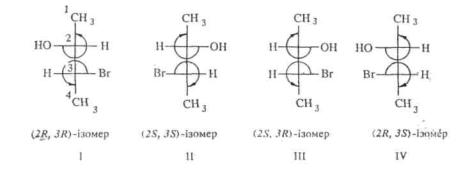
Особливо складним є перетворення проекційних формул для сполук з декількома хіральнимн центрами. У таких випадках R, 5-система допускає використання неперетворених проекційних формул. При цьому, якщо у проекційній формулі Фішера молодший замісник розташований праворуч або ліворуч від асиметричного центру, то для опису конфігурації за R-, S-системою застосовується обернене правило, а саме: зменшення старшинства замісників за годинниковою стрілкою надає хіральному центру 5-конфігура-цію, а проти годинникової стрілки — ^-конфігурацію. Наприклад, з чотирьох стереоізомерів З- бромбутанолу-2 перший має (2R1 3R)-, другий— (2S, 3S)-, третій— (2S, 3R)-, четвертий— (2R, 3S)-конфігурацію, яка позначається у вигляді префіксу до систематичної назви:
Рацемічні форми. В індивідуальному вигляді органічні сполуки з хіральними молекулами утворюються лише внаслідок складних біохімічних процесів, що протікають у живих організмах за участю ферментів. При синтетичних методах їх добування, як правило, утворюються рівні кількості лівообертаючого і правообертаючого енантіомерів, які складають так звану рацемічну форму. Рацемічна форма не має оптичної активності. У газоподібному та рідкому агрегатному стані, а також в розчинах рацемічна форма являє собою суміш рівного числа енантіомерних молекул, тому вона має ті ж властивості, що і індивідуальні енантіомери (температура кипіння, показник заломлення, ІЧ-спектри).
У твердому стані рацемічна форма може існувати у вигляді суміші дзеркально ідентичних кристалів індивідуальних енантіомерів, які одержали назву — рацемічна суміш, або являти собою молекулярну сполуку, кристали якої побудовані із молекул ліво-і правообертаючого ізомеру, які суворо чергуються. Така рацемічна форма називається рацемічною сполукою або рацематом. Раце-мати відрізняються від індивідуальних енантіомерів фізичними властивостями (температура плавлення, розчинність) і спектральними характеристиками (ІЧ-спектри в твердому стані). Так, температура плавлення ( + )-винної і (—)-винної кислот дорівнює χ 170 °С, а рацемічна винна кислота (виноградна) плавиться при температурі 204—2060C'
80
Причиною утворення рацемічної форми при виникненні хіраль-ного центру у молекулі є тонкі відмінності у просторовій будові ахіральних молекул.
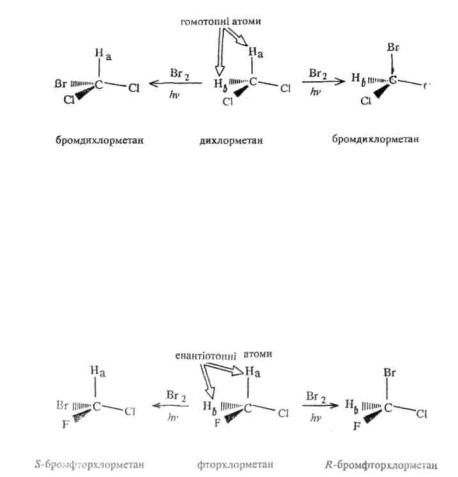
Якщо ахіральна молекула містить при 5р3-гібридизованому атомі вуглецю чотири або три однакових замісники, то ці замісники еквівалентні, тобто їх неможливо відрізнити один від другого будьякими фізичними і хімічними методами. Такі замісники мають однакове просторове розташування і називаються гомо-топними.
Коли при 5р3-гібридизованому атомі вуглецю є два однакових замісники, їх просторове положення може бути в одних випадках еквівалентним, в інших — нееквівалентним. В симетричному оточенні такі два замісники є еквівалентними, тобто гомотопними. Так, у молекулі дихлорметану СН2СІ2 атоми водню мають симетричне оточення, тому заміщення будь-якого з них на інший замісник, наприклад на атом брому, веде до ідентичних продуктів:
У несиметричному оточенні два однакових замісники мають нееквівалентне просторове положення. При заміні одного з них на нову групу утворюється продукт, просторово не ідентичний тому, котрий одержується при заміщенні другого. Ці продукти один відносно другого є енантіомерами. Атоми або угрупування у молекулі, заміщення яких веде до утворення енантіомерів, називаються енантіотопними. Так, у молекулі фторхлорметану CH2FCI атоми водню мають несиметричне оточення, а внаслідок цього — нееквівалентне просторове положення. Вони енантіотопні, оскільки при заміщенні одного з них, наприклад, бромом утворюється один енантіомер, тоді як при заміні другого—інший енантіомер:
81
