
Органічна хімія, том 1 - Черних В
..pdf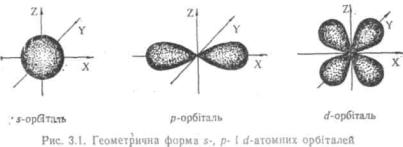
Водневий зв'язок, особливо внутрішньомолекулярний, впливає на конформацію молекул і швидкість протікання хімічних реакцій.
Встановити наявність водневого зв'язку можна за допомогою методів 14-, KPта ЯМР-спектроскопії. Наприклад, в інфрачервоних (14) спектрах гідроксилвмісннх сполук (спирти, феноли) спостерігається полоса вбирання вільної ОН-групи в області 3650— 3590 см_1, якщо ж ця група бере участь в утворенні водневого зв'язку, полоса вбирання спостерігається в області 3400—3200 см_І.
Водневі зв'язки відіграють важливу роль у протіканні різноманітних біохімічних процесів в організмі, вони визначають просторову структуру білків, полісахаридів, беруть участь в утворенні подвійної спіралі ДНК і ін.
3.2. КВАНТОВО-МЕХАНІЧНІ ОСНОВИ ТЕОРІЇ ХІМІЧНОГО ЗВ'ЯЗКУ
Сучасна теорія хімічного зв'язку базується на квантово-механічному розгляді молекули як системи з електронів та атомних ядер. Квантовомеханічний підхід до вивчення хімічних систем заснований на розв'язанні хвильового рівняння Шредінгера #ψ — £ψ, де H — оператор Гамільтона; E — повна енергія системи; ψ (грец. «псі») —хвильова функція.
Рівняння Шредінгера описує енергію молекули будь-якої сполуки у відповідності з хвильовою функцією, яка характеризує розподіл електронної густини у полі атомних ядер. Розв'язання рівняння зводиться до знаходження хвильової функції ψ, залежної від просторових координат і спінових змінних усіх електронів. Квадрат модуля хвильової функції [ψ]2 визначає ймовірність виявлення електрона у «точці» простору, а сама функція описує орбіталь.
Атомні орбіталі. Атомною орбіталлю (AO) називають область простору, всередині котрої ймовірність знаходження електрона максимальна.
Згідно з квантовою теорією стан будь-якого електрона в атомі описується чотирма квантовими числами: п, І, m, s. Перші три характеризують атомну орбіталь. Головне квантове число η означає енергетичний рівень орбіталі, побічне квантове число / — геометричну форму орбіталі, магнітне квантове число m — орієнтацію різних атомних орбіталей у просторі. Спінове квантове число s описує обертання електрону навколо власної осі.
З курсу неорганічної хімії студентам відомі геометричні форми S-, р-, d-атомних орбіталей (рис. 3.1).
32

Атомні орбіталі s-тнпу мають сферичну симетрію. Для електронів у р-стані існують три однакових за енергією AO гантелеподібної форми, що відрізняються одна від другої орієнтацією у просторії Px, Py, Pz
(рис. 3.2).
Кожна р-орбіталь має вузлову область, в якій ймовірність знаходження електрона дорівнює нулю. Існує п'ять атомних орбіталей d- типу з більш складною геометричною формою.
Згідно з принципом Паулі на одній орбіталі може знаходитись не більше двох електронів, і ці електрони повинні мати протилежні
спіни (умовно записується |
). |
Заповнення атомних орбіталей електронами відбувається у порядку зростання енергій: ls<2s<2p<3s<3p<4s<3d і т. д. Атомна орбіталь, не занята електронами, називається вакантною (умовно позначається □ )· Відповідно до правила Гунда заповнення орбіталей з однаковою енергією (так звані вироджені орбіталі) відбувається у такому порядку, що спочатку кожна орбіталь заселяється одним електроном, і ці електрони повинні мати паралельні спіни, потім відбувається остаточне
заповнення орбіталі другим електроном.
Нижче наведені електронні конфігурації елементів, які найчастіше зустрічаються в органічній хімії (табл. 3.1).
33

Ковалентний зв'язок. Для опису ковалентного зв'язку з позицій квантової механіки використовують два основних методи: молекулярних орбіталей (MO) і валентних зв'язків (ВЗ). Обидва методи являють собою математичні прийоми наближеного розв'язання рівняння Шредінгера стосовно молекули.
В уявленні методу ВЗ (теорія резонансу) ковалентний зв'язок розглядається як результат перекривання атомних орбіталей, які несуть по одному електрону з протилежними спінами. При цьому атомні орбіталі зберігають свою індивідуальність, а пара електронів локалізується у просторі між ядрами атомів. Застосування методу ВЗ для опису молекули зводиться до складання максимального числа так званих резонансних структур і розгляду реальної молекули кк гібриду даних структур. Резонансними або граничними називають структури, що різняться лише розташуванням електронів. Наприклад, молекулу водню H—H можна представити як гібрид граничних структур H+H-" ■+*■ H-H+ (-^-позначення резонансу). Теорія резонансу застосовується в основному для якісної оцінки реакційної здатності органічних сполук.
У методі MO також виходять з припущення, що ковалентний зв'язок утворюється у результаті перекривання одноелектронних AO. Однак, на відміну від методу ВЗ, атомні орбіталі тут не зберігають своєї індивідуальності, а замість них утворюється така ж кількість орбіталей нового типу, які називають молекулярними орбіталями (MO). З двох AO утворюється дві MO, з чотирьох — чотири, з шести — шість MO і т. д. Молекулярні орбіталі відрізняються від атомних тим, що електронні хмари оточують ядро вже не одного атома, а двох або декількох. Для утворення MO необхідно, щоб атомні орбіталі мали близькі енергії, однакову симетрію відносно лінії зв'язку у молекулі і достатню для перекривання в просторі. На рис. 3.3 представлена схема утворення ковалентного зв'язку у молекулі водню.
34
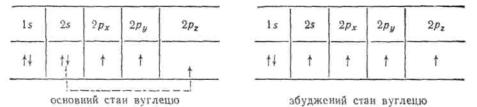
Як видно, перекривання двох атомних орбіталей приводить до утворення двох молекулярних орбіталей. Одна з них має нижчу енергію, ніж вихідні AO, і називається зв'язуючою орбіталлю, друга має вищу енергію, ніж утворююча її AO, і називається розпушуючою, або антизв'язуючою, орбіталлю. Заповнення молекулярних орбіталей електронами проходить аналогічно атомним, тобто за принципом Паулі і у відповідності до правила Гунда. Спочатку електрони займають нижчі по енергії зв'язуючі орбіталі, що приводить до утворення хімічного зв'язку між атомами. Молекулярна розпушуюча орбіталь в основному стані вважається вакантною, її заповнення електронами проходить при збудженні молекули, що веде до розпушення зв'язку і розпаду молекули на атоми. Таким чином, згідно з методом MO утворення ковалентного зв'язку представляється як перехід двох електронів з атомних орбіталей на зв'язуючу молекулярну орбіталь.
Поряд зі зв'язуючими і розпушуючими MO існують незв'язуючі молекулярні орбіталі, на яких розташовуються неподілені пари електронів.
3.2.1. Гібридизація атомних орбіталей |
4- |
Згідно з квантово-механічною теорією хімічного зв'язку число утворюваних атомом ковалентних зв'язків визначається кількістю одноелектронних атомних орбіталей, тобто кількістю неспарених електронів. Однак у дійсності атоми деяких елементів утворюють більше число ковалентних зв'язків у порівнянні з кількістю неспарених електронів в основному стані. Так, атом вуглецю в основному стані має два неспарених електрони, але, як відомо, в органічних сполуках він утворює чотири ковалентні зв'язки. Це можна пояснити, якщо уявити, що один з 25-електронів переходить на вакантну 2р2-орбіталь:
У такому стані, званому збудженим, атом вуглецю має чотири одноелектронні орбіталі. Оскільки валентні орбіталі вуглецю нерівноцінні (одна—s, а три — р) , то і ковалентні зв'язки, утворені за їх участю, не повинні бути еквівалентними. У дійсності ж, наприклад, у молекулі метану CH4 всі чотири ковалентні зв'язки C—H рівноцінні. Для пояснення цього факту у квантовомеханічній теорії хімічного зв'язку введено математично обгрунтоване поняття про гібридизацію атомних орбіталей. Суть гібридизації полягає у тому, що з декількох різних за формою і близьких за енергією атомних орбіталей утворюється таке ж число однакових за фор-
35
мою і енергією гібридних орбіталей. Наприклад, при взаємодії однієї S- і трьох р-атомних орбіталей утворюється чотири 5р3-гібридні орбіталі. За формою гібридна орбіталь відрізняється
від S- і від
р-орбіталей, являючисобоюнесиметричнуоб'ємнувісімку:
Гібридні орбіталі є атомними орбіталями, але виникають вони тільки у процесі утворення хімічного зв'язку і не відображають реальної структури вільного атома. У результаті перекривання більшої долі гібридної орбіталі з атомними орбіталями інших атомів утворюється ковалентний зв'язок. У порівнянні з негібридизованими гібридні орбіталі вигідніші геометрично і внаслідок більшого перекривання з орбіталями інших атомів утворюють міцніші зв'язки.
Для атома вуглецю характерні три види гібридизації за участю S- і р-орбіталей: sp3-, sp2-, sp-гібридизація. Кожному з цих видів відповідає певний валентний стан атому.
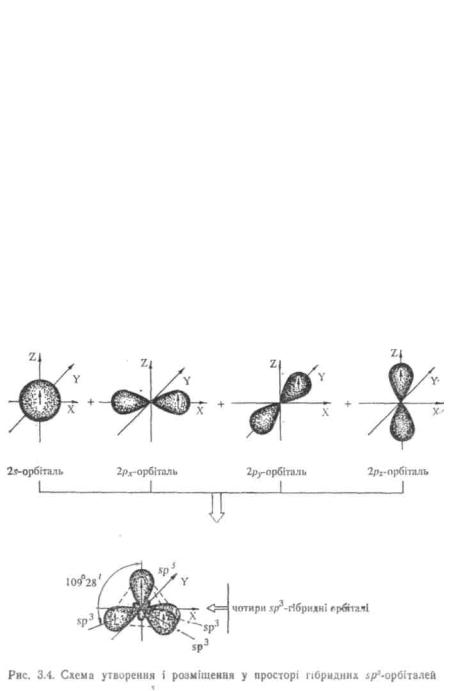
sp^-Гібридизація вуглецю (перший валентний стан). При sp3- гібридизації з однієї S- і трьох р-орбіталей утворюється чотири якісно нові, рівноцінні 5р3-гібридні орбіталі, спрямовані у просторі під кутом 109°28' (від центру правильного тетраедра до його вершин). Тому5р3-гібридизаціюназиваютьщететраедричною.
Виходячи зі схеми, наведеної на рис. 3.4, можна умовно уявити, що доля s-хмари у гібридних sp3-орбіталях дорівнює 1/4. У першому валентному стані атом вуглецю утворює лише прості ковалентні зв'язки.
36
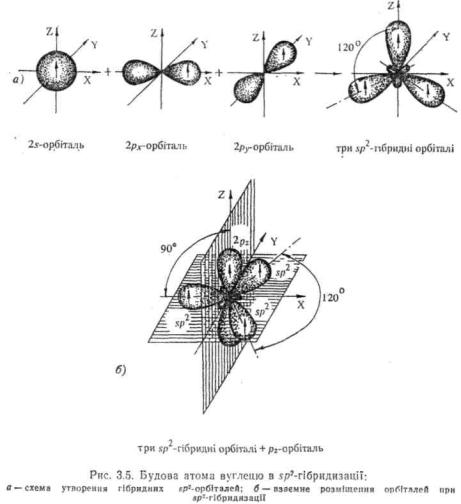
sp--ri6pudii3attfn вуглецю (другий валентний стан). .^-Гібридизація відбувається внаслідок взаємодії однієї s- і двох р-орбіталей І/7*. Py)- У результаті утворюються три еквівалентні .ср2-гібридні орбіталі. що лежать в одній площині під кутом 120°. Тему sp2-H6-ридизація иазиваєься ще тригональною. Залишена негібридизованею р,-орбіталь розташована у площині, перпендикулярній до площини гібридних орбіталей (рис. 3.5).
Умовно доля s-хмари у гібридних $р2-орбіталях дорівнює 1/3. Атом вуглецю у 5р2-гібридизації утворює подвійний зв'язок.
sp-Ґібридизація вуглецю (третій валентний стан). sp-Пбри-дизація виникає у результаті злиття однієї s- і однієї р-орбіталі (рх). При цьому утворюються дві sp-поридні орбіталі, розташовані одна до другої під кутом 180°. Звідси sp-гібридизація називається ліній-
37
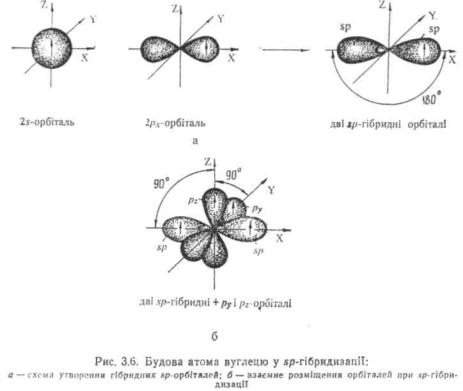
пою. Негібридпзовані ру- ρ,-орбіталі розташовані у двох взаємно перпендикулярних площинах під прямим кутом до sp-гібридних орбіталей (рис. 3.6).
s-Характер гібридних sp-орбіталей дорівнює 1/2. У стані Sp- гібридизації атом вуглецю утворює потрійний зв'язок.
Слід відзначити, що поряд з трьома граничними варіантами гібридизації S- і р-орбіталей існує багато проміжних типів. Для експериментальної оцінки характеру гібридної орбіталі з успіхом використовують ЯМР-спсктроскопію.
3.2.2.Ковалентні σ- і π-зв'язки
Узалежності від способу перекривання атомних орбіталей розрізняють ковалентні зв'язки двох типів: σ- (грец. «сігма») і π-(грец.
«пі») зв'язки. σ-Зв'язки утворюються у результаті перекривання двох різних атомних орбіталей (s, р, d) і гібридних (sp3, sp2, sp) вздовж лінії, з'єднуючої ядра атомів (σ-перекривання) (рис. 3.7).
38

Виникаючі при цьому молекулярні орбіталі називаються відповідно σ-ΜΟ — зв'язуюча молекулярна орбіталь і σ*-ΜΟ — розпушуюча молекулярна орбіталь (див. рис. 3.3). Максимальна електронна густина при σ-перекриванні знаходиться на осі, з'єднуючій два ядра.
У більшості органічних сполук σ-зв'язки утворюються переважно за рахунок перекривання гібридних sp3-, sp2- і sp-орбіталей, які є вигіднішими енергетично і забезпечують ефективніше перекривання (рис. 3.8). У молекулі етану σ-зв'язки C—H утворюються внаслідок осьового s—«р3-перекривання, а σ-зв'язок C—C за рахунок sp3—$р3- перекривання орбіталей. Тому що максимальна електронна густина при σ-перекриванні згромаджена у просторі між ядрами атомів, σ-зв'язок міцніший.
Поряд з перекриванням атомних орбіталей вздовж осі, з'єднуючої ядра атомів, існує так зване бокове перекривання атомних орбіталей. У ньому беруть участь тільки паралельно розташовані р-атомні орбіталі. Бокове перекривання р-орбіталей називають π-перекриванням, а зв'язок, який утворюється,— π-зв'язком (рис. 3.9).
39
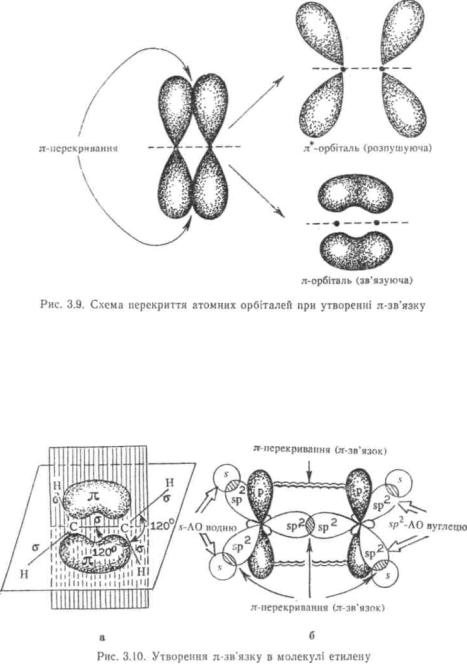
У результаті π-перекривання двох р-атомних орбіталей утворюються дві молекулярні π-орбіталі, одна з яких називається л.-зв'язую-чою MO, друга — π-розпушуючою MO. В основному стані обидва електрони займають зв'язуючу π-орбіталь, що приводить до утворення π-зв'язку. Максимальна електронна густина π-зв'язку сконцентрована у двох областях —■ вище і нижче осі, що з'єднує ядра атомів. Тому π- зв'язок є слабший, ніж σ-зв'язок. π-Зв'язок утворюється лише між атомами, котрі знаходяться в Sp2- і sp-гібридному стані (рис. 3.10).
У молекулі етилену (рис. 3.10) атоми вуглецю перебувають у хр'!-гібридизації. σ-Шрекривання трьох гібридизованих орбіталей
40
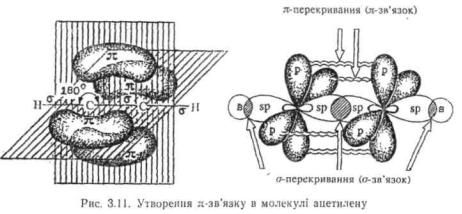
ножного з атомів вуглецю дає вже розглянуті σ-зв'язки (два C—H і один C—C). π-Перекривання двох негібридизованих р-орбіталей дає вуглець-вуглецевий π-зв'язок. У результаті між атомами вуглецю утворюється подвійний зв'язок, який являє собою сполучення σ- і л- зв'язків. При цьому π-зв'язок розташований у площині, перпендикулярній площині σ-зв'язку.
Аналогічно утворюється л-зв'язок між атомами, що знаходяться у spгібридному стані.
У молекулі ацетилену (рис. 3.11) вуглецеві атоми перебувають у spгібридизації і утворюють між собою потрійний зв'язок, який складається з одного σ- і двох л-зв'язків. σ-Зв'язок виникає за рахунок перекривання sp-гібридизованих орбіталей, а чотири р-орбі-талі утворюють два л-зв'язки, розташовані у взаємно перпендикулярних площинах.
Як уже згадувалось, у залежності від кількості електронних пар, які беруть участь в утворенні хімічного зв'язку між двома атомами, розрізняють прості і кратні ковалентні зв'язки. Прості зв'язки (їх ще називають одинарними) представлені завжди σ-зв'язком. У склад кратних зв'язків, поряд з σ-зв'язком, входить також л-зв'язок. Кратні зв'язки розрізняють подвійні і потрійні.
3.2.3. Основні характеристики ковалентних зв'язків
Довжина зв'язку. Довжиною зв'язку називають відстань міл· центрами зв'язаних атомів у молекулі. Основними методами визначення довжини зв'язку є дифракція рентгенівських променів, дифракція електронів і спектроскопічні методи. Враховуючи, що атоми у молекулі перебувають у постійному коливному русі, довжини зв'язків є наближеними величинами. У табл. 3.2 наведені довжини найбільш розповсюджених ковалентних зв'язків.
У хімічній літературі довжини зв'язків частіше наводяться в ангстремах (А), або нанометрах (нм). У міжнародній системі оди-
4!
