
Органічна хімія, том 1 - Черних В
..pdf
ниць (CI) за одиницю вимірювання приймають пікометри, скорочено пм (1 нм=10 A=IOO пм). Як видно з наведених даних (табл. 3.2), довжина зв'язку залежить від природи і типу гібридизації атомів, що утворюють зв'язок. Чим більше s-характер атомів вуглецю, тим міцніший зв'язок між ними. Найчастіше це пояснюється тим, що зі збільшенням s-характеру гібридної орбіталі вона міцніше утримується ядром.
Енергія зв'язку. Кількість енергії, яка виділяється при утворенні хімічного зв'язку між двома вільними атомами, або ж кількість енергії, яку необхідно витратити на роз'єднання двох зв'язаних атомів, називають енергією зв'язку. Утворення зв'язку завжди супроводжується виділенням, а його розрив — витратою певної кількості енергії. Енергія, необхідна для гемолітичного (А· ^ -В) розщеплення окремого зв'язку у молекулі, називається енергією дисоціації зв'язку. Оскільки енергія дисоціації залежить від структури молекули, для характеристики енергії зв'язку звичайно використовують середні значення енергії дисоціації. Енергію зв'язку виражають у кілоджоулях на моль (кДж/моль) або кілокалоріях на моль (ккал на моль). Значення енергії зв'язку служить мірою її міцності. У табл. 3.3 наведені енергії зв'язків, найбільш розповсюджених в органічних сполуках.
42
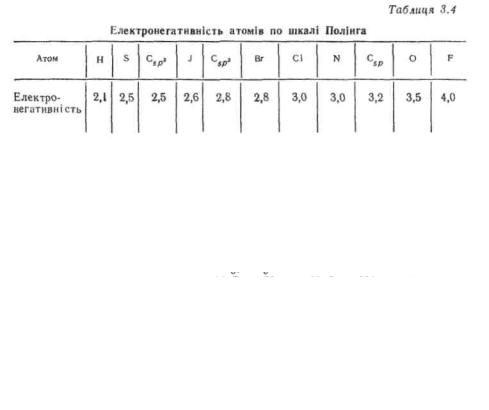
При порівнянні даних табл. 3.2 і 3.3 видно, що зі збільшенням s- характеру зв'язку його довжина зменшується, а міцність зростає. Подвійні зв'язки коротші і міцніші щодо відповідних одинарних, а потрійні — відносно подвійних. Але разом з тим енергія подвійного зв'язку менше подвоєної, а потрійного — потроєної енергії одинарного зв'язку. Це означає, що σ-зв'язок міцніший за «-зв'я- зок. Якщо простежити за елементами у межах групи періодичної системи (наприклад, зв'язок C—HaI), то видно, що при русі зверху вниз довжина зв'язку збільшується, а міцність зменшується.
Полярність зв'язку. Полярністю зв'язку називають нерівномірний розподіл електронної густини зв'язку, зумовлений електронегативністю атомів. Електронегативність — це здатність атома притягати електрони. Вона залежить від ефективного заряду ядра атома і виду гібридизації атомних орбіталей. Найбільш відома шкала електронегативності складена американським хіміком Л. Полінгом. У табл. 3.4 наведені електронегативності деяких елементіворганогенів (за Полінгом).
Згідно з табл. 3.4 електронегативність атома вуглецю, яка рівна 2,5, характерна для «^"-гібридизованого стану. При збільшенні «-ха- рактеруорбіталейелектронегативністьзростає: С,рх— 2,8; Csp — 3,2.
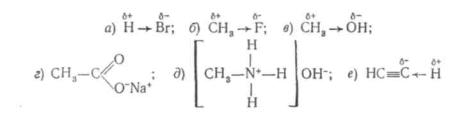
Полярний ковалентний зв'язок утворюється між атомами з різною електронегативністю, а також між атомами з однаковою електронегативністю, але які у свою чергу пов'язані з атомами, що мають іншу електронегативність (див. підрозд. 4.1):
В молекулі хлоретану атом хлору поляризує не тільки зв'язок
C—Cl, але і зв'язок C—C.
Кількісно полярність зв'язку виражається дипольним моментом, який позначають буквою μ (грец. «мю»). Дипольний момент дорівнює добутку відстані між «центрами важкості» позитивних і негативних зарядів на їх значення. Звичайно дипольний момент виражають в одиницях Дебая, скорочено Д. В одиницях CI його наводять в аттокулоннанометрах (аК-нм) : 1 Д = 3,33564- 1O-3 аKX Хнм. Дипольниймомент— векторнавеличина. Длябільшостікова-
43
лентних зв'язків дипольний момент дорівнює 0—З Д, сильно полярні зв'язки мають 4—7 Д, іонні —понад 10 Д. Молекулу, складену з трьох і більше атомів, розглядають як систему декількох диполів. Виміряти дипольний момент кожного окремого зв'язку у такій молекулі неможливо. Можна виміряти сумарний дипольний момент молекули (результуючий диполь), який являє собою суму векторів дипольних моментів окремих зв'язків. Знаючи значення дипольного моменту молекули і кутів між напрямленням зв'язків, можна визначити дипольні моменти окремих зв'язків шляхом розкладання за правилом паралелограму. Сумарний дипольний момент молекули залежить не тільки від числа і природи полярних зв'язків, але і від взаємного розташування їх у просторі. Так, молекула тетра-хлорметану (CCl4) містить чотири зв'язки C—Cl з дипольним моментом 1,46 Д кожний, а в цілому сполука не має диполя (μ=0), тому що відбувається взаємна компенсація дипольних моментів окремих зв'язків. Молекула ж хлорметану (СНз—Cl) має дипольний момент 1,86 Д, зумовлений в основному полярністю зв'язку C—Cl.
Наявність диполя суттєво впливає на фізичні і хімічні властивості речовини. Наприклад, температури кипіння полярних сполук вищі, ніж неполярних. Полярні речовини добре розчиняються в полярних розчинниках, а неполярні, як правило,— в неполярних.
Полярність хімічних зв'язків визначає тип хімічної взаємодії (тип реакції) і є кількісною характеристикою реакційної здатності речовини.
Поляризовність зв'язку. Під «поляризовністю» розуміють легкість, з якою зміщуються електрони зв'язку під впливом зовнішньої дії (електричне поле, реагуюча частинка і ін.). Іншими словами, поляризовність—це здатність електронної хмари зв'язку до поляризації під впливом зовнішнього електричного поля або електрично заряджених частинок. В результаті зовнішніх дій відбувається деформація електронної хмари зв'язку, зростає її полярність (збільшується дипольний момент). Слід відрізняти поняття поляризовність від полярності зв'язку. Якщо полярність зумовлена різною електронегативністю зв'язаних атомів, то поляризовність визначається ступенем рухливості електронів зв'язку. Полярність — ие статичне явище, а поляризовність — динамічне. Поляризовність) не завжди узгоджується з полярністю. Так, якщо полярність вуг-лець-галоїдного зв'язку зменшується в ряду C—F>C—Cl>C—Br> >С—І, то її поляризовність, навпаки, збільшується.
При порівнянні поляризовності σ- і π-зв'язків необхідно відзначити, що π-зв'язки поляризуються значно легше, ніж σ-зв'язки, оскільки π- електронна густина знаходиться далі від атомних ядер. Як і полярність, поляризованість впливає на реакційну здатність речовин, але її внесок значно більший.
Напрямленість зв'язків. Ковалентні зв'язки мають певну напрямленість у просторі. Електронні пари, які утворюють хімічні зв'язки, намагаються зайняти таке просторове положення відносно один другого, щоб ,сили електростатичного відштовхування між ними були мінімальними. Кути між напрямками зв'язків у моле-
44
кулі називають валентними кутами. Розмір валентного кута залежить від стану гібридизації атомних орбіталей і природи атомів, утворюючих зв'язки. Так, кути між зв'язками C—H в метані складають 109°28'. Однак це справедливо лише у тих випадках, коли атом вуглецю зв'язаний з чотирма однаковими замісниками. У більшості ж випадків спостерігаються невеликі відхилення від кута правильного
тетраедра. Наприклад, у молекулі 2- бромпропану
валентний кут C—С—Br
дорівнює 114,2°. Аналогічно, незначне відхилення від валентних кутів 120° і 180° спостерігається у сполуках з атомом вуглецю в sp2- і sp-гібридизації.
КОНТРОЛЬНІ ПИТАННЯ І ВПРАВИ
1. Наведіть електронні конфігурації елементів: C, O, N, S, Cl. Вкажіть, скільки валентних електронів має кожний з цих елементів. Поясніть, чому вуглець в органічних сполуках має валентність, яка дорівнює чотирьом.
2. Запишіть наведені нижче сполуки у вигляді структур Льюїса, позначивши (де необхідно) неподілені пари електронів: Br2; C2H6; C2H2; C3H6; CH2O; CH3NH2; CH3Cl.
3. Дайте визначення поняттю гібридизація. Які види гібридизації можливі для атома вуглецю в органічних молекулах? Наведіть приклади і вкажіть форму та просторову напрямленість атомних орбіталей у кожному випадку.
4.Визначте вид гібридизації атомів у таких сполуках:
5.Дайте визначення основним типам хімічного зв'язку. Укажіть, які типи хімічного зв'язку наявні в молекулах наведених СПОЛУКІ
6. Дайте визначення σ- та π-зв'язкам. Вкажіть, які зв'язки у молекулах наведених сполук відносяться до σ-, а які — до π-типу. Вкажіть атомні орбіталі, які беруть участь в утворенні цих зв'язків.
45
7.Діетиловий ефір C2H5—O—C2H5 і н-бутиловнй спирт C4H9—OH мають однакову молекулярну масу. Поясніть, чому температура кипіння спирту (1180C) значно вища, ніж ефіру (35°С)?
8.Дайте визначення поняттям полярність і поляризовнісгпь зв'язку. Поясніть причину появи дробних або цілих зарядів у сполуках, структурні формули котрих наведені нижче:
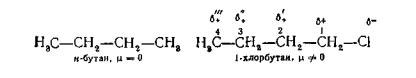
Глава пг
ВЗАЄМНИЙ ВПЛИВ АТОМІВ В ОРГАНІЧНИХ СПОЛУКАХ
Ідея про взаємний вплив атомів |
на |
реакційну |
здатність орга |
|||
нічних сполук уперше |
висловлена |
O. M. Бутлеровим у теорії хіміч |
||||
ної будови. Дальший розвиток |
вона |
одержала у |
теорії електрон |
|||
них зміщень (електронні ефекти). Згідно з сучасними уявленнями |
||||||
реакційна |
здатність |
органічних |
сполук |
визначається характером |
||
розподілу електронної густини у молекулі та рухливістю (поляри- |
||||||
зовністю) |
електронів |
|
ковалентних |
зв'язків. |
||
%
В органічних сполуках розрізняють два види електронних зміщень: зміщення електронної густини по ланцюгу σ-зв'язків — індуктивний ефект і зміщення по системі π-зв'язків — мезомерний ефект.
4.1. ІНДУКТИВНИЙ ЕФЕКТ
Як уже відзначалось, при утворенні ковалентного зв'язку між двома атомами з однаковою електронегативністю електронна пара у рівній мірі належить зв'язаним атомам (неполярний зв'язок). Якщо ж атоми мають різну електронегативність, електронна густина ковалентного зв'язку зміщується до електронегативнішого атома (полярний зв'язок). У складних органічних молекулах полярний ковалентний зв'язок впливає на сусідні зв'язки, приводить до зміни їх електронного стану, викликаючи поляризацію:
Так, у молекулі н-бутану всі вуглець-вуглецеві зв'язки неполярні, електронна густина розподілена симетрично і молекула не має дипольного моменту. Введення у молекулу н-бутану атома хлору (1- хлорбутан) приводить до поляризації не лише зв'язку C—Cl, але і сусідніх вуглець-вуглецевих зв'язків. Атом хлору, маючи більшу електронегативність, ніж вуглець, стягає електрони σ-зв'язку C—Cl
47
у свій бік. У результаті такого зміщення на атомі хлору виникає частковий негативний заряд (δ-), а на вуглецевому атомі рівний за значенням позитивний заряд (δ+). Зменшення електронної густини на C частково компенсується стяганням в його бік електронів з сусіднього атома вуглецю, що приводить до поляризації зв'язку C2—C і виникненню часткового позитивного заряду на атомі C2. Цей, у свою чергу, викликає поляризацію зв'язку С3—C2 і т. д. У міру віддалення зв'язку значення дробного заряду на атомах вуглецю зменшується: δ+>δ'+>6" + >δ'"+. Таким чином, поляризація зв'язку C—Cl викликає електронну асиметрію молекули і появу дипольного моменту.
Передача електронного впливу вздовж ланцюга σ-зв'язків називається індуктивним (індукційним) ефектом.
Індуктивний ефект позначається буквою «/», напрямок зміщення електронної густини σ-зв'язків—прямою стрілкою (-*-).
Дія індуктивного ефекту найсильніше виявляється на двох найближчих σ-зв'язках. Через слабку поляризовність σ-зв'язків індуктивний ефект через 3—4 зв'язки загасає.
У залежності від напрямку електронного впливу замісника розрізняють індуктивний ефект позитивний (+/) і негативний (—/). В якості стандарту для оцінки напрямку індуктивного ефекту замісника прийнятий індуктивний ефект атома водню, який, враховуючи невеликий дипольний момент зв'язку C—H," вважається рівним нулю.
Замісники, що притягають до себе електрони σ-зв'язку у більшому ступені, ніж атом водню, виявляють негативний індуктивний ефект (—/·), а замісники, що відштовхують від себе електрони зв'язку сильніше атома водню, виявляють позитивний індуктивний ефект ( + /).
Під притяганням і відштовхуванням мається на увазі різниця у положенні електронів зв'язку, зумовлена різною електронегатив-ністю атома водню і замісників.
На с. 49 наведені деякі важливі замісники, розташовані у порядку зменшення —/- або +/-ефектів по відношенню до водню.
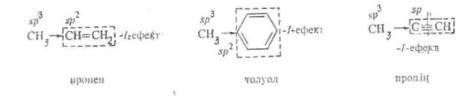
Негативний індуктивний ефект замісника, як правило, тим більший, чим вища електронегативність атома, зв'язаного з вуглецевим ланцюгом. Найбільший негативний індуктивний ефект виявляють групи, що несуть позитивний заряд. При інших рівних умовах sp- гібриднзовані атоми мають більшу електроноакцепторпу здатність, ніж sp2-aTOMH, а ті, у свою чергу, більшу, ніж хр3-атоми. Цим пояснюється негативний індуктивний ефект залишків ненасичепих і ароматичних вуглеводнів:
48
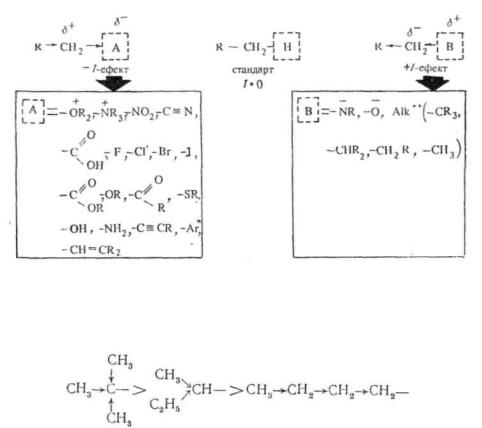
Найбільший позитивний індуктивний ефект виявляють замісники, що несуть негативний заряд. Серед алкільних груп більші електронодонорні властивості мають третинні радикали, потім вторинні і, нарешті, первинні:
У ряду первинних алкільних радикалів позитивний індуктивний ефект зростає зі збільшенням вуглецевого ланцюга:—СЛ-І9> -СзН7>- С2Н8>—СН».
Таким чином, на підставі вищевикладеного можна зробити такі висновки:
1.Індуктивний ефект виявляється завжди при наявності у молекулі атомів з різною електронегативністю.
2.Індуктивний ефект розповсюджується лише через σ-зв'язкн і завжди в одному напрямку.
3.Індуктивний ефект загасає в ланцюгу через 3—4 σ-зв'язки.
4.2. МЕЗОМЕРНИЙ ЕФЕКТ (ЕФЕКТ СПРЯЖЕННЯ]
На відміну від індуктивного ефекту, по-іншому відбувається передача електронного впливу замісника по спряженій системі л- зв'язків.
* Ar — ароматичний радикал. ** AIk—алкільні групи.
48
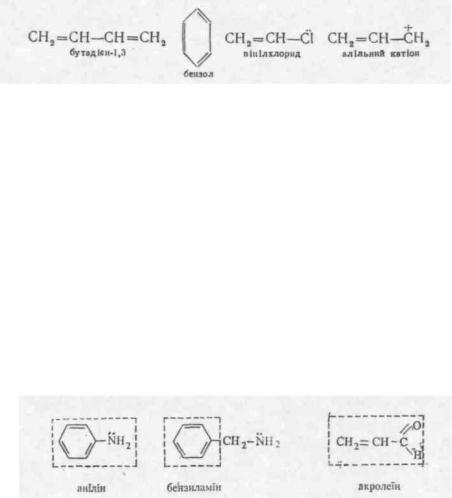
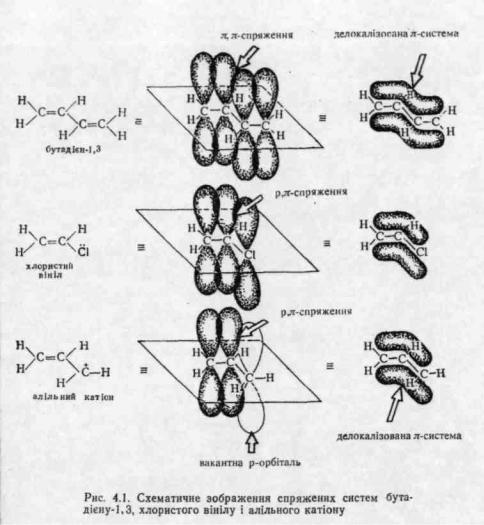
Спряженою називається система, що складається з простих і кратних зв'язків, які чергуються, або ж коли поряд з вуглецевим атомом, що утворює кратний зв'язок, знаходиться атом з неподіле-ною парою р-електронів або атом, що має вакантну р-орбіталь. Наприклад:
Спряжені системи поділяються на системи з відкритим і замкненим ланцюгом.
У спряжених системах має місце додаткове перекривання π- і р- орбіталей, яке називають спряженням. Розрізняють π, π-спря-ження — перекривання двох π-орбіталей і р, π-спряження — перекривання р- орбіталі з π-орбіталлю (рис. 4.1). Спряження можливе лише у випадку паралельності осей симетрії взаємодіючих орбі-талей.
У результаті спряження утворюється єдина π-електронна система і відбувається перерозподіл (делокалізація) π-електронної густини (рис. 4.1).
Для молекули спряження є енергетично вигідним процесом. Воно супроводжується зменшенням енергії системи і приводить до підвищення термодинамічної стійкості молекули.
Процес передачі електронного впливу замісника по спряженій системі π-зв'язків називають мезомерним ефектом (M) або ефектом спряження (C). Мезомерний ефект виявляється лише у тому випадку, коли замісник включений у спряжену систему молекули.
Так, аміногрупа у молекулі аніліну і альдегідна група в акролеїні входять у спряжену систему і, як наслідок, виявляють мезомерний ефект, а у молекулі бензиламіну аміногрупа мезомерного ефекту не виявляє.
Розрізняють мезомерний ефект замісника позитивний ( + M) і негативний (—M).
50
Позитивниймезомернийефектвиявляютьзамісники, якінадають електрони у спряжену систему.
До них відносять атоми, що містять неподілені пари електронів або негативний заряд, а також атомні групи, котрі мають на першому атомі неподілені електронні пари або негативний заряд.
Негативниймезомернийефектвиявляютьзамісники, яківід-
тягаютьнасебеелектроннугустинуспряженоїсистеми.
—Λί-Ефект мають замісники, перший атом яких несе позитивний яаряд, а також атомні групи, в яких перший атом зв'язаний кратним зв'язком з електронегативнішим атомом, ніж він сам.
51
