
Органічна хімія, том 1 - Черних В
..pdf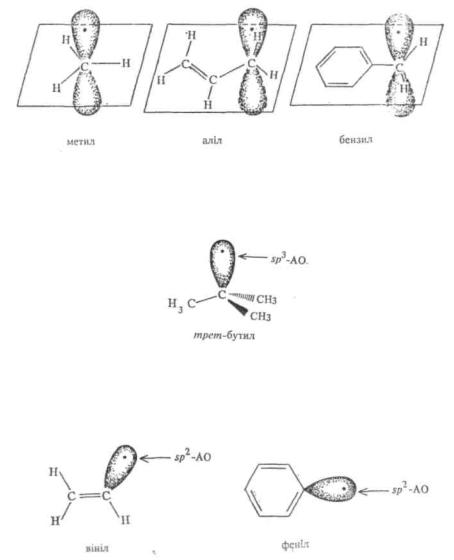
Найчастіше зустрічаються вільні радикали, які несуть неспарсний електрон на атомі вуглецю. У таких радикалах атом вуглецю з неспареним електроном може мати площинну і тетраедричну конфігурацію. Прості алкільні радикали, а також радикали, в яких вуглець з неспареним електроном перебуває у спряженні з π- електронами кратного зв'язку або бензольного кільця, мають площинну будову радикального центра, тобто атом вуглецю перебуває у 5р2-гібридизації, неспарений електрон займає р-атомну орбіталь:
Третинні алкільні радикали мають тетраедричну будову радикального центру; неспарений електрон займає $р3-гібридну орбіталь:
Як і у випадку карбаніонів, якщо атом вуглецю з неспареним електроном бере участь в утворенні подвійного зв'язку, радикальний центр має площинну будову, а неспарений електрон перебуває на 5р2-гібридизованій орбіталі:
134
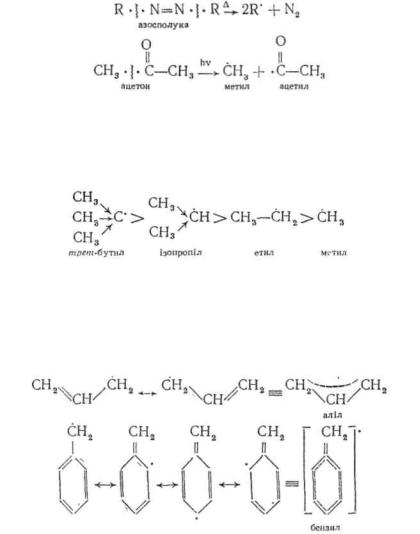
Вільні радикали утворюються внаслідок гомолітичного розриву ковалентного зв'язку у молекулі, який відбувається в основному при термічних і фотохімічних впливах:
Стійкість вільних радикалів, аналогічно карбкатіонам і карбаніонам, залежить від їх структури і визначається можливістю делокалізації неспареного електрона. Чим більша делокалізація, тим вища стійкість.
У ряду алкільних радикалів стійкість змінюється за порядком третинний>вторинний>первинний> CH3, наприклад:
Алкільні групи за рахунок +/-ефекту збільшують електронну густину у радикальному центрі і тим самим частково заповнюють одноелектронну орбіталь другим електроном, приводячи, по суті, до делокалізації. Вільні радикали, в яких одноелектронна орбіталь перебуває у спряженні з π-електронпою системою кратних зв'язків, є стійкішими, тому що у даному випадку делокалі-запія неспареного електрона відбувається по всій спряженій системі:
Незважаючи на те що бензильні і алільиі радикали стійкіші, ніж прості алкільні, усі вони мають високу реакційну здатність і існують лише як проміжні частинки. Поряд з тим є і довгоживучі вільні радикали. Так, радикал трифенілметил (C6Hs)зС зберігається у вільному стані у розчині за кімнатної температури довгий час.
Оскільки вільні радикали володіють неспареїшм електроном,
135
вони мають магнітний момент і є парамагнітними частинками. Ця властивість використовується для їх виявлення. Метод, заснований на вимірюванні магнітних властивостей неспарених електронів, одержав назву електронного парамагнітного резонансу (ЕПР). Цей метод аналогічний ядерному магнітному резонансу, однак замістьядерного спіну уньому фіксують спінелектрону.
КОНТРОЛЬНІ ПИТАННЯ І ВПРАВИ
1.Назвіть енергетичні умови, необхідні для протікання хімічних реакцій. Дайте визначення поняттям: енергія активації, пере-
хідний стан, проміжна сполука (інтермедіат), лімітуюча стадія реакції.
2.Охарактеризуйте основні типи хімічних реакцій. Визначте тип кожної з наведених нижче реакцій та позначте її відповідним символом. У іонних реакціях вкажіть нуклеофіл і електрофіл:
3. Як класифікують механізми органічних реакцій? Викори стовуючи рівняння реакцій, наведених у вправі 2, укажіть, які з них протікають за гомолітичннм, а які — за гетеролітнчним ме ханізмом. «
136
4. Дайте визначення поняттям карбкашіон,
карбаніон, вільний радикал.
Назвіть такі частинки: 5. Розгляньте
електронну і просторову будову таких проміжних активних
частинок:
Назвіть ці частинки.
6. Які фактори визначають стійкість карбкатіонів? Розташуйте в порядку збільшення стійкості такі карбкатіони: метил-, пропіл-, втор- бутал-, бензил-, грег-пентил- і хлорметил-катіон.
7. Перелічте структурні фактори, які впливають на стійкість карбаніонів. Наведіть приклади найбільше і найменше стійких карбаніонів.
8. Від чого залежить ступінь делокалізації неспареного електрона у вільних радикалах? Який радикал найстійкіший: пропіл-, алілабо трифенілметил і чому?
ПРЕДМЕТНИЙ ПОКАЖЧИК
Активований комплекс, див. Перехідний стан Аліфатичні сполуки, див. Ациклічні сполуки Аліциклічні сполуки 15, 16, 84 Альтернування поляризації 54, 55 Ароматичні системи 12, 15
— сполуки 15, 108, 116
Атом вуглецю
— валентні стани (гібридизація) 35—37, 40, 43, 45, 48, 65, 70, 81,82, 131, 134
— вторинний 21, 22
— електронегативність, див. Електронєгативність атомів
— збуджений стан 35
— основний стан 35
— первинний 21, 22
— третинний 21, 22
— хіральний (асиметричний) 70—81,88 Ауксохроми 108 Ахіральні молекули 69, 73, 81 Ациклічні (аліфатичні)
сполуки 15, 16 Гетерофункціональні органічні сполуки 17, 18 Гетероциклічні сполуки (гетероцикли) 13, 15, 16 Гіперкон'югація, див. Надспряження Головний вуглецевий ланцюг 21, 72 Гомологічний ряд 18 Гомотопні (еквівалентні) атоми або замісники 81, 82
137
Граничні структури, див. Резонансні структури
Діастереомери 73, 74, 83, 84, 87
Еквівалентні замісники, див. Гомотопні атоми або замісники
Електронегативність атомів (за Полінгом) 43
Електронографія 104, 119 Елементи симетрії органічних молекул 68, 69
Енантіомери (див. також Ізомери оптичні) 70—76, 78—84, 88 Енантіотопні атоми (групи) 81, 82 Енергетичний бар'єр обертання 90, 91 Енергія
—активації 121 —123
—вбирання випромінювання 106, 107
—вільна121 — 123
—резонансу 59
Ефект
—гіперхромний 109
—гіпохромний 109
—індуктивний 12, 47—49, 53—55, 97, 129, 132, 135
—мезомерний (ефект спряження) 12, 47, 49—57, 97
—надспряження (гіперкон'югації) 55, 129
—сольватаційний 98, 99,130, 133
—спряження, див. Ефект мезомерний
Замісники 19, 21—24, 48—54, 57, 70—74, 76—88, 91, 96—99, 108 115, 130, 132
Зсув
—батохромний 108
—гіпсохромний 108
—хімічний 115—117 Ізомери 61
—геометричні 64, 84—89
—ерітро-, трео- 77
—конфігураційні 64, 93
—конформаційні (поворотні) 64, 92, 93
—оптичні (див. також Енантіомери) 64, 67, 71, 74—76, 88
—просторові (стереоізомери) 63, 72, 73, 85, 87, 88
—структурні 61, 63
—цис-, транс- 85—89
Ізомерія 61
—вуглецевого ланцюга 61—63
—геометрична (цис-транс-\зомерія) 61,84—88
—конфігураційна 61
—конформаційна (поворотна) 61,89
—оптична 61, 67, 75
—положення 61—63
—просторова (стереоізомерія) 61,63
—структурна (ізомерія будови) 61,62
—функціональних груп 61—63
Інтенсивність
— вбирання 107, 1Q8
138
—сигналів 117 Інтермедіати 123, 127
Карбаніони 123, 127, 128, 130—134 Карбкатіонн 123, 127—130, 133, 135
Карбоцнклічні сполуки (карбоцикли) 15, 16 Квантові числа 32 Кислотний центр 96, 97 Кислоти 95—101
—жорсткі 100, 101
—Льюїса (апротонні) 100, 101, 125, 129
—м'які 100, 101
—органічні, типи 96
—снряжені 95, 96, 98 Класифікація органічних сполук 15—18 Коливання в органічних молекулах 110, 111, 113 Комплекс
—активований, див. Перехідний стан
—п- 100
—π-99, 100
—σ- 123
Константа
—кислотності 95, 96
—основності 96
—спін-спінової взаємодії 117 Конфігурація 63
—абсолютна 75, 76, 78
—відносна 75, 76
—елементів електронна 33
—енантіомерів 70, 75, 76, 78
—лінійна 63
—молекул 63, 75, 76
—площинна 63, 134
—системи позначення
-----D, L- 75—77
-----E, Z- 85—88
-----R, S- 78—80
------син-анти- 87
-----цис-транс- 85—87
—тетраедрична 63, 134
Конформація 63, 89
—загальмована 89—93
анти-, гош- 91—93
—заслонена 89—92
—молекул 32, 64, 67, 89, 92
—скошена 89
Конформери, див. Ізомери конформаційні
Локанти 23, 24 Мас-спектрометрія 103, 104, 118, 119 Мезо-форма 73, 74, 88
139
Методи
— валентних зв'язків (ВЗ) 12,34
— деструктивні 118
— дипольних моментів 57 ■—дифракційні 104, 119
— ебуліоскопічний 103
— електронного парамагнітного резонансу (ЕПР) 136
— кріоскопічний 103
— молекулярних орбіталей (MO) 12, 34, 35, 106
— резонансних структур 58, 59
— спектральні 32, 104 Моделі
— Драйдінга 64, 65
— кульострижньові 64, 65
— молекулярні 14, 64, 69, 71, 79
—півсферичні (див. моделі Стюарта— Бріглеба)
— Стюарта — Бріглеба 64, 65
Молярний коефіцієнт вбирання 110 Монофункціональні органічні сполуки 17, 18 Мультиплетність 117 Надспряження (гіперкон'югація) 55, 56 Напруга
— Ван-дер-Ваальса 91
— торсійна (Пітцера) 91 Насичені сполуки 15, 16 Нейтронографія 104, 119 Ненасичені сполуки 15, 16 Номенклатура органічних сполук
— женевська 19
— замісникова 19, 23, 24
— міжнародна (номенклатура ІЮПАК) 18, 19
— радикало-функціональна 19,24
— раціональна 18, 19
— тривіальна 18
Оптична активність 67, 68, 70, 71, 73, 74, 80
Оптичні антиподи (оптичні ізомери) див. Ізомери оптичні Оптична густина 109
Op біталі
— атомні (AO) 32—36,38—40, 131
гібридизація 35
------ d- 32, 33, 38
------ р- 32, 33, 35—41, 50, 51, 56, 57, 128, 131, 134
------ S-32—41,98
------ sp- 36—41, 131
------ sp-- 36—40, 131, 132, 134
-----sp3- 36, 38, 39, 131, 134
—вакантні 33, 35, 50, 51, 100, 125, 126, 128
—вироджені 33
—молекулярні (MO) 34, 35, 39, 40
140
------антизв'язуючі, див. Орбіталі молекулярні розпушуючі
— зв'язуючі 34^ 35, 40, 58, 107
незв'язуючі 35, 107
------π- 39, 40, 50, 55, 56, 95, 98, 99, 107
----- розпушуючі 34, 35, 40, 107
------σ-39, 55, 56, 107 Основи 95, 96, 98—101
— жорсткі 100, 101
— Льюїса 100, 101
— м'які 100, 101
— органічні, типи 98
— спряжені 95, 96 Перехідний стан 122, 123 Питоме обертання 68, 73 Площина поляризації 67, 70, 75, 76 Поліфункшональні органічні сполуки 17, 18 Поляризоване світло 67, 68, 70, 75 Правило
— Гунда 33, 35
— октетне 27
— Хюккеля 12
Призма Ніколи 67 Принцип
— ЖМКО 100, 101
— Паулі 33
Проміжні активні частинки 127, 130, 135 Пропускання 111, 112 Прохіральні молекули 83
Радикали 10, 21, 22,24, 49
— вільні 21, 124, 127, 128, 133—135
Рацемічна сполука (рацемат) 80 Рацемічна форма
80—84
— методи розділення 83, 84 Рацемічна суміш 71, 80 Реагенти
—атакуючі 122, 125
—ахіральні 82
—електрофільні 125
—нуклеофільні 125
—хіральні 82
Реакції
—бімолекулярні 127
—відщеплення (елімінування) 127
—електрофільні 124, 126
—заміщення 127
—механізм 124
-----гетеролітичний (іонний) 124
-----гомолітичний (вільнорадикальний) 124
-----періциклічний (молекулярний) 126
141
— мономолекулярні 127
— нуклеофільні 126
— окислення і відновлення 127 ■— перегрупування 127
— приєднання 126
— селективність (вибірковість) 122
— стереоселективні 83
— типи 126
— швидкістьвизначальна (лімітуюча) стадія 123, 127 Резонанс 58 Резонансні (граничні) структури 34, 58 Рентгенографія
(рентгеноструктурний аналіз) 75, 104, 119 Родоначальна структура сполуки 21—24 Смуги вбирання спектральні 106,
108 — характеристичні 113 Спектроскопія
— електронна 106, 108, 110
— інфрачервона (14) 32,80, 104—106, 110, 111, 113
— комбінаційного розсіювання (KP) 32, 104
— ультрафіолетова (УФ) 104, 106, 130, 133
— протонного магнітного резонансу (ПМР) 114, 115, 117, 118
— ядерного магнітного резонансу (ЯМР) 32, 38, 104, 114, 130, 133, 136
Спряжені системи 49—59, 108, 132, 135 Спряження 50, 51, 55—57, 135
Стереоізомери, див. Ізомери просторові
Стер-еоформули 65, 66 Субстрат 124 Таутомерії 63 Таутомерія 63 Теорія
— електронних зміщень 12, 47
— квантова (квантово-механічна) 9, 12, 32, 34, 35, 55
—кислот і основ
-----електронна (апротонна теорія Льюїса) 95, 100, 101
-----протонна (протолітична теорія Бренстеда) 95, 100
—радикалів 10
—резонансу 12, 34 —
стереохімічна 12
—типів 12, 34
—хімічного зв'язку електронна 12, 27
—Хімічні будови Бутлерова 9, 11, 12,47 Торсійний (двогранний) кут 90 Формули
—графічні, див. Формула структурні
—молекулярні (брутто-формули) 14, 103
—перспективні 65, 66, 89
—проекційні Ньюмена 65, 66, 89
—проекційні Фішера 67, 71, 72, 75—77, 79, 80
142
— стереохімічні 14, 65, 66, 69, 71, 79, 103
— структурні 12—14, 57, 58, 74, 103
скорочені 13
Хвильове рівняння LUредінгера 32, 34 Хвильове число 105, ПО, 112 Хімічний зв'язок
— водневий 30—32, 93
енергія ЗО
— делокалізований 58
— донорно-акцепторний 29, ЗО
— іонний (електровалентний) 27
— ковалентний 27—30, 34—36, 38, 43, 47, 65, 100, 125, 126, 129
дипольний момент 43, 44, 48, 57
----- довжина 41—43
------кратний 15, 21—23, 29, 41, 50—52, 55, 56, 104, 107, 108, 126, 131—135
----- напрямленість 44
----- π- 38—41, 43, 44, 47, 49, 50, 52, 87, 98, 100, 106
------подвійний 15, 21, 23, 37, 41, 82—88, 104, 129, 131, 134
----- поляризовність 44, 48
----- полярність 28, 43, 44, 47
----- потрійний 15, 21, 23, 38, 41, 43, 129, 131
----- %
------простий (поодинокий) 15, 29, 36, 41, 43, 50, 89—91
------σ- 38—41, 43, 44, 47—49, 53—55, 63, 84, 87, 106, 128
----- енергія ЗО, 42, 43
— координаційний ЗО
— локалізований 57
— семіполярний ЗО
— типи 29 Хіральність 67—70 Хромофори 108 Циклічні сполуки 15, 87, 88
Частоти характеристичні в ІЧ-спектрах 113
143
