
Органічна хімія, том 1 - Черних В
..pdf
Напрямок зміщення електронної густини π-зв'язків і неподіле-них пар електронів зображають зігнутою стрілкою (  ), по-
), по-
чаток котрої вказує, які електрони зміщуються, а кінець — зв'язок або атом, до якого вони зміщуються.
Нижче наведені деякі замісники, розташовані у порядку зменшення + M- або—М-ефектів:
Найбільший негативний мезомерний ефект виявляють замісники, що несуть позитивний заряд. —М-Ефект ненасичених груп тим вищий, чим більше різниця електронегативності атомів, зв'язаних кратним зв'язком. Найбільший позитивний мезомерний ефект мають атоми, що несуть негативний заряд. + М-Ефект замісників, вміщуючих атоми з неподіленими парами електронів, тим вищий, чим нижча у межах періоду електронегативність атома, що несе непо-ділену електронну пару, наприклад —ΝΗ2>—ОН>—F. У межах групи періодичної системи +М-ефект замісників слабне зверху вниз (—г>—С1>—Br), що пояснюють більшою вигідністю при перекриванні близьких за розмірами р-орбіталей.
Розрізняють чотири основних типи прояву мезомерного ефекту в органічних сполуках.
1. Взаємодія замісника, який має +М-ефект, з л-електронною системою молекули:
2.Взаємодія замісника, що виявляє —М-ефект, з π-електронною системою молекули:
52

3.Взаємодія двох замісників з 4-М-ефектом ΐ —М-ефектом, зв'язаних а-зв*язком:
4.Взаємодія замісників, маючих -f Λί-ефект і —Λί-ефект, через я- електронну систему молекули:
Важливо відзначити, що на відміну від індуктивного ефекту передача електронного впливу замісника за спряженою системою відбувається на значно більшу відстань, практично не згасаючи.
4.3. СУМІСНИЙ ПРОЯВ ІНДУКТИВНОГО І МЕЗОМЕРНОГО ЕФЕКТІВ ЗАМІСНИКІВ
Раніше було визначено, що індуктивний ефект виявляється в органічних сполуках завжди при наявності у молекулі атомів з різною електронегативністю. Мезомерний же ефект виявляється лише у тому випадку, коли атоми з різною електронегативністю входять у спряжену систему. Тому включені у спряжену систему замісники викликають поляризацію зв'язків за рахунок індуктивного і мезомерного ефектів. Ці ефекти можуть співпадати і не співпадати за напрямком:
53

Для більшості замісників індуктивний і мезомерний ефекти співпадають за напрямком. У замісників, що містять атоми з неиоділеними електронними парами, індуктивний і мезомерний ефекти мають протилежні напрямки і ніби «гасять» один другого.
Оскільки π-зв'язки поляризуються легше у порівнянні з σ-зв'яз- ками, більш виразний вплив на поляризацію молекул чинить мезомерний ефект замісника, як правило, більший від його індуктивного ефекту. Виключення складають лише атоми галогенів (F, Cl, Br, J), для яких у статичному (нереагуючому) стані молекули +М-ефект менше — /-ефекту, але у процесі реакції (динамічний стан) і для них +Λί-ефект більше від —/-ефекту.
Замісники, які підвищують електронну густину в молекулі, називають електронодонорними, а замісники, що знижують її — електроноакцепторними.
Внаслідок сумісного вияву індуктивного і мезомерного ефектів замісника відбувається альтернування (чергування) поляризації у спряженій системі за значенням зарядів:
Наприклад, у молекулі 1-хлорбутадієну-1, 3 внаслідок — /-ефекту атому хлору, який більший, ніж +М-ефект, всі атоми вуглецю набувають дробного позитивного заряду. Але завдяки -Ь/И-ефекту хлору на атомах C2 і C* електронна густина дещо збільшується. І незважаючи на те що у результаті всі атоми вуглецю несуть дробний позитивний заряд, у положеннях C2 і C4 він менший, ніж у C1 і C3, тобто відбувається чергування поляризації за значенням заряду *.
Аналогічне явище спостерігається у системах з замкнутим ланцюгом спряження:
У молекулі аніліну —/-ефект аміногрупи викликає пониження електронної густини на всіх атомах вуглецю бензольного кільця.
*Знак· б++ означає, що у"цьомуположенні електроннагустина нижча, ніж уположенні зі знаком б+.
54
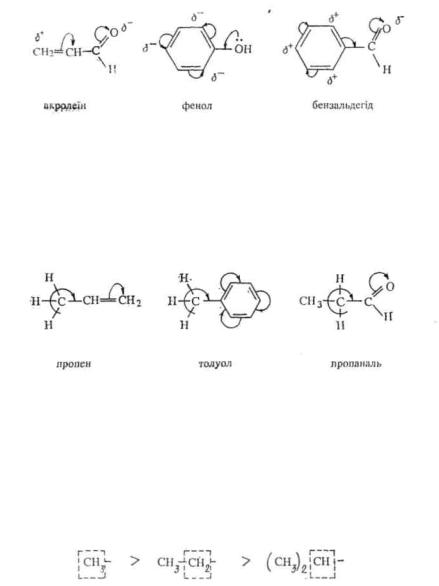
Але тому що +Λί-ефект електронної пари атому азоту більший —/- ефекту, це приводить у цілому до підвищення електронної густини на вуглецевих атомах кільця і особливо у положеннях 2, 4 і 6, тобто відбувається альтернугача поляризація.
Звичайно, у молекулах з відкритим ланцюгом спряження вказують лише часткові заряди, зосереджені на кінцевих атомах спряженої системи, а у замкнених спряжених системах — максимальні заряди на атомах:
4.4. НАДСПРЯЖЕННЯ (ГІПЕРКОН'ЮГАЦІЯ)
Поряд з обговореним раніше π, π- і ρ, π-спряженням у молекулах деяких органічних сполук має місце особливий вид спряження, званий надспряженням або гіперкон'югацією. Надспряження характерне для речовин, в котрих атом вуглецю, який несе принаймні один атом водню, зв'язаний з ненасиченим угрупуванням:
У молекулах таких сполук електронна густина σ-зв'язків C—H вуглецю, зв'язаного з ненасиченим угрупуванням, зміщується у бік кратного зв'язку. Таке зміщення електронів називають надспряженням і схематично зображують зігнутою стрілкою.
З позиції квантово-механічної теорії надспряження розглядають як часткове перекривання σ-орбіталей зв'язків C—H з л-орбіталями кратного зв'язку, тобто відбувається о, π-спряження (рис. 4.2).
Ефект надспряження тим вищий, чим більше є атомів водню при вуглецю, зв'язаному с ненасиченою системою:
55
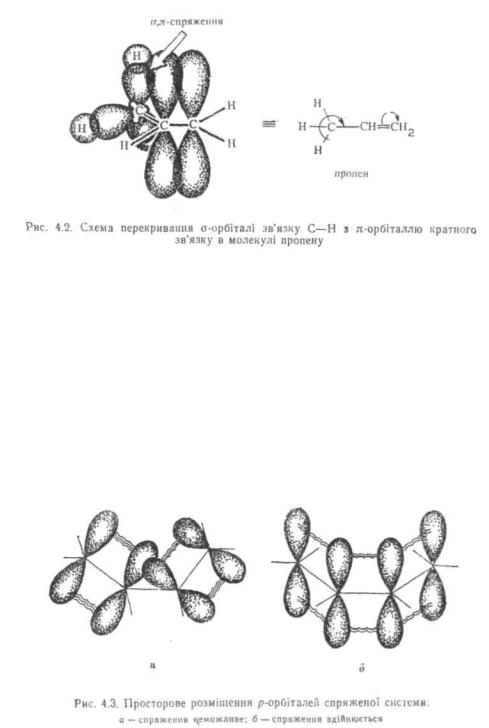
У результаті надспряження ці атоми водню активізуються (протонуються) і виявляють підвищену реакційну здатність.
4.S. ПРОСТОРОВІ ПЕРЕШКОДИ СПРЯЖЕННЮ
Наявність спряженої системи є обов'язковою, але не єдиною умовою для спряження. Важливу роль у спряженні відіграє просторове розташування взаємодіючих орбіталей. Як уже відзначалось, мезомерний ефект виявляється лише у тому випадку, коли всі атоми спряженої системи лежать в одній площині, або близько до неї, тобто коли виконується умова паралельності осей симетрії
56

орбіталеі'і, які беруть участь у спряженні. Якщо ця умова не виконується, спряження не відбувається, або ефективність його значно знижується (рнс. 4.3).
Одною з причин порушення ефекту спряження замісника є просторові (стеричні) перешкоди. Вони виникають при наявності у молекулі у сусідніх з замісником атомів об'ємних груп. У результаті стеричних факторів замісник виходить з площини спряженої системи, що частково або повністю порушує перекривання р-орбі-талей:
Так, у молекулі нітробензолу нітрогрупа і бензольне ,кільце розташовані в одній площині, що забезпечує спряження. У молекулі ж 2, 4, 6-трибромнітробензолу нітрогрупа внаслідок просторових перешкод з боку замісників у положеннях 2 і 6 вимушено виведена з площини бензольного кільця. При цьому осі р-орбі-талей атомів азоту і вуглецю кільця розташовуються під кутом одна відносно другої, що перешкоджає їх перекриванню, а отже, і спряженню.
Вплив просторових перешкод на прояв ефекту спряження замісника можна виявити методом дипольних моментів. У наведеному прикладі молекула нітробензолу має значно більший дипольний момент (3,97 Д), ніж молекула 2,4,6-трибромнітробен-золу (3,17 Д). При співотавленні дипольних моментів необхідно мати на увазі, що розташовані у центросиметричних положеннях бензольного кільця однакові замісники не впливають на дипольний момент молекули.
4.6. СПОСОБИ ЗОБРАЖЕННЯ РОЗПОДІЛУ ЕЛЕКТРОННОЇ ГУСТИНИ В МОЛЕКУЛАХ. ПОНЯТТЯ ПРО РЕЗОНАНС
Структурні формули достатньо однозначно описують будову органічних сполук лише злокалізованими хімічними зв'язками, тобто коли електрони зв'язку розділені (локалізовані) між двома ядрами. Зміщення електронної густини у локалізованих зв'язках молекули зображають у структурній формулі прямою стрілкою (->):
57

У молекулах зі спряженими системами зв'язків одна або більше зв'язуючих орбіталей належать вже не двом атомам, а охоплюють декілька атомних ядер. Такий зв'язок називають дело-калізованим. Використовувані у структурних формулах для означення хімічних зв'язків риски не відображають реального положення електронів у делокалізованих зв'язках.
Для зображення розподілу електронної густини у спряжених системах молекули за допомогою структурних формул використовують два способи. Один з них полягає у тому, що сполука зображається однією структурною формулою, в якій зігнутою стрілкою (
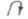 ,) вказується напрямок зміщення р- або π-електронів:
,) вказується напрямок зміщення р- або π-електронів:
Ідея другого способу належить американському вченому Л. TIoлінгу і носить назву методу резонансних структур. Суть його полягає у тому, що делокалізація електронів у спряженій системі зображується за допомогою декількох структурних формул, так званих резонансних (граничних) структур, що різняться одна від другої тільки розподілом електронних пар між ядрами атомів. Дійсна електронна будова молекули не відповідає жодній з даних структур, а є проміжною між ними, тобто реальна молекула розглядається як гибрид резонансних структур. Взаємозв'язок граничних структур зображують двобічною стрілкою ('*'*■)■ Наприклад, делокалізацію електронів у молекулі фенолу можна зобразити у вигляді таких структур:
Резонансні структури не існують реально, це лише засіб опису делокалізаиії електронів у молекулі. Внесок кожної структури у дійсну будову молекули пропорційний її стійкості, тобто чим стабільніша гранична структура, тим внесок її значніший. Від-
58

носна стійкість резонансних структур визначається декількома параметрами.
Стійкішою вважається така структура: а) яка містить більше число ковалентних зв'язків
тобто структура (А) стабільніша, ніж (Б); б) в якій негативний заряд розташований на електронегативні-
шому атомі (або позитивний заряд на атомах з низькою електронегативністю)
тобто структура (А) вносить основний внесок, структура (Б) стабільніша, ніж (В); в) в якій менша відстань між різноіменними зарядами
тобто структура (А) вносить основний внесок, структура (Б) — значний, а структура (В) — незначний внесок.
Енергія дійсної молекули завжди нижча енергії, розрахованої для будь-якої з резонансних структур. Різниця між енергіями реальної молекули і найбільш стійкої граничної структури називається енергією резонансу. Енергія резонансу тим вища, чим більша кількість резонансних структур і чим більше число низькоенер-гетичних структур з рівною або близькою енергією. Енергія резонансу є мірою стабілізації молекули, зумовленої делокалізацією електронів у спряжених системах.
Незважаючи на те що метод резонансу наочніше описує делокалізацію електронної густини у спряжених системах, його застосування утруднене необхідністю написання великого числа граничних структур. Це особливо незручно при складанні рівнянь реакцій, тому далі, як правило, делокалізація електронів у спряжених зв'язках буде зображатись за допомогою зігнутих стрілок. Метод резонансу буде використовуватись лише для якісної оцінки будови і реакційної здатності окремих органічних сполук.
КОНТРОЛЬНІ ПИТАННЯ І ВПРАВИ
1. Дайте визначення поняттям: індуктивний ефект (І);мезомер-ний ефект (M). Наведіть приклади замісників, які виявляють: а) +/-ефект; б) —/-ефект.
Як змінюється електронегативність атомів вуглецю в залежності від типу гібридизації? Укажіть електроноакцепторні групи в таких сполуках:
59
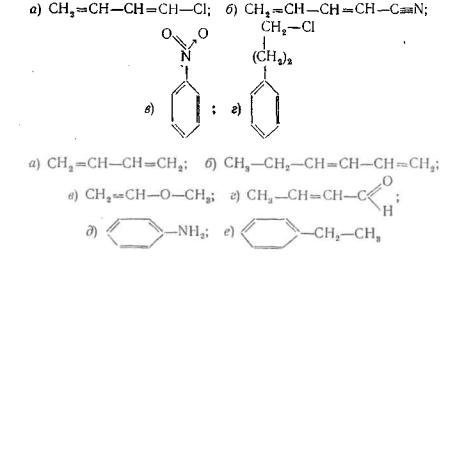
3.Зобразіть розподіл електронної густини у молекулах наведених нижче сполук:
4.Дайте визначення поняттям: спряжена система, спряження.
Внаведенихсполукахвкажіть спряжену системуі видиспряження;
5.Які атоми і атомні групи здатні до прояву: а) +М-ефекту; б) —/-ефекту?
6.За допомогою стрілок, які використовуються для позначення індуктивного f мезомерного ефектів, покажіть розподіл електронної густини в таких молекулах:
7.Що таке резонансні структури? Перелічте фактори, які визначають відносну стійкість резонансних структур. Наведіть резонансні структури для молекули аніліну.
8.Дайте визначення поняттю енергія резонансу. Від чого залежить значення енергії резонансу?

Глава O
ІЗОМЕРІЯ ОРГАНІЧНИХ СПОЛУК. ПРОСТОРОВА БУДОВА
МОЛЕКУЛ
Ізомерія — явище, що полягає в існуванні сполук, однакових за якісним і кількісним складом, але різних за порядком зв'язування атомів у молекулі або розташуванням їх у просторі, а внаслідок цього маючих різні фізичні і хімічні властивості. Вперше термін «ізомери» був впроваджений у 1830 р. шведським хіміком Й. Я. Берцеліусом. Теоретичне ж обгрунтування ізомерії належить російському хіміку O. M. Бутлерову. З розвитком органічної хімії поняття ізомерії поширилось за рахунок уявлень про просторову будову органічних сполук (Я. Вант-Гофф, Ж. А. Ле-Бель, 1874 р.).
Розрізняють два основних види ізомерії — структурну і просторову (стереоізомерія).
5.1. СТРУКТУРНА ІЗОМЕРІЯ
Структурні ізомери відрізняються один від другого послідовністю зв'язування атомів у молекулі, тобто структурою. Ix ще називають ізомерами будовн. Структурна ізомерія підрозділяється на ізомерію вуглецевого ланцюга, ізомерію положення і ізомерію функціональних груп.
61
