
Органічна хімія, том 1 - Черних В
..pdf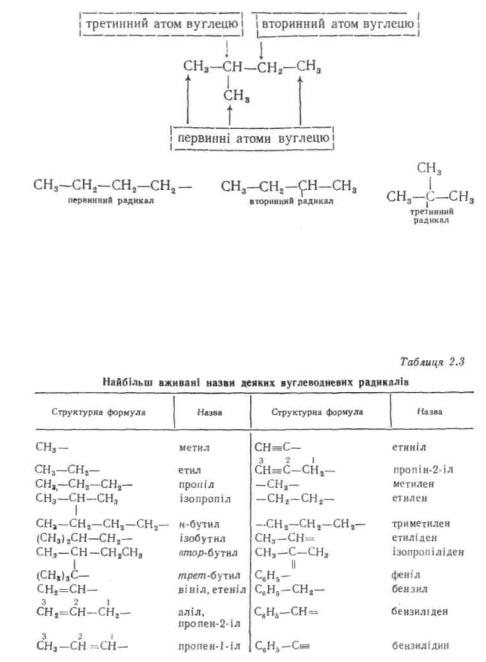
називається атом вуглецю, безпосередньо зв'язаний тільки з одним атомом вуглецю, вторинним —з двома, третинним — з трьома:
У табл. 2.3 наведені структурні формули і назви деяких вуглеводневих радикалів.
Визначивши родоначальну структуру, нумерують її атоми таким чином, щоб старша група дістала, по можливості, менший номер. Якщо сполука не має старшої групи, перевагу при нумерації (можливо менші номери) надають положенням кратних зв'язків, а при їх відсутності — замісникам.
22
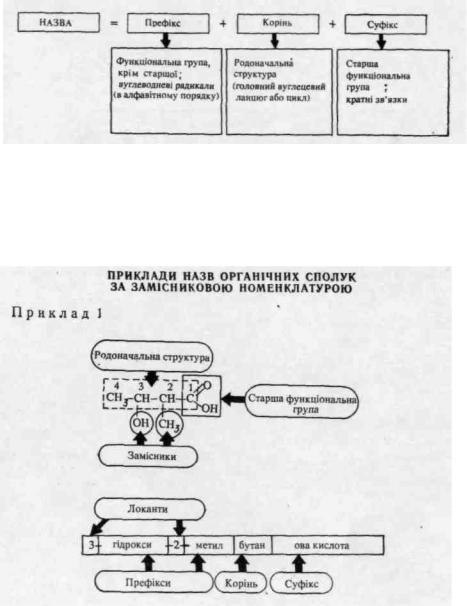
Нарешті, складають назву сполуки в цілому, дотримуючись такої послідовності: спочатку вказують в алфавітному порядку функціональні групи, окрім старшої, та вуглеводневі радикали (префікс), потім —назву родоначальної структури (корінь), у кінці — кратні зв'язки і старшу функціональну групу (суфікс):
Подвійний зв'язок у назві позначається суфіксом -єн, потрійний
—ін. Положення замісників і кратних зв'язків вказують цифрами або буквами (локанти), які розташовують перед префіксом і після суфіксу. При наявності у молекулі неоднакових замісників або кратних зв'язків· для їх означення використовують множні префікси: ди- (два), три- (три), тетра- (чотири), пента- (п'ять) і т. д.
23
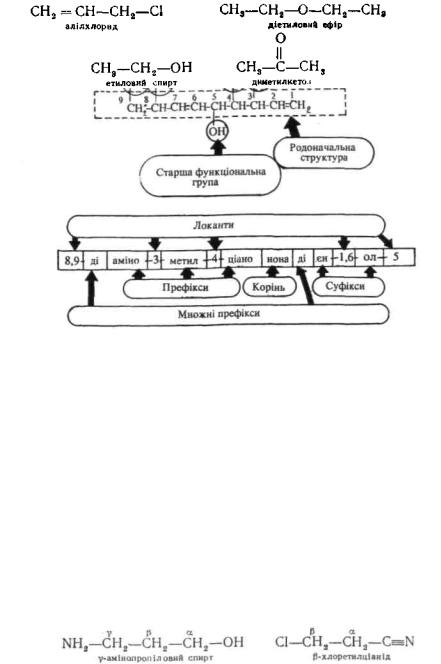
Радикало-функціональна номенклатура. Для деяких органічних сполук номенклатура ІЮПАК, поряд із замісниковою, передбачає радикало-функціональний варіант утворення назв. В основі цих назв лежить назва функціонального класу (спирт, ефір, кетон і ін.), якому передують назви вуглеводневих радикалів, наприклад:
Якщо сполука містить декілька функціональних груп, то аналогічно замісниковій номенклатурі старша з них визначає належність до класу, який кладуть в основу назви, решту вказують у префіксах. Для визначення родоначальної структури частіше застосовують тривіальні назви. Як локанти у радикало-функціональ-ній номенклатурі звичайно використовують літери грецького алфавіту α, β, γ, δ і τ. д., причому літерою а означають перший атом вуглецю від старшої групи, β — другий, у — третій і т. д.:
Розглянуті у цій главі основні принципи номенклатури органічних сполук є лише коротким поясненням до численних назв
24
і номенклатурних правил, викладених у наступних розділах підручника, присвячених конкретним класам сполук.
КОНТРОЛЬНІ ПИТАННЯ І ВПРАВИ
1. Як класифікують органічні речовини?
Вкажіть, які з наведених нижче речовин належать до аліфатичних, які — до карбоциклічних, а які — до гетероциклічних:
У формулах сполук а—и визначте: головний вуглецевий ланцюг; родоначальну структуру; старшу функціональну групу; кратний вуглець-вуглецевий зв'язок; групи, які позначаються у назві сполуки як замісники.
2. Що таке класи органічних сполук? Чи всі класи органічних сполук є функціональними?
Виберіть серед наведених у вправі 1 формули, які належать до сполук; а) насичених; б) ненасичених; в) аліциклічних; г) ароматичних; д) альдегідів; є) амінів; є) галогенопохідних; яе) кетонів; з) карбонових кислот; и) нітросполук; і) спиртів, фенолів; ї) вуглеводнів.
25
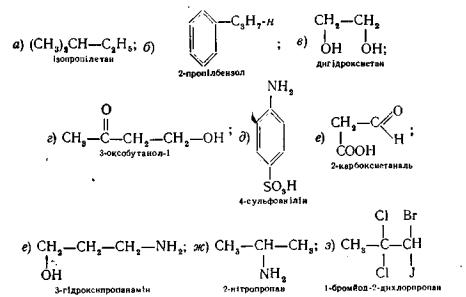
Вкажіть у формулах сполук 1 а—и первинні, вторинні, третинні та четвертинні атоми вуглецю.
3. Дайте визначення поняттю функціональна група. До сполук а—и, формули яких наведені у вправі І, прикладіть класифікацію органічних речовин за кількістю і однорідністю функціональних груп.
Виділіть в показаних формулах радикали: метил, етил, етилен, ізопропіл, н-бутил, ізобутил, βτορ-бутил, трег-бутил, циклопентил, бензил, феніл та вініл.
4. Що таке гомологічний ряд і гомологічна різниця?
Наведіть структурні формули і хімічні назви найпростіших представників гомологічних рядів, до яких належать сполуки, позначені у вправі 1 літерами а, б, є—з.
5. Які номенклатурні системи склалися в процесі розвитку органічної хімії?
Напишіть структурні формули сполук за їх назвами та визначте, за якою номенклатурною системою ці назви утворені: а) бромистий аліл; б) хлорбензол; в) ізопропілйодид; г) метиловий спирт; д) винний спирт; є) бутанол-2; є) ізобутиловий спирт; ж) триме-тилнітрометан; з) анілін; и) метанамін; і) формальдегід; ї) про-паналь; к) оцтова кислота.
6. Сформулюйте основні правила утворення назв органічних речовин за замісниковою і радикало-функціональною номенкла турами ІЮПАК.
Поясніть, які помилки допущені у назвах таких сполук:
Наведіть вірні назви цих сполук за міжнародною номенклатурою.
28
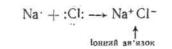
Глава О ХІМІЧНИЙ ЗВ'ЯЗОК
Вивчення органічної хімії значно спростилось завдяки розвитку теорії хімічного зв'язку. На підставі існуючих уявлень про природу хімічного зв'язку та електронної структури молекул стало можливим пояснити реакційну здатність органічних сполук, зрозуміти та запам'ятати фактичний матеріал хімії.
3.1. ТИПИ ХІМІЧНИХ ЗВ'ЯЗКІВ
У 1916 р. німецький вчений В. Коссель та американський вчений Дж. H. Льюїс запропонували теорію хімічного зв'язку, яка виявилась важливим етапом у розвитку теорії будови. Згідно з електронною теорією, хімічний зв'язок розглядається як результат взаємодії зовнішніх електронних оболонок (валентні електрони) атомів. Враховуючи хімічну інертність благородних газів, їх зовнішні електронні оболонки (для гелію—двоелектронна, для неону, аргону і т. п.— восьмиелектронна) вважають найбільш стійкими до взаємодії. Прагнення атомів інших електронів зв'язуватись один з другим зумовлене нестійкістю їх валентних оболонок. Тому кожен атом, утворюючи хімічний зв'язок, приймає, віддає або усуспільнює валентні електрони таким чином, щоб його зовнішня електронна оболонка відповідала конфігурації інертних газів. Такий принцип заповнення валентних оболонок дістав назву «октет-не правило».
У залежності від способу утворення розрізняють два основних типи хімічного зв'язку: іонний та ковалентний.
Іонний зв'язок утворюється між атомами, які значно відрізняються за електронегативністю. Електронна конфігурація інертного газу досягається у даному випадку шляхом переносу електрону до більш електронегативного атому. У результаті утворюються протилежно заряджені іони, які електростатично взаємно притягаються. Тому іонний зв'язок називають ще електровалентним:
У наведеному прикладі іон натрію має електронну конфігурацію неону, а іон хлору — конфігурацію аргону.
Сполуки з іонним зв'язком мають високі температури плавлення, добре розчиняються у полярних розчинниках, у водних розчинах дисоціюють на іони. їх розчини і розплави проводять електричний струм.
27

Ковалентний зв'язок є основним типом хімічного зв'язку в органічних сполуках. Він утворюється між атомами, рівними або близькими за електронегативністю. Електронна конфігурація інертного газу в даному випадку досягається за рахунок усуспільнених валентних електронів і формування однієї або декількох спільних електронних пар:
У результаті усуспільнення валентних електронів вуглецю і водню утворюються чотири електронні пари, які є спільними для даних атомів. Вуглецевий атом при цьому набуває конфігурації неону, а атом водню — конфігурації гелію. Кожна з усуспільнених пар електронів складає ковалентний зв'язок, котрий позначається у вигляді валентного штриху (—).
При утворенні ковалентного зв'язку між атомами з однаковою електронегативністю спільна електронна пара розташовується симетрично по відношенню до центрів обох атомів. Такий зв'язок називається ковалентним неполярним:
Якщо в утворенні ковалентного зв'язку беруть участь атоми з різною електронегативністю, то спільна пара електронів зміщується до атома з більшою електронегативністю. У цьому випадку зв'язок називається ковалентним полярним:
Полярний ковалентний зв'язок зображають у вигляді стрілки (->-), спрямованої до електронегативного атому. Буквою б (грец. «дельта») умовно позначають дробні (часткові) заряди на атомах. Символ 6+ відображає понижену, а δ-— підвищену електронну густину.
У залежності від числа спільних електронних пар, виникаючих між атомами пр,и утворенні зв'язку, розрізняють прості і кратні
28
ковалентні зв'язки. Прості представлені ОДНОІС, кратні — двома або трьома парами електронів:
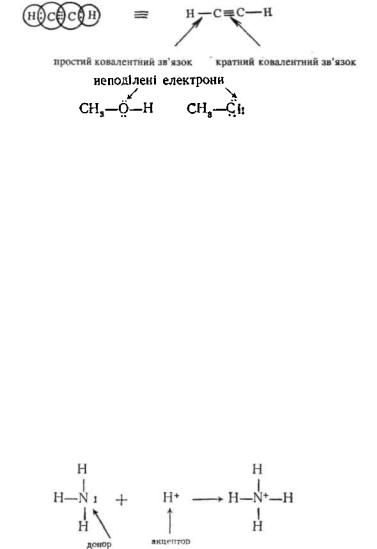
Атоми азоту, кисню, сірки, галогенів та деяких інших елементів при утворенні ковалентних зв'язків формують октетну оболонку усуспільненням не всіх зовнішніх електронів. Частина електронів не бере участь в утворенні хімічних зв'язків. Ці електрони називають неусуспільненимн, неподіленими або п-електронами:
Донорно-акцепторний зв'язок являє собою різновидність ковалентного зв'язку і відрізняється від останнього тільки способом утворення. Якщо ковалентний зв'язок утворюється шляхом усуспільнення пари електронів, по одному від кожного атома, то до- норно-акцепторний— за рахунок двох електронів, які надає один з атомів. При цьому атом, що надає пару електронів у спільне користування, називають донором, а атом, приймаючий електрони,— акцептором. Донор повинен мати пару неподілених електронів. Акцептором може бути протон або інший атом, в якого не вистачає до утворення октету двох електронів.
За донорно-акцепторним механізмом, наприклад, відбувається утворення іона амонію NH^":
Оскільки пара електронів азоту пішла на утворення зв'язку з протоном і стала спільною для обох атомів, азот набуває позитивного заряду. Утворений в іоні амонію за донорно-акцепторним механізмом ковалентний зв'язок нічим не відрізняється від трьох інших зв'язків.
Донорно-акцепторний зв'язок називають ще координаційним, при його утворенні відбувається процес координації неподіленої електронної пари.
29
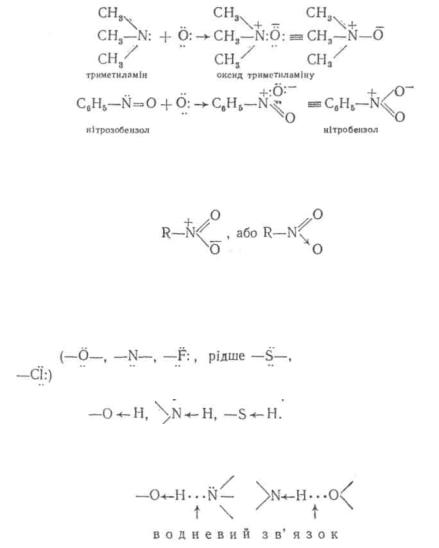
Окремим випадком донорно-акцепторного зв'язку є семіполяр- ний зв'язок. Він утворюється при взаємодії атомів, що мають неподілені електронні пари (донори) з електронейтральними частинками, які містять секстет електронів (акцептори). Внаслідок утворення координаційного зв'язку атом-донор набуває позитивного заряду, а атом-акцептор — негативного. У результаті ці два атоми виявляються зв'язаними двояко: ковалентним зв'язком і іонним. Нижче наведені приклади утворення семіполярного зв'язку у молекулах оксиду триметиламіну і нітробензолу:
Незважаючи на те, що у семіполярних зв'язках поряд з ковалентним зв'язком є і іонна взаємодія, сполуки, побудовані за цим типом, не проводять електричного струму.
Семіполяриий зв'язокприйнятопозначатитакимчином:
До донорно-акцепторного типу відносяться зв'язки у комплексних сполуках.
Водневий зв'язок утворюється в результаті електростатичної взаємодіїміжактивнимиатомамиводнювмолекуліі атомами з не-
поділеною електронною парою
у ній же або в іншій молекулі. Активними називають атоми водню, зв'язані в молекулі сильно поляоним
ковалентнимзв'язком, наприклад Графічно водневий зв'язок позначають трьома крапками:
Енергія водневого зв'язку (10—40 кДж/моль) у порівнянні з енергією ковалентного зв'язку (340—1360 кДж/моль) невелика.
Розрізняють внутрішньомолекулярні і міжмолекулярні водневі зв'язки. Внутрішньомолекулярні водневі зв'язки (ВВЗ) виника-
30
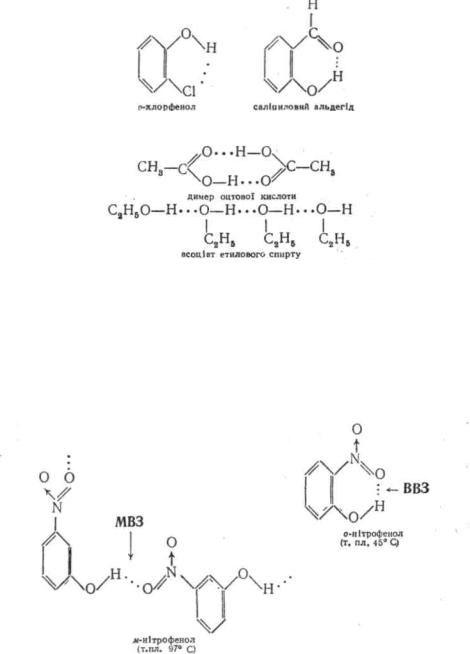
ють у межах однієї молекули з утворенням п'яти-, шестиабо семичленних хелатоподібних структур (від лат. chela — клішня):
Міжмолекулярні водневі зв'язки (МВЗ) виникають між двома або декількома молекулами з утворенням димерів або асоціатів:
Наявність водневих зв'язків впливає на фізичні (температура кипіння і плавлення, розчинність, в'язкість, спектральні характеристики) і хімічні властивості органічних сполук. Міжмолекулярний водневий зв'язок сприяє підвищенню температури кипіння, а часто і температури плавлення речовини. Так, за рахунок утворення асоціатів температура кипіння етилового спирту СгН5ОН (78 °С) значно вища, ніж диметилового ефіру CH3—O—CH3 (—24 °С), що має однакову з ним молекулярну масу, але не здатний утворювати водневий зв'язок. Аналогічно вища температура ле/па-нітрофенолу (97 °С) і ηαρα-пітрофенолу (114 °С) у порівнянні з ор/ло-нітрофенолом (45 0C) пояснюєтьсяутвореннямміжмолекулярноговодневогозв'язку;
Утворення водневого зв'язку між розчиненою речовиною і розчинником(якщоцеможливо) значнозбільшуєрозчинністьречовини.
31
