
Геохімія
.pdf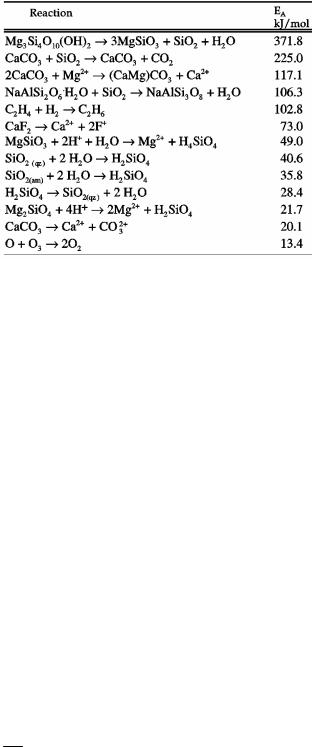
171
Перед-експонентний чинник (множник), часто вважають незалежним від температури, однак порівняння рівнянь 5.24 і 5.23 демонструє що це не так. При елементарних реакціях газових фаз ми повинні передбачати наявність залежності від T. Інші види реакцій мають свої види залежності частотного фактора від температури. Більш точний виразом залежності швидкості реакції від температури є:
k A T n e Eb/(kT) |
5.25 |
де ступінь n може бути будь-яким числом. Однак, оскільки залежність частотного фактора від температури звичайно мала, нею часто нехтують, як в нашому прикладі вище.
Таблиця 5.1 – Величини енергії активації деяких геохімічних реакцій.
*Ця форма залежності швидкості реакції від температури спершу була запропонована Jacobus H. Van't Hoff (18521911), який зробив цей висновок аналогічно до рівняння
3.108, рівняння Van't Hoff. Van't Hoff народився в Rotterdam і
в 1878 був призначений професором геології, мінералогії, і хімії в Університеті Амстердама. У 1896 він перебрався до Університету Берліна, де залишився до кінця життя. Він отримав Нобелівську премію з хімії в 1901.
**Названа в честь Arrhenius (1859-1827), через те, що Arrhenius теоретично обгрунтував припущення Van't Hoff's.
Дисертація Arrhenius's PhD, виконана у 1884 в Університеті Uppsala в Швеції, була комітетом екзаменаторів номінована на четвертий клас, тобто відкриттів не очікувалось. Старі професори напевно були дуже здивовані через дев'ятнадцять років, коли Arrhenius отримав нобелівську премію з хімії. Серед інших досягнень Arrhenius's слід назвати: теорію іонних розчинів електроліту, теорію потепління клімату (концентрація CO2 в атмосфері є важливим контролюючим чинником планетарної температури, і, антропогенне спалювання викопного палива може призвести до всесвітнього потепління).
***********
В загальному випадку (рівняння 5.8) швидкість реакції можна виразити через постійнушвидкості і активні концентрації всіх речовин (aA, aB, aC, aD) що беруть участь в реакції:
Y k anA anB anC |
anD |
5.26 |
A B C |
D |
|
де nA, nB, nC, nD – є порядковими числами реакції (order of the reaction), які в загальному випадку визначають експериментально.
Якщо реакція є елементарною (по суті це ще один критерій елементарності реакції) то концентрація продуктів реакції не впливає на швидкість іnC=nD=0.
Якщо реакція має 2 шляхи реалізації, тобто A (1) B |
і A (2) B, то швидкість реакції |
|||
визначається за формулою: |
5.35 |
|
||
Y dA (k1 k2 ) [A] |
|
|||
***** |
|
|
|
|
|
|
|
|
|
|
dt |
|
|
|
якщо k1>>k2, то
dA k1 [A] dt
171
172
****
Якщо наша реакція є рівноважною, то A<=>B:
Y |
d[A] |
k ([A]s [A]) |
5.36 |
|
|
||
|
dt |
|
|
де [A]s є рівноважною (стабільною) концентрацією речовини A (якщо [A]s=[A] то швидкість реакції дорівнює 0). Звідси
Y |
d[A] |
|
k C e kT |
5.37 |
|
|
|
||||
|
dt |
|
|
||
або |
|
|
|
|
|
|
d[A] |
|
5.38 |
||
Y |
|
k [A] k |
[B] |
||
dt |
|
||||
якщо час наближається до безкінечності то |
|||||
k [A] k [B] |
5.41 |
||||
Виходячи з рівностей швидкості утворення-розкладення в реакції маємо:
k |
|
[A]eqv |
K |
app |
5.43 |
k |
[B]eqv |
|
|
||
|
|
|
|
Де Kapp є константою рівноваги (?) реакції, звідки ми вже маємо вихід на термодинамічні рівняння. Наприклад, при серпентинізації олівіну:
2Mg2SiO4+H2O+2H+ <=>Mg3Si2O5 (ОH)4+Mg2+
маємо
K |
app |
[Mg2 |
] |
|
|
k |
|
|
|
|
5.44 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
[H ]2 |
|
k |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
d[Mg2SiO4 ] |
|
|
|
|
d[Mg |
2 |
] |
|
|
5.45 |
||||||||
|
2 |
|
2k [Ol] [H ] |
|||||||||||||||
|
|
|
|
|
||||||||||||||
|
|
dt |
|
|
|
dt |
|
|
|
|
|
|
||||||
|
[Mg2 ] |
|
|
|
|
|
|
|
[Mg2 |
] |
||||||||
2k' |
|
|
|
|
[Ol |
] [H |
|
|
] 2k' |
|
|
[Ol] |
||||||
|
|
|
|
|
|
[H ] |
|
|||||||||||
|
|
[H ]2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
*****
Зв’язок між ентальпією та енергією активації описується наступним чином: 1) Відомо що
lnK=-( H r/RT)+( S r/R)
тобто зміна константи рівноваги при зміні температури дорівнює
lnK/ T=-( H r/RT2)
інтегруючи, отримуємо
lnK=-( H r/RT)+K 5.46
де K – постійна інтегрування. Звідси температурна залежність константи рівноваги може бути описана як:
172
173
ΔHr/(RT) 5.47
K K e
Пам’ятаючи про залежність константи рівноваги від постійних швидкостей прямої та зворотної реакції і використовуючи рівняння Арреніуса, отримуємо:
|
k |
|
A e E /(RT) |
ΔHr/(RT) |
5.48 |
||
|
|
|
|||||
|
|
|
|
|
K K e |
|
|
|
k |
E |
/(RT) |
|
|
||
|
|
|
A e |
|
|
|
|
звідси |
|
|
|
|
|||
|
|
|
|
A+/A-=K =lnK = e S r/R |
5.49, |
||
|
|
|
|
|
E+-E-= H |
|
5.50 |
A+=(k T)/h e S*+/R 5.52
S*+ - різниця ентропій початкового і активованого стану, h – постійна Планка, (k T)/h – основна частота.
****
Приклад 5.5: Оцінка швидкостей оборотних метаморфічних реакцій
Розглянемо реакцію: Ca2Mg5Si8O22(OH)+11CaMg(CO3)2=8Mg2SiO4+13CaCO3+9CO2+H2O
Tremolite+11Dolomite=8Forsterite+13Calcite+9CO2+H2O
Дано: T=625°C, Sr=1,140 kJ/K, EA=579 kJ, A=1.54*1027 с-1 (Heinrich, та інші. 1989), перевищення рівноважної температури 5°C, кристали доломіту є кубічними, тобто, VDo= (SDo)3/2, де VDo і SDo є, відповідно, об’ємом і зовнішньою поверхнею доломіту. Припустімо далі, що вихідна порода містить тільки тремоліт і доломіт, а також що швидкість реакції можна виразити у вигляді заданому рівнянням 5.76, тобто:
Y |
dVDo /VDo0 |
k(1 e |
G / RT |
) |
SDo |
5.71 |
dt |
|
SDo0 |
|
|||
|
|
|
|
|
де VDo0 і SDo0 є початковими об’ємом і зовнішньою поверхнею доломіту, відповідно, а k є постійною швидкості із звичайною залежністю Arrhenius від температури (знак мінус позначає витрачання доломіту в процесі реакції). Необхідно оцінити перетворення доломіту з плином часу.
Вирішення: Щоб вирішити цю проблему, нам потрібно інтегрувати рівняння 5.71. Спершу, ми робимо заміну SDo/SDo 0 = (V/VDo 0)2/3 і переписуємо. Після інтегрування отримуємо:
|
VDo |
|
[1 |
A |
e EA/RT (1 eΔG/RT)t]3 |
|
|||
|
VDo0 |
|
|
|
|||||
|
3 |
|
|
|
|||||
Використовуючи - T* S= G, (де T є величина (крок) зміни температури за рівнянням 5.68), ми |
|||||||||
маємо: |
|
|
|
|
|
|
|||
|
VDo |
|
[1 |
A |
e EA/RT (1 e ΔTΔS/RT)t]3 |
5.72 |
|||
|
VDo0 |
|
|
||||||
|
3 |
|
|
|
|||||
173

174
Результат показаний на Рис 5.9. За геологічними масштабами часу ця реакція є, вочевидь, дуже швидкою, завершуючись фактично за півроку (1.5*107 с), навіть з відносно малим перевищенням температури - 5°C. Ми також бачимо прогресуюче зменшення швидкості реакції, що обумовлено зменшенням зовнішньої поверхні доломіту. При цьому температурні умови обрані нами для задачі є не надто реалістичними - більш правдоподібним було б припущення про постійне зростання температури (поруч з інтрузією, наприклад).
Рис.5.9. Відносне зменшення об’єму доломіту, як функція часу (за рівнянням 5.72) при 625°C
***
Характер (механізм), швидкість і тривалість є надзвичайно важливими параметрами не лише хімічних реакцій, а й різноманітних процесів переносу речовини в діапазоні від окремих атомів (дифузія) до мегатонних обсягів (утворення батолітів). У дуже великій кількості випадків саме ці параметри визначають якісний та кількісний склад продуктів процесу. Наприклад:
А. При генерації магми ключовими чинниками є:
1)природа і склад вихідної речовини;
2)швидкість і ступінь розплавлення;
3)швидкість і повнота розділення рідини і твердих фаз при плавленні;
4)фізико-хімічні умови плавлення;
Б. При рухові і накопиченні магми ключовими чинниками є:
1)взаємодія магми з навколишніми породами;
2)кристалізаційне фракціонування чи сепарація при плавленні;
3)змішування різних магм;
4)накопичення в резервуарі;
В. Ключовими чинниками при кристалізації магми є:
1)фізико-хімічні умови кристалізації магми;
2)швидкості охолодження і кристалізації;
3)ступінь фракціонування при кристалізації;
4)відкритість системи;
На всіх цих стадіях формування магми (та й пізніше, при подальшому існуванні речовини в твердому стані) для прогнозу змін складу системи слід враховувати вплив дифузії, адсорбції, зародкоутворення, процесів росту та розчинення кристалів, перетворень в твердих фазах тощо, тобто таких явищ які визначають кінетику геологічних процесів.
***
5.4 Дифузія
Ми не можемо "перемішувати" речовину при геохімічних реакціях, однак природа часто забезпечує адвекцію (advection) для переміщення компонентів. Рушійними силами адвекції у природі є гравітаційні: рідини (включно з мантію, яка в геологічних масштабах часу поводить себе як рідина) пересуваються знизу вгору або зверху донизу (через те, що вони або легші або важчі,
ніж їх оточення). Оскільки при адвекції транспортуються реагенти то, відповідно, завдяки цьому процесу зростають швидкості реакцій. Однак для дуже малих мас адвекція рідко буває ефективною, тут звичайним процесом що відповідає за переміщення хімічних компонентів є дифузія. Щоправда, крім випадку газів важко уявити собі дифузійні процеси які мають розмах більш як кілька метрів (та й то в рідкісних випадках). Тому в хімічних процесах наявні як адвекція
(транспортування на великі відстані) так і дифузія (локальний перерозподіл речовини). Оскільки
174

175
адвекція залежить переважно від фізичних властивостей речовин (густина, в’язкість), в даному
випадку ми її не розглядатимемо.
Дифузія ж хімічних елементів є чинником що контролює (може контролювати) перебіг багатьох
геологічних процесів.
В твердому тілі за локалізацією в просторі виділяються наступні типи дифузії (які, тією чи іншою
мірою, контролюють процеси зміни порід та встановлення рівноваги між мінералами):
1)поверхнева дифузія (по поверхні);
2)міжзернова дифузія (по границям зерен);
3)об’ємна дифузія (через речовину мінеральних зерен).
Від швидкості дифузії в магмі (розплаві) певною мірою залежать швидкості росту кристалів. Будь
який з перелічених процесів важко моделювати не визначивши тип та швидкість дифузії.
Закони Фіка
Named for Adolf Fick (1829-1901). Fick was born in Kassel, Germany and earned an MD from the University
of Marburg in 1851. Fisk’s interest in diffusion through cell membranes led him to formulate the laws that bear
his name. It was actually the second law that was published first, in an 1855 paper titled Über Diffusion. Fick
deduced it by analogy to Fourier’s equation for thermal diffusion.
Закони названі на честь Adolf Fick (1829-1901). Fick народився в Касселі (Німеччина) і отримав ступінь магістра в Марбургському університеті у 1851. Інтерес Fisk's до дифузії через мембранну сітку призвів до формулювання законів, які нині носять його ім’я. Фактично першим, у 1855 році, був опублікований 2-й закон. Fick вивів цей закон по аналогії з рівнянням Фур’є (Fourier's) коефіцієнта теплопровідності (термодифузії).
5.4.1 Дифузійний потік і закони Фіка
Згідно закону Фіка (Fick's), або інакше - першого закону Fick's, стаціонарний потік, J, якоїсь речовини через площину є пропорційним до градієнту концентрацій цієї речовини в напрямку перпендикулярному до площини.
Інше формулювання першого закону Fick's таке: існування градієнту концентрацій в розплаві або твердому тілі (яке є однорідним в інших відношеннях) в загальному випадку породжує потік відповідного елементу чи хімічної речовини в напрямку протилежному до градієнту.
|
c |
5.73 |
|
J D |
|
|
|
|
|
||
|
x t |
|
|
Jm= -Dm ( C/ x) S dt |
5.73a |
||
Знак (-) вказує що потік спрямований в напрямку протилежному до зростання концентрації (в напрямку до області нижчих концентрацій). Коефіцієнт пропорційності, D, є коефіцієнтом дифузії. Розмірність потоку J - одиниця маси на площу в одиницю часу, наприклад, моль/см2*с. Розмірність коефіцієнту дифузії (найчастіше м2/с або см2/с) в загальному випадку залежить від розмірності концентрації (наприклад, якщо концентрація виражена в одиницях об’єму, як роблять в кінетиці, коефіцієнт дифузії матиме розмірність см-1с-1). Коефіцієнт дифузії повинен бути визначений експериментальним шляхом і залежатиме від природи дифундуючої речовини, властивостей системи де відбувається дифузія і, як завжди, від температури. В загальному випадку коефіцієнт дифузії не є незалежним від градієнту концентрацій.
175

176
Якщо бути точним, рівняння 5.73 є справедливим якщо дифузія відбувається лише в одному напрямку. Більш загальним виразом першого закону Fick's, який є чинним у тривимірному просторі є:
J DVC |
|
|
5.73а |
||||||
|
|
|
|||||||
де |
|
|
|
|
|
|
|
||
V |
C |
|
c |
|
c |
|
c |
|
|
x |
y |
z |
|||||||
|
|
|
|
||||||
Якщо концентраційний градієнт є однонаправленим (як це буде, наприклад, у випадку, осадконакопичення), то рівняння 5.73а може бути зведене до рівняння 5.73 просто за допомогою вибору відповідного вибору напрямку x.
Рівняння 5.73 описує стаціонарний потік, що на практиці спостерігається не так часто позаяк градієнт концентрації змінюється з плином часу і, відповідно, змінюється потік речовини.
Рисунок 5.10. Три можливих градієнти концентрації.
a.2c/ x2=0 і, таким чином, c/ t=0. Для постійного градієнту концентрація в будьякий момент залишається постійною. Це випадок стабілізованого (стаціонарного) потоку.
b.2c/ x2>0. Концентрація в будь-якій точці момент зростає з часом.
c.2c/ x2<0. Концентрація в будь-якій точці з часом зменшується. І випадок b і випадок c змінюватимуться, щоб з часом перейти до випадку a.
Зміна концентрації в будь-який момент часу визначається при використанні Другого закону Фіка:
|
|
|
|
D |
c |
5.74 |
||
|
c |
|
|
|
|
|
||
x |
|
|||||||
|
|
|
|
|||||
|
|
|
|
|
||||
|
|
|
|
|||||
t x x
t
увипадку коли коефіцієнт дифузії не залежить від концентрації вираз спрощується:
|
c |
|
|
2 |
c |
|
5.74а |
|
|
|
|
|
|||||
|
|
|
|
|
2 |
|
||
|
D |
x |
|
|
||||
|
t x |
|
|
t |
|
|||
Рівняння 5.74 вказує нам, що швидкість зміни концентрації з часом в любий момент пропорційна до другої похідної дифузійного потоку по профілю. Другий закон Fick's ілюстрований на рис 5.10.
Закони Фіка застосовуються в багатьох випадках, однак для того щоб коефіцієнт дифузії мав зміст необхідно знати тип дифузії який відповідатиме певному механізмові дифузії.
5.4.2 Дифузія в багатокомпонентних системах і коефіцієнти дифузії.
Є 2 важливі умови (нами раніше ігноровані) для дифузії. По-перше, дифузія відрізняється від інших видів переносу відсутністю транспортних “каналів”. Якщо є транспортні канали то ми швидше спостерігатимемо результати потоку речовини або адвенкції, а не результати дифузії. Якщо умова відсутності транспортних каналів задовольняється то рух однієї речовини через площину повинен супроводжуватись рухом іншої (інших) речовини в протилежному напрямку.
176

177
Другою умовою є баланс зарядів (електрична нейтральність дифузії). Дифузія навіть малих кількостей іонів швидко призведе до появи значного електричного потенціалу. Сила, яка пов’язана з потенціалом, буде протидіяти будь-якій подальшій дифузії в тому ж напрямку. Тому дифузія іонів повинна супроводжуватися дифузією рівної кількості заряду в протилежному напрямку. На додаток до цих умов ми маємо пам’ятати що дифузія в деяких випадках призведе до утворення неідеальних сумішей і певних (не надто малих) змін ентальпії і об’єму, які супроводжують подібні випадки.
Пам’ятаючи вказане ми можемо виділити 3 ситуаційні моделі і 3 види коефіцієнтів дифузії:
1) Коефіцієнт слідової (tracer) дифузії (або самодифузії), в якому перенесена маса і потік заряду, який пов’язаний з дифузіє достатньо малі і можуть бути безпечно проігноровані. Там можливо немає значного ухилу концентрації. Ця ситуація характерна для дифузії радіоактивних ізотопів, коли ми не спостерігаємо суттєвої зміни концентрацій і хімічного потенціалу. Ця ситуація є найпростішою, і саме її ми вивчали досі. Ряд дослідників (П.Хендерсон, 1982) виділяють окремо
коефіцієнт ізотопної дифузії і коефіцієнт власної дифузії хоча чисельно вони майже не відрізняються.
Коефіцієнт ізотопної дифузії застосовується тоді коли в системі існують виключно ізотопні градієнти (Fe55 в системі 55Fe2SiO4-56Fe2SiO4). Коефіцієнт власної дифузії застосовують при відсутності і хімічних і ізотопних градієнтів, тобто відсутності результуючого потоку маси через заданий перетин.
2) Коефіцієнт хімічної дифузії застосовується в неідеальних ситуаціях, де слід вивчати скоріше хімічний потенціал ніж концентрацію. В такому випадку, закони Фіка можуть бути переписані у вигляді:
|
|
|
|
|
|
2 |
|
|
5.90 |
|||
|
|
|
|
|||||||||
J D |
|
|
і |
|
|
D |
|
|
|
|
|
|
|
|
x |
2 |
|
||||||||
|
x t |
t x |
|
|
t |
|
||||||
3.) Коефіцієнт перехресної дифузії (interdiffusion) застосовується в тих ситуаціях, у яких градієнт концентрації настільки великий, що дифузія, задля підтримання електричної нейтральності і постійного об’єму, повинна супроводжуватись дифузією інших речовин у протилежному напрямку. Тобто дифузія однієї речовини пов’язана з дифузією всіх інших речовин. Наприклад, при вивченні дифузії Mg в олівіні (приклад 5.6), слід розглядати також зустрічну дифузію Fe. Таким чином потік речовини i обчислюється як:
Ji= k=1n Di,k ( Ck/ x) |
5.91 |
де Di,k – коефіцієнт перехресної дифузії (interdiffusion), який описує взаємодію речовин i і k. Коефіцієнт перехресної дифузії пов’язаний з коефіцієнтом слідової дифузії як:
Di,k = (ni Di+nk Dk)/ (ni +nk) |
5.91 |
де ni – мольна частка речовини i, а Di є коефіцієнтом слідової дифузії для речовини i. Експеримент Watson (1982) показав хороший приклад сфери застосування коефіцієнтів перехресної дифузії. В цьому досліді кварцова сфера було розчинено в розтопленому базальті. Всі елементи (крім SiO2) дифундували з базальту в кварцову рідину. На рис 5.16 показані зміна концентрацій, яка ілюструє дифузію Na і K в напрямку до вищих концентрацій.
Повним рівнянням для потоку дифузії в системі є: J =DC, де J є вектором потоку, D - матрицею коефіцієнтів перехресної дифузії, а C є вектором градієнту концентрації. Слід пам’ятати що потік речовини i залежить від градієнтів концентрації всіх речовин.
Приклад 5.8. Коефіцієнти перехресної дифузії
177

178
Підрахуйте дифузійний потік для Mn в гранаті, який задається наведеною нижче матрицею інтердифузії, за умови що градієнти концентрації рівні: 0,023 моль/см, -0,009 моль/см і –0,015 моль/см для Mn2+, Mg2+, і Fe2+, відповідно.
Матриця коефіцієнтів дифузії для гранату (за Demspter, 1975)
|
Mn |
Mg |
Fe |
Mn |
8,38*10-20 |
-9,91*10-20 |
-4,68*10-21 |
Mg |
-2,78*10-20 |
7,26*10-21 |
-8,81*10-23 |
Fe |
-7,16*10-20 |
-4,81*10-23 |
1,19*10-20 |
Відповідь: ми підраховуємо дифузійний потік для Mn, використовуючи рівняння 5.107. Ми знаходимо, що JMn=3*10-21 моль/(см2*сек).
Хоча дифузія в різних умовах є різною, важливо пам’ятати, що мікромеханізм є завжди однаковим: він породжений випадковим рухом атомів або молекул. Часом вживані терміни “сили дифузії”, “дифузійний потенціал” є зручними для з’ясування ключових чинників, однак в дійсності не існують.
Для доведення цієї тези ми можемо отримати перший закон Fick's виключно за результатами розгляду випадкового руху атомів. Розгляньте дві сусідні структурні площини в кристалі, розташовані на відстані dx одна від одної. Кількість атомів в першій площині дорівнює n1, а в другій - n2. Ми допускаємо, що атоми можуть змінити позицію випадково за допомогою переходу до сусідньої площини і, що це відбувається з середньою частотою (тобто, 1 стрибок на відстань dx кожні 1/ секунд). Ми допускаємо що немає дії зовнішніх сил, і стрибок в будь-якому напрямку має рівну ймовірність. У першій площині буде *n1/6 атомів, які стрибають до другої площини (ділимо на 6, тому що є 6 напрямів можливого стрибка: вгору, вниз, назад, вперед, направо, наліво). У другій площині буде *n2/6 атомів, які стрибають до першої площини. Результуючий потік речовини від першої площини до другої рівний:
J= ( *n1/6- *n2/6)/dx2=( /6)*(n1-n2) /dx2 5.93
Концентрація, c, є кількістю атомів в одиниці об’єму, тобто, n/dx3, так що ми можемо замінити кількість атомів на добуток cdx3:
J= ( /6)*(с1-с2)dx |
5.93а |
Знаючи що градієнт концентрації дорівнює (c2-c1)/dx, а dc=-(c1-c2), маємо: |
|
J= - ( *dx2/6)*dc/dx |
5.93б |
Якщо ми прирівняємо D= *dx2/6, то отримаємо перший закон Фіка: J= -D*dc/dx
Тобто D пов’язаний з частотою стрибків, , і квадратом відстані стрибка (dx).
Ми бачимо, що дифузійний переніс існує завдяки не наявності сил а тому що в одній точці більше атомів ніж в сусідній. За відсутності градієнту стрибки теж відбуватимуться, але ми цього не помітимо. оскільки не зможемо відрізнити один атом від іншого. Інші фактори, такі як електростатичний тиск, або градієнти концентрацій інших речовин можуть зробити стрибок в одному напрямку більш імовірним, ніж в інших, так само як це відбувається за наявності відмінностей в хімічному потенціалі між двома площинами.
Рис. 5.16. - Електрон microprobe перетинає через прикордонні шари танучого в контакті з сферами кварцу поступово зникнення. Кварц є вліво в нульових мікронах. Зверніть увагу, що K2O і Na2O розповсюджують ‘uphill', тобто, в напрямку до вищих концентрацій K2O і Na2O в SiO2-багатій рідині. Від Watson (1982).
5.4.1.1 Вирішення Другого Закону Fick 's
178

179
Єдиного вирішення (тобто, функції яка б виражала c(t,x)) для рівняння 5.74 немає, однак є багато часткових вирішень залежних від граничних умов. Давайте розглянемо деякі найпростіші з них. У всіх випадках, ми допускаємо, що система є однорідною в напрямках y і z, отож дифузія відбувається лише в напрямку x.
Як перший випадок, розглянемо тонку плівку деякої дифундуючої речовини яка затиснута між шарами безмежної довжини з концентрацією речовини c=0. В природі такий випадок може відповідати тонкому, збагаченому якимось елементом (як, наприклад, збагачені іридієм численні шари на межі крейда-палеоген - Cretaceous-Tertiary). Дифузія викличе з плином часу міграцію речовини на відстань далеку від x=0. Математично, ця ситуація накладає певні граничні умови на рівняння 5.74. Ми визначаємо місце збагаченого горизонту як x=0, і шукаємо вирішення 5.74 з такими початковими умовами що в t=0 c=0 всюди крім x=0. В який-небудь t>0, наша функція повинна мати властивість до зменшення c в початковій точці і наближення концентрацій до 0 на безкінечній відстані. Ми також постулюємо, що загальна маса речовини яка мігрує залишається постійною, тобто:
M= c*dx; де M є загальна масою субстанції в циліндрі з поперечним перетином рівним одиниці і довжиною x. Вирішення отримане Crank (1975):
|
M |
|
x2 |
5.75 |
|
|
|
||
c(x,t) |
e 4 D t |
|
||
2(π D t)0,5 |
|
|||
|
|
|
|
|
На рис. 5.11 показано як за таких умов змінюється з часом концентрація.
Якщо ж ми припустимо, що поширення відбувається виключно в позитивному напрямку то, в цьому випадку поширення в негативному напрямку є начебто відбитим від площини x=0. І тоді вирішення отримується за допомогою сумування результатів в двох напрямках:
|
M |
|
|
x |
2 |
5.76 |
|
|
|
|
|
||
c(x,t) |
|
e |
4 D t |
|
||
(π D t) |
0,5 |
|
||||
|
|
|
|
|
|
|
Саме цей вираз використовується при експериментальному визначенні коефіцієнтів дифузії в силікатах.
Далі розглянемо ситуацію коли речовина що дифундує має початкову витриману (постійну) концентрацію C=C0 в обсязі від x=0 до x=+ , в просторі ж від x=0 до x=- C=0. Така ситуація певною мірою відповідає контакту двох мінералів, контакту морської і річкової оди за відсутності змішування тощо.
Рис. 5.11. Зміна з часом параметрів концентрації при дифузії від безкінечно тонкого шару. Зверніть увагу, що площа області під кривою залишається постійною.
Вирішення для цього випадку може бути знайдене якщо об’єм з C=C0 уявити у вигляді безкінечного набору тонких плівок товщиною d (див Рис. 5.12). Концентрація дифундуючої речовини в точці xp в момент часу t визначається сумарним ефектом всіх цих уявних плівок (Crank, 1975).
Математичне вирішення отримується при інтегруванні:
179

|
C0 |
|
|
e |
|
ξ2 |
|
|
|
|
4 D t dξ |
||||
|
|
|
|||||
c(x,t) |
|
x |
|
||||
2 (π D t) |
0,5 |
|
|||||
|
|
|
|
|
|
|
|
приймаючи ж = /2 Dt, маємо:
|
|
|
C0 |
|
2 |
|
|
|
|
|
|||
c(x,t) |
x/2 |
|
e η |
dη |
|
|
|
|
|||||
0,5 |
|
|
|
|
|||||||||
Dt |
|
|
|
|
|||||||||
|
|
|
π |
|
|
|
|
|
|
|
|
|
|
Інтеграл 5.78 можна записати, як: |
|
|
|
||||||||||
|
Dt e η |
2 |
dη 0 e η |
2 |
|
|
e η |
2 |
|||||
x/2 |
|
Dt |
|||||||||||
|
dη 0 |
dη |
|||||||||||
|
|
|
|
|
|
|
|
|
|
x/2 |
|
|
|
180
5.77
5.78
5.79
Цей інтеграл відповідає формі стандартної математичної функції яку називають функцією помилок (error function), яка визначається, як:
|
2 |
|
e η |
2 |
5.80 |
erf(x) |
0 |
|
dη |
||
0,5 |
|
||||
|
π |
|
|
|
|
Підставляючи 5.80 в 5.78 і приймаючи erf( ) = 1, маємо:
|
C |
0 |
|
|
x |
5.81 |
|||
c(x,t) |
|
{1 erf |
|
|
|
|
} |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
||||
2 |
|
2 |
|
|
|
|
|
||
|
|
Dt |
|
||||||
Значення функції помилок функції можуть бути знайдені в математичних таблицях. Функція помилок входить також до переліку вмонтованих функцій електронних таблиць, таких як Microsoft Excel ™*. Наближений поліномний розклад:
erf(x) {1-exp(-4x2/ )} |
5.82 |
На рис. 5.13 показано як параметри концентрації змінюються з перебігом часу. Якщо erf(0)=0, то C=C0/2 при x=0 в будь-який момент.
Рис. 5.12. Розподіл в напівпросторі може сприйматися як набір тонких плівок товщиною d . Концентрація дифундуючої речовини в точці xp в момент часу t визначається сумарним ефектом всіх цих уявних плівок від x до безкінечності (Crank, 1975).
Рис. 5.13. Розподіл дифундуючої речовини (на початку зосередженої в напівпросторі -<x<0) через певні часові проміжки після початку дифузії.
Подібний підхід може використовуватися для моделювання дифузії речовини з обмеженого об’єму, наприклад: C=C0 якщо h<x<+h. Цей випадок відповідає дифузії з шарів кінцевої потужності або зональних кристалів. (див. Приклад 5.6). Знов ж таки, шар розглядається як серія тонких плівок, але інтегрування в рівнянні здійснюється від -h до +h. В результаті маємо:
180
