
Геохімія
.pdf81
Породи видозмінювалися плутонізмом, метаморфізмом, метасоматизмом, вони були принаймні часто переплавлені і знаходилися у формі магм і лав, але колись у минулому вони утворилися з осадків”. З табл. 6.2 випливають важливі висновки:
1)земна кора складена в основному 8 елементами: O, Si, Al, Fe, Ca, Mg, Na, K;
2)на частку інших 84 елементів припадає менше 1 % маси земної кори;
3)серед найголовніших по поширеності елементів особлива роль у земній корі належить O.
Особлива роль O полягає в тому, що його атоми складають 47% маси земної кори і майже 90% об’єму найважливіших породоутворюючих мінералів.
Саме ця обставина дала Гольдшмідту можливість (і право) мав назвати земну кору оксисферою. Біосфера, яка в наші дні охопила всю гідросферу і верхню частину літосфери, завжди отримувала (залучала) практично необмежені ресурси O саме з цих, твердої і рідкої оксисфер Землі. Нижче буде показано, що, наприклад, киснева атмосфера, без якої немислиме високоорганізоване життя на Землі, по суті є похідною цих оксисфер.
Поширеність рідкісних і розсіяних елементів у земній корі визначалася багатьма дослідниками, в першу чергу Ф.У.Кларком, В.М.Гольдшмідтом, В.І.Вернадським, О.Е.Ферсманом, С.Р.Тейлором, О.П.Виноградовим, Л.Г.Аренсом, К.Г.Ведеполем.
Використовуючи новітні методи аналізу (нейтронно-активаційний, атомно-адсорбційний, люмінесцентний, електронного парамагнітного резонансу, мікрозондового аналізу тощо), із результатів численних точних аналізів мінералів, порід і їхніх сумішей, а також із зіставлення поширеності окремих пар елементів (наприклад, Rb : K, Hf : Zr, Re : Mo, Cd : Zn) вдалося визначити вміст в земній корі майже всіх елементів періодичної системи. Ці цифри за пропозицією Ферсмана одержали назву кларків на честь Ф.У.Кларка, який вперше, як уже говорилося, достатньо повно і точно оцінив хімічний склад земної кори.
На сьогодні найчастіше користуються кларками земної кори:
-за О.П.Виноградовим, який за середній склад земної кори взяв суміш, що складається з 2 ч. кислих порід і 1 ч. основних порід,
-за О.О.Беусом, який встановив кларки виходячи з співвідношення гранітного та базальтового шарів 1:2.
-за С.Р.Тейлором, який встановив кларки для континентальної кори виходячи із співвідношення 1:1 основних і кислих магматичних порід.
Вміст хімічних елементів у головних типах порід за Виноградовим наведено в табл. 6.3.
Впитаннях оцінки складу будь-яких типів порід і земної кори загалом окремо постає питання стандартів – необхідності приведення результатів аналізів різних лабораторій “до спільного знаменника”, без чого порівняння будь-яких даних є некоректним.
Вякості геохімічних стандартів спочатку були узяті граніт G-1 із містечка Уестерлі в штаті РодАйленд (північний схід США) і діабаз W-1 із містечка Сентервілл у штаті Віргінія (на сході США). Вміст рідкісних і розсіяних елементів у суміші цих порід (1:1) було визначено різноманітними методами в кращих лабораторіях світу. Зведення цих даних навів Тейлор [Taylor S. RД 1964]. Значення кларків для окремих елементів постійно уточнюються. Природно, що це позначається на значеннях поширеності всіх інших елементів, тому що їхня загальна сума завжди повинна бути дорівнює 100%. Загальна поширеність елементів у земній корі така, г/т:
0,001-0,01 Re, Os, lr, Ru, Rh, Ті, Pt, He, Au, Pd 0,01-0,1 Ar, Se, Ag, Hg
0,1-1,0 Cd, Bi, In, Tu, I, Sb, Lu
81
82
1,0-10,0 |
Eu, Dy, Ho, Er, Yb, Hf, Та, W, Tl, U, Ge, As, Br, Мо, Sn, Cs, Pr, Sm, Be |
10,0-100,0 |
Pb, Th, Y, Nb, La, Ce, Nd, Li, B, N, Sc,V,Cr, Co, Ni. Cu, Zn, Ga |
100,0-1000,0 |
C, F, P, S, Cl, Rb, Sr, Zr, Ba |
1000,0-10 000,0 |
Mn, Ti |
>10 000,0 |
O, Si, Al, Fe, Ca, Mg, Na, K |
Таблиця 6.3 - Поширеність елементів у гірських породах (мас. %) за О. П. Виноградовим
Аналіз поширення елементів за типами порід дає, зокрема, наступні групи:
а) елементи в основних і кислих породах поширені приблизно однаково - Ga, Ge, Se, Ті, Re, Sr, Nb, Cd, In, Hf;
б) в основних породах даного елемента більше, ніж у кислих - Сг, Sc, Ni, V, Co, Pt;
в) у кислих породах вміст елементу помітно вищий, ніж в основних - Li, Be, Rb, TR, Ва, Tl, Th, U, Та.
Дослідження двох найголовніших магм Землі (основних і кислих) показали, що в особливостях їх складу знайшло відображення відоме правило Оддо-Гаркінса: якщо не враховувати парний Si і непарний А1, які однаково важливі для обох магм, то виявиться, що для кислої магми переважно характерні непарні елементи, а для основної - парні. Кисла магма багата 1H, 3Li, 5B, 9F, 11Na, 17Cl,
19K, а основна - 12Mg, 20Ca, 22Ti, 24Cr, 26Fe, 28Ni [Ф.Ю.Левінсон-Лессінг, 1935 р.].
Емпіричне правило Оддо-Гаркінса (за іменами проф. Г.Оддо та проф. В.Гаркінса) проголошує що елементи, які мають парну атомну масу, суттєво переважають на Землі (і в земній корі) над непарними
В.І.Рехарський [1964] виявив цікаву закономірність: виявилося, що відношення вмісту елементу в
82
83
основних породах СО до вмісту елементу в кислих породах СК є однією з тих періодичних залежностей, які відображені в менделеєвській таблиці (фіг. 10.1 ?). Ці відношення («коефіцієнти концентрацій»), крім двох перших періодів, зменшуються зверху вниз, а в періодах - збільшуються зліва направо від І до VII групи, а потім зменшуються зліва вниз направо і збільшуються зліва нагору праворуч.
Як ми вже бачили, поширеність елементів у земній корі охоплює величезний діапазон значень. За їх вмістом всі елементи можна всі елементи розділити на декілька груп, і тоді виникає ряд несподіваних для наших повсякденних уявлень співвідношень. Наприклад, у земній корі Cu менше ніж Zr; Hg менше ніж TR; Pb менше ніж Ga; Ni у декілька разів менше ніж Rb; Sn у 30 разів менше ніж V, a Sc у 200 разів більше ніж Ag.
В. И. Вернадский назвав розсіяними ті елементи, що, знаходячись у земній корі в значних кількостях, не дають високих концентрацій. Так, наприклад, величезні маси Rb розсіяні в польових шпатах, Ga - в алюмінієвих мінералах, Re - у молібденітах, Cd - у сфалеритах, Ag - у галенітах, Sc - у силікатах, Li - у слюдах і т.д.
На відміну від розсіяних, рідкісні (кларк < 0,01 0,001%) елементи в земній корі знаходяться в значно меншій кількості, хоча й утворюють власні мінерали, які можуть концентруватися в рудні скупчення. Вернадський у зв'язку з цим увів поняття кларка концентрації елемента в мінералах і родовищах (як відношення вмісту у мінералі, родовищі до величини кларку). Так, кларк Mn у земній корі складає 0,1 %, а кларк концентрації Mn у родоніті - 400, у псиломелані - 500, у піролюзиті - 632.
Таким чином, доступність того або іншого елемента насамперед визначається його спроможністю досягати високих кларків концентрації, тобто утворювати мінерали, скупчення яких можуть бути економічно вигідними для використання родовища.
В.В.Іванов [1969 р.] дав генеральні оцінки середніх вмістів елементів-домішок у головних рудних мінералах. Обчислені з накопиченого у світовій літературі аналітичного матеріалу, вони показують, яку величезну масу важливих елементів-домішок несуть у собі деякі рудні мінерали (так в піриті кларк концентрації Tl складає 24, Se - 81, Te - 34, а кларк концентрації Cd в сфалериті - 2705). Існують також відповідні узагальнення кларків концентрації елементів у промислових родовищах.
Елементи, які мають і низькі кларки і малу спроможність до концентрації, розсіяні в земній корі, і у всіх породах, грунтах і мінералах зустрічаються в незначних кількостях. Такі елементи називаються рідкісними розсіяними; їхня роль в системах (ландшафті) і процесах завжди другорядна (Ra, Sc, Cd, In, Hf, Ga і ін.).
Розповсюджені хімічні елементи, що визначають істотні і характерні риси даної системи (процесу), називаються типоморфними. В ландшафті такими елементами є Ca, H (точніше водневий іон), Fe, S, Cl та інші елементи. Це дозволяє говорити про кальцієві (Ca), кислі (H+), глеєві (Fe2+) та інші ландшафти (наприклад, кальцієва і кисла тайга).
Розбіжності в кларках призводять до того, що хімічна подібність елементів зовсім не означає їх “геохімічної подібності”. Так, наприклад, у натрію кларк високий (2,50%), тому його багато в ландшафтах. У солончаках, соляних озерах він визначає геохімічну своєрідність ландшафту, фізико-хімічні умови середовища, тобто є типоморфним. Цезій у хімічному відношенні схожий на натрій, але його кларк малий (3,7*10-4%) і вплив на геохімічні особливості ландшафту невеликий. Адже він не визначає фізико-хімічних умов середовища і мігрує в тій обстановці, що створена головними елементами. Якби в цезію був такий кларк, як у натрію, то його роль у ландшафті була б також велика, тобто він був би типоморфним елементом.
Чим більший кларк елементу, тим, при подібних хімічних властивостях, вищий його вміст в
83
84
природних водах, а отже, і більша імовірність утворення насичених розчинів, осадження мінералів. Рідкісні й особливо рідкісні розсіяні елементи, як правило, не насичують природні води, у зв'язку з чим число їхніх мінералів невелике. Наприклад, для Ca відомо 385 мінералів (кларк - 2,96%), а його хімічний аналог Ra (кларк - біля 10-10%) не утворює жодного власного
мінералу. Аналогічно, K (2,50%) утворює 106 мінералів, а Rb (0,015%) – 0; S (0,047%) - 369, а Se (5 *10-6) - 37 і т.д.
У мінералах рідкісні катіони звичайно зв'язуються з поширеними (розповсюдженими) аніонами, а рідкісні аніони - з поширеними катіонами. Тому в ландшафтах відомі сульфати, карбонати, фосфати рідкісних металів і селенати, ванадати, арсенати поширених катіонів (CaSeO4, Na2SeO4, PbSeO4, (UO2)3(PO4)2 і т.д.). Утворення мінералів із рідкісних і катіонів і аніонів малоймовірні (наприклад, CaCrO4 відомий, а SrCrO4 - немає, тому що концентрація відповідних іонів не досягає стану насиченого розчину).
Таким чином, спроможність до мінералоутворення залежить не тільки від хімічних властивостей елементів, але і від їхніх кларків. Низькі кларки багатьох елементів є однією з причин обмеженості числа мінералів (А.А.Сауков). Це визначає важливу відмінність природних реакцій від лабораторних. Хімік, задавшись метою здійснити якусь реакцію, бере стехіометричне співвідношення речовин, що реагують, або й з невеликим надлишком одного з реагентів, щоб реакція пройшла до кінця. У природі ж стехіометричні співвідношення майже ніколи не спостерігаються, деякі реагенти знаходяться в різкому надлишку, а інших бракує. Тому число мінералів менше числа хімічних сполук того ж класу.
Отже, природні системи відрізняються від лабораторних умов різко нерівномірною поширеністю хімічно близьких елементів (Ca - Ra, S - Se, Cl - I і т.д.), у зв'язку з чим чисто «хімічне мислення» є недостатнім при аналізі природних процесів; необхідне «геохімічне мислення», що враховує величину кларку.
Згідно до основного геохімічного закону Гольдшмідта кларки залежать від будови атомного ядра, а обумовлений міграцією розподіл елементів – від будови зовнішніх електронних оболонок
(хімічних властивостей). Це не зовсім так, оскільки і кларки залежать від хімічних властивостей (сама земна кора є продуктом міграції) і міграція певним чином залежить від кларків (вміст елементів в розчинах і розплавах, здатність до осадження). Саме тому нині користуються дещо відкоригованим визначенням основного геохімічного закону (закон Ферсмана-Гольдшмідта):
геохімія елементу в земній корі визначається як його хімічними властивостями, так і величиною кларку.
84

4.1 Будова та розміри атомів та іонів.
Будова атомних ядер
Ядра атомів складені нуклонами – протонами і нейтронами, спін яких дорівнює ½ h.
Маса електрону me= 0,000548756 dalton = 9,1093897·10-31 кг;
енергія спокою електрону 0,510999 МеВ;
заряд електрону негативний: e-= -1,60217733·10-19 Кл; магнітний момент електрону e=928,47701·10-26 Дж/Тл; комптонівська довжина хвилі електрону С=2,42631058·10-12 м.
Маса протону mp=1836·me = 1,007593 daltons = 1,6726231·10-27 кг;
енергія спокою протону 938,27231 МеВ;
заряд протону позитивний: e+= +1,60217733·10-19 Кл; магнітний момент протону p=1,41060761·10-26 Дж/Тл; час життя протону не менш як 1030 років;
комптонівська довжина хвилі протону С, p=1,32141002·10-15 м.
Маса нейтрону mn=1840·me = 1,008982 daltons 1,6749286·10-27 кг;
енергія спокою нейтрону 939,56563 МеВ; заряд нейтрону =0;
магнітний момент нейтрону n=0,96623707·10-26 Дж/Тл;
час життя нейтрону складає близько 15,3 хвилин, оскільки нейтрон є стійким виключно у складі стабільних атомних ядер, а у вільному стані розпадається за схемою n p + e- + ύ;
комптонівська довжина хвилі нейтрону С, e=1,31959110·10-15 м
За кількістю протонів у ядрі визначається номер Z, який визначає положення елементу в періодичній таблиці Менделєєва.
Чітких меж атоми не мають. Діаметр ядра атому водню = 1,45 фм (фемтометр, раніше фермі – Ф=10-15 м)= 1,45·10-15 м (при діаметрі власне атому в 100000 фм), а діаметр ядра урану = 9 фм.
Густина ядра атому складає, за різними оцінками, від 1·1017 кг/м3 (Френкель Я.І.) до 6·1017 кг/м3 (Шпольський Е.В.).
Найвища густина заряду ядра у атому водню, у важких ядер густина заряду густини заряду ядра H. Середня густина заряду ядра3·1019 Кл/см3=3·1025 Кл/м3. Розподіл заряду досить складний – у протону, наприклад, він спадає до 0 на відстані 1,4 фм від центру, що може бути наслідком наявності у протона мезонної хмари (за рахунок виверження і поглинання протоном мезонів). У ядер атомів від Ca до U існує рихла оболонка товщиною 2,4 фм.
85
1 ерг = 1·10-7 Дж
1 еВ =1,602177·10-19 Дж
1 МеВ =1,602177·10-13 Дж
1 dalton (уніфікована атомна одиниця маси – 1 у.а.о.м) =
1,6605402·10-27 кг= 931,5 Мев
-34
h (постійна Планка) = 6.626· 10Дж ·с (Дж/Гц)
Спін – власний момент кількості руху елементарної частинки
Спін = j· h
де j = 0; ½; 1; 1½; 2; 2½;…
Для ферміонів (частинки, в яких j= n+½) є справедливим принцип Паулі за яким одинакові частинки з таким спіном не можуть одночасно перебувати в одному стані. До ферміонів належать всі баріони, лептони, квазічастинки та атомні ядра з непарним Z.
Частинки в яких j=n називаються бозонами.
До баріонів (важких частинок) належать: протон (p), нейтрон (n), гіперони тощо.
Мезони – частинки з середньою масою.
Лептони (легкі частики) – електрон, мюон, нейтрино та їх античастинки.
Сильна взаємодія – процеси за яких частинки обмінюються енергіями та імпульсами і перетворюються з одного виду в інший. Термін “сильний” зокрема означає високу вірогідність процесу. В сильній взаємодії беруть участь адрони (баріони і мезони).
Слабкі взаємодії – процеси в яких можуть брати участь і взаємоперетворюватись всі
85

Ядерні сили, які зв’язують нуклони в ядрі досягають багатьох мегаелектронвольт (тобто в тисячі разів більші за взаємодію p e-) але діють на дуже малих відстанях 4 фм. Вважається, що ця взаємодія обумовлена безперервним обміном (випромінюванням) мезонами між нуклонами:
p n+¶+; n p+¶-;
де ¶+ та ¶- - пі-мезони з масою =274·me і часом життя 2,603·10-8с.
86
субатомні частинки. Вірогідність цих процесів невелика. Крім адронів у слабких взаємодіях беруть участь лептони і фотони. Слабкі взаємодії обумовлюють розпад частинок та ядер. Наприклад, β- розпад:
n p+e-+ΰе (антинейтрино);
p n+e++νе (нейтрино)
Для унаочнення співвідношень величин сил взаємодії прирівняємо сильні взаємодії до 1. Тоді електромагнітні взаємодії становитимуть менш як 10-2, слабкі взаємодії - 10-5, а гравітаційні становитимуть всього 10-39. Щоправда, вже на відстані 10 фм вплив сильних взаємодій буде меншим за вплив електромагнітних взаємодій.
Структура атомних ядер є й нині однією з найскладніших проблем фізики. Всі існуючі моделі (“краплі рідини”, фермі-газу, оптична, колективна, оболонкова) є швидше робочими гіпотезами. В геохімії звикли використовувати оболонкову модель, згідно якої кожен нуклон в ядрі знаходиться в певному квантовому стані і розташовується на відповідному до цього стану енергетичному рівні. Ці рівні можуть заповнюватись певним числом нуклонів.
хімічна атомна одиниця маси – 1 х.а.о.м.= 1/16 середньої атомної маси ізотопів кисню O16, O17 і O18 = 1,66022 10-27 кг
уніфікована атомна одиниця маси – 1 у.а.о.м.= 1/12 маси ядра ізотопу C12 = 1,66054 10-27 кг
Ядра, в яких повністю заповнені рівні з числом нейтронів 2, 8, 20, 28, 50, 82 і 126, або з числом протонів 2, 8, 20, 28, 50, 82 називаються магічними, в них відбувається стрибкоподібна зміна властивостей, зокрема енергії зв’язку нуклонів.
Формулу атому можна представити у вигляді: ZNXA
де A - масове число (A=Z+N), а Z та N – кількість протонів та нейтронів, відповідно.
Ізотопи – це атоми з однією і тією ж кількістю протонів, але різною кількістю нейтронів:
Z=constNXA.
Наприклад: 2020Ca40, 2022Ca42, 2023Ca43, 2024Ca44, 2026Ca46, - стабільні ізотопи кальцію.
Ізобари – це атоми різною кількістю протонів, але однаковими масовими числами:
ZNXjA=const.
Наприклад: 46Be10 - 55Ba10 - 64C10
Ізотони – це атоми з різною кількістю протонів, але однаковою кількістю нейтронів:
ZN=const XjA.
Наприклад: 57B12, 67C13, 77N14, 87O15
Ізоміри – це атоми з однаковою будовою ядра які знаходяться в різному енергетичному стані. Для ізомірів характерні різний період піврозпаду та різна енергія зв’язку.
Наприклад: у 3545Br80 період піврозпаду може бути 18 хвилин та 4,58 години. Ядерна ізомірія проявляється у ядер атомів з числами Z та N дещо меншими від 50, 82, 126. Поблизу цих значень існують “острівці” ізомірії ядер.
Стійкість атомних ядер визначається багатьма факторами: дефіцит мас і його похідні (питомий дефект маси, питома енергія зв’язку нуклонів в ядрі); співвідношення кількості протонів та нейтронів; парність протонів, нейтронів та масових чисел; радіоактивність.
Встановлено, що маса ядра більшості атомів менша за суму мас нуклонів які складають це ядро. Різниця між масою атому ізотопу (в атомних одиницях маси) та масовим числом (кількість нуклонів в ядрі цього ізотопу) називається дефектом маси ядра:
86
87
М = Z mp +N mn - М (маса ядра)
або, в іншому варіанті, М = Z mp +N mn + Z me - М (маса ядра)
Дефект маси обумовлений “витратами” частини маси на забезпечення зв’язкунуклонів в ядрі.
Енергія зв’язку нуклонів в ядрі (Eзв) – характеризує стійкість ядра і відповідає енергії, яку необхідно витратити для розчеплення ядра на окремі нуклони.
Виходячи з формули E = m c2, маємо:
Eзв = (Z mp +N mn – М) c2 = М c2;
звідси ж випливає що 1 у.а.о.м. (1 dalton) еквівалентна енергії 931,5 МеВ (1,67 10-24 г 9 1020
см2/с2 = 1,5 10-3 ерг = 931 МеВ)
Для прикладу розрахуємо енергію зв’язку атома гелію (22He4).
М = 2 mp +2 mn + 2 me - M4He= 4,034248 – 4,003873 daltons = 0.030375 daltons.
Така величина дефекту мас еквівалентна енергії 28,28 МеВ.
Енергія зв’язку приблизно пропорційна числу нуклонів і, таким чином, приєднання до ядра одного нуклона супроводжується виділенням, середньому, однієї і тієї ж кількості енергії.
За К.Ф.Вейцзеккером залежність Eзв від Z та A для всіх відомих ядер виглядає наступним
чином: |
- A2/3 |
- Z2 A-1/3 |
- (A/2-Z)2/A |
|
|
Eзв = |
A |
+ (A,Z); |
|||
|
|
|
|
|
|
|
лінійна |
зменшення енергії |
зменшення енергії зв’язку за рахунок |
зменшення енергії |
вплив |
|
залежність |
зв’язку за рахунок |
енергії електростатичного |
зв’язку за рахунок |
парності Z |
|
від |
того що частина |
кулонівського відштовхування, |
нерівності числа |
і A |
|
масового |
нуклонів знаходиться |
обернено пропорційної радіусу ядра і |
протонів і нейтронів в |
|
|
числа |
на поверхні ядра |
прямо пропорційної квадрату заряду |
ядрі |
|
Емпірична формула К.Ф.Вейцзеккера (в МеВ) має вигляд
Eзв = A [ |
- 15,75 |
+17,8 A-1/3 |
+ 0,71 Z2/A4/3 |
|
об’ємна енергія |
поверхнева енергія |
кулонівська енергія |
+ 23,7 (A-2 Z)2/A2 ];
енергія симетрії
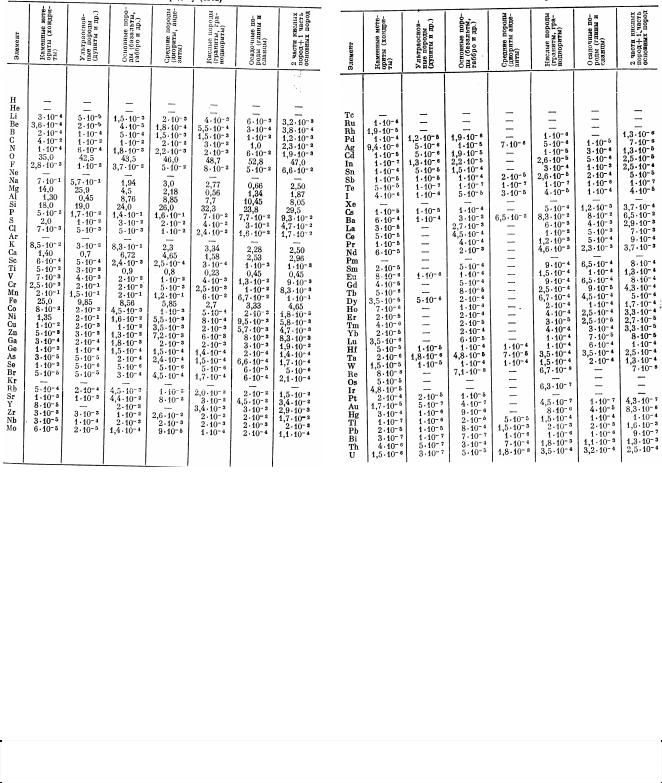
Рис.2.1 - Графічна залежність дефекту мас (в а.о.м.) від масового числа A.
З малюнку видно, що дефект маси позитивний для ядер легших за O16. При A>20 дефект мас стає від’ємним. Нове зростання дефекту маси (обумовлене електростатичним відштовхуванням протонів) починається у важких ядер і для ядер починаючи з A>180 дефект маси знову стає позитивним. Мінімум М спостерігається у 3850Sr88.
Дефект маси, розрахований на один нуклон, називається питомим дефектом маси, або упаковочним коефіцієнтом: P= М/A.
87
88
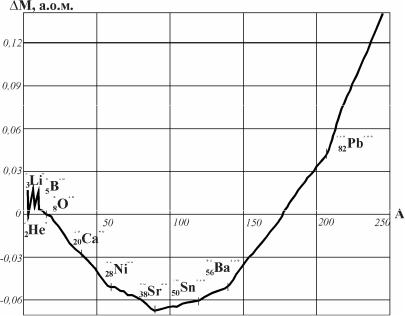
Залежність упаковочного коефіцієнту від масового числа показана на рисунку 2.2.
Рис.2.2 - Залежність упаковочного коефіцієнту (P) від масового числа (A). (а) – легкі елементи, (б) – важкі елементи
Найменші значення питомого дефекту маси відповідають найстійкішим ядрам (мінімум у 2832Ni60), тобто упаковочний коефіцієнт також характеризує стійкість атомного ядра.
Питома енергія зв’язку нуклонів у ядрі обчислюється за формулою
Eзв=| М/A| 931 МеВ = |P| 931 МеВ. (в
англомовній літературі - binding energy per nucleon, Eb).
|
9 |
4 |
He |
|
|
|
2 |
3 |
8 |
Рис.2.3 |
- |
Залежність |
питомої |
енергії |
|
МеВ |
|
|
|
|
|
зв’язку нуклонів в ядрі (Eзв) від масового |
|||||||||
8 |
|
5 6 |
|
|
|
|
U |
||||||||
|
|
|
|
Fe |
|
|
|
|
числа (A). |
|
|
|
|
||
7 |
|
|
|
|
|
|
|
Мінімальні значення питомої енергії |
|
||||||
язку, |
|
|
|
|
|
|
|
|
|
||||||
6 |
|
1 0 |
|
|
|
|
|
|
зв’язку характерні для легких ядер ( 1 |
||||||
|
B |
|
|
|
|
|
|
МеВ), із збільшенням масового числа |
|||||||
|
|
|
|
|
|
|
|
||||||||
зв’ |
5 |
|
6 |
|
|
|
|
|
|
вона стрибкоподібно зростає, |
|
|
|||
енергія |
4 |
|
Li |
|
|
|
|
|
|
досягаючи максимуму в ядрах атомів |
|||||
|
|
|
|
|
|
|
|
групи заліза ( 8,7 МеВ) і поступово |
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||
3 |
|
3 |
|
|
|
|
|
|
зменшується надалі (до 7,5 МеВ в ядрі |
||||||
Питома |
2 |
|
He |
|
|
|
|
|
|
урану). |
|
|
|
|
|
|
|
|
|
|
|
|
Відповідно до величини |
дефекту |
|||||||
1 |
|
1 |
|
|
|
|
|
|
|||||||
|
|
H |
|
|
|
|
|
|
маси, |
упаковочного |
коефіцієнту |
та |
|||
|
|
|
|
|
|
|
|
|
питомої енергії зв’язку, виділення |
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
0 |
20 |
40 |
60 |
80 100 120 140 160 |
180 200 220 |
240 |
енергії характерно лише для синтезу |
||||||
|
|
|
|
|
|
Масове число (А) |
|
|
та розпаду ядер легких (H, He, Li) та |
||||||
|
|
|
|
|
|
|
|
|
|
важких (Th, U, Pu) елементів. Ядра ж |
|||||
атомів елементів з середини таблиці Менделєєва настільки стійкі, що для реакцій синтезу і |
|||||||||||||||
розпаду з виділенням енергії непридатні (ядра Fe, Ag, Au, Hg не детонують навіть при вибухах |
|||||||||||||||
водневих бомб). |
|
|
|
|
|
|
|
|
|
|
|
||||
При синтезі ядер He |
34Li7 + 10H1 |
22He4 +22He4 |
||
|
7,0182 |
1,0081 |
4,004 |
4,004 |
8,0263 а.о.м. |
8,008 а.о.м. |
виникає різниця в 0,0183 а.о.м., яка еквівалентна енергії 17,25 МеВ (саме така
енергія у утворюваних –часток).
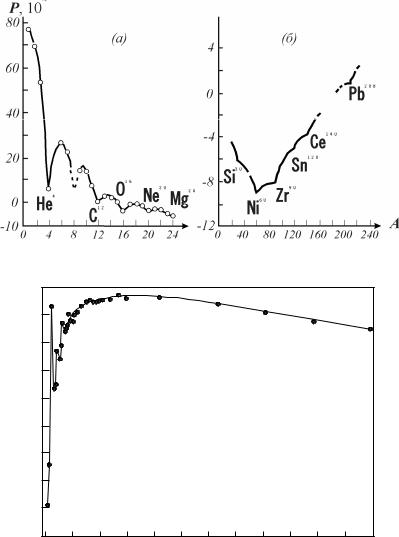
Мінімальні значення енергії зв’язку припадають на легкі ядра з непарною кількістю протонів і
нейтронів – 11H2, 33Li6, 55B10, 77N14, а максимальні – на ядра з парною кількістю протонів та нейтронів – 22He4, 66C12, 88O16, 2020Ca40, 2630Fe56, 2832Ni60. Ця закономірність дуже важлива для пояснення розповсюдженості в природі різних атомів – в цілому високі значення питомої енергії
88
89
зв’язку характеризують найбільш стійкі і тому найбільш розповсюджені ядра атомів. Мінімальні значення енергії зв’язку характерні для малостіких ядер, що рідко зустрічаються.
Стійкість атомних ядер значною мірою залежить від співвідношення протонів та нейтронів. Для стійких ядер до A=40 це співвідношення дорівнює 1 (2020Ca40). Надалі, (починаючи з 2123Sc44) для ослаблення сил кулонівського відштовхування в ядрі залучаються додаткові нейтрони, число яких зростає і досягає 44 у 82126Pb208. Починаючи з Z=83 (вісмут), незважаючи на подальше зростання кількості нейтронів в ядрах, всі вони стають нестійкими, радіоактивними. Цей факт, як і меншу стабільність ядер з непарною кількістю протонів та нейтронів можна пояснити тим, що зв’язок нуклонів в ядрі обумовлений обміном між ними мезонами. Підтвердженням цього є розподіл за парністю і непарністю нуклонів 274 відомих стабільних ізотопів.
Таблиця 2.1 – Залежність числа стабільних ізотопів від парності Z, N, A. |
|
|
|||||
Z |
N |
A |
Число ізотопів |
Приклад |
|
87% |
|
Парне |
Парне |
Парне |
165 + 11 довг.р.і. |
88O16 |
|
||
Парне |
Непарне |
Непарне |
55 +3 довг.р.і. |
1415Si29 |
|||
|
земної кори |
||||||
Непарне |
Парне |
Непарне |
50 +3 довг.р.і. |
78N15 |
|
|
|
Непарне |
Непарне |
Парне |
4 +5 довг.р.і. |
11H2,33Li6, 55B10, 77N14 (1921K40,2327V50) |
|
|
|
Примітка 1921K40- радіоактивний з T½ =1,27 109 років, а 2327V50– з T½ = 1015 років.
За проф. Г.Оддо елементи, що мають парну атомну масу, суттєво переважають на Землі над непарними - вони складають 86,5% загальної маси земної кори. Проф. В.Гаркінс показав, що в метеоритах це переважання ще суттєвіше і складає: в металевих метеоритах - 92,22%, а в кам’яних
-97,69%. Ці емпіричні спостереження в геохімії одержали назвуправила Оддо-Гаркінса.
Парність Z, N, A має велике значення:
-вона знаходить відображення в кількості ізотопів у одного елемента, їх стійкості, наявності чи відсутності сусідніх ізобар, в проявленні так званих магічних чисел;
-всі елементи з парним Z мають кілька ізотопів (незалежно від розповсюдженості), які є стабільними незалежно від парності нейтронів;
-у всіх елементах з парним Z до 28Ni – один парний ізотоп різко переважає інші за розповсюдженістю: 22He4 - 99,97%, 66C12 – 98,89%, 88O16 – 99,76%, 1010Ne20 – 90,92%, 1212Mg24 – 78,60%,1414Si28 – 95,51%, , 2830Ni58 (з 5 ізотопів) – 67,76%;
-в ядрах з парним Z>28 розповсюдженість ізотопів більш рівномірна, наприклад:
A= |
92 |
94 |
95 |
96 |
97 |
98 |
100 |
42Mo |
15,86% |
9,12% |
15,7% |
16,5% |
9,45% |
27,75% |
9,62% |
A= |
168 |
170 |
171 |
172 |
173 |
174 |
176 |
70Y |
0,14% |
3,03% |
14,31% |
21,82% |
16,13% |
31,84% |
12,73% |
-серед ізотопів з парним Z і непарним N відсутні ядра, в яких A дорівнює сусіднім ізобарам. Так, наприклад, у молібдену немає ізотопів з А=93 та А=99 (4251Mo93, 4257Mo99). Це пов’язано з тим що:
a)з масовим числом А=93 існує стабільний ізотоп 4152Nb93 (100% розповсюдженості Nb);
b)масове число А=99 характерне для стабільного ізотопу 4455Ru99 (12,8% розповсюдженості) та радіоактивного ізотопу 4356Tc99 (його радіоактивність обумовлена тим що він є сусіднім
ізобаром до 4455Ru99 і, відповідно, нежиттєздатнім). Взагалі в ряду 41Nb 42Mo 43Tc
44Ru, у Mo та Ru існує по 7 ізотопів.
Очевидно, з аналогічних причин в природі відсутній Pm: 61Pm145 60Nd142, 143, 144, 145, 146, 148, 150, ядру якого відповідає стабільний ізотоп 60Nd145 з розповсюдженістю 8,3%.
89

90
В наведених прикладах роль парності Z проявляється і в кількості ізотопів (в парних 42Mo, 44Ru, 60Nd – по 7 ізотопів, а в непарних 41Nb, 43Tc, 61Pm – по 1 ізотопу) і в їх розповсюдженості (43Tc, 61Pm в природі не зустрічаються, є радіоактивними, а розповсюдженість 41Nb – 20 г/т). Слід зауважити також, що нестійкість сусідніх ізобар зростає зі збільшенням Z.
Найстійкішими, найбільш розповсюдженими, з найбільшим числом ізотопів та ізотонів є ядра (“магічні ядра”) в яких кількість протонів або нейтронів дорівнює “магічному числу”: 2, 8, 20, 28, 50, 82, 126. Згідно оболонкової моделі нуклони ядра рухаються в самоузгодженому полі нуклонів, намагаючись повністю заповнити оболонки N і Z в яких існують певні енергетичні рівні, розділені сильними енергетичними щілинами. Схематично це виглядає наступним чином:
Послідовність заповнення рівнів в оболонковій моделі
22He4 |
88O16 |
2020Ca40 |
|||||
| |
| |
|
| |
| |
|
| | |
|
2p |
2n енергетич |
6p |
6n енергетич |
12p 12n енергетич |
|||
|
|
на щілина |
|
|
на щілина |
|
на щілина |
Загальний ряд магічних ядер виглядає
так: 22He4, 88O16, 2020Ca40, 2832Ni60, 3850Sr88,
5070Sn120, 5682Ba138, 82126Pb208 (підкреслені двічі магічні ядра).
В магічних ядрах енергія зв’язку нуклонів значно вища ніж в сусідніх ядрах ( 7 МеВ на 1 нуклон в 22He4 проти 5,3 МеВ в 33Li6; енергія відриву 82-го протона в ядрах з N=124-128 сягає 8,5
МеВ, а 83-го – 4,4 МеВ).
При приєднанні до ядра з магічним числом одного протона чи нейтрона питома Езв різко
зменшується і відбувається викид нейтрона. У цих ядер низька вірогідність захоплення нейтронів (малий ефективний перетин захоплення нейтронів). Так, в 3850Sr88, 5682Ba138, 82126Pb208 ефективний
перетин нейтронів з енергією 1 МеВ в 10 100 разів менший ніж в сусідніх ядер, де оболонки не заповнені повністю. Якщо продуктом розпаду є ядро з 126-ма нейтронами то -частинки, що випромінюються, мають мінімальну енергію. Якщо при -розпаді розпадається ядро з магічним числом p або n то енергія -часток в 5 20 разів вища.
Ядра з магічним числом p або n мають найбільшу кількість ізотопів та ізотонів. Число ізотопів і ізотонів в елементів наступних за магічними ядрами різко зменшується.
Таблиця 2.2 – Стабільні та довго живучі ізотопи магічних ядер
|
2He |
|
8O |
20Ca |
28Ni |
|
38Sr |
|
50Sn |
|
56Ba |
82Pb |
|||||||
n A % |
n A % |
n A % |
n A % |
n A % |
n A % |
n A % |
n A % |
||||||||||||
1 |
3 |
0,00013 |
8 |
16 99,759 |
20 40 |
96,62 |
30 58 |
67,8 |
46 |
84 |
0,56 |
62 |
112 |
0,95 |
74 |
130 |
0,1 |
122 204 |
1,55 |
2 |
4 |
99.99 |
9 |
17 0,037 |
22 42 |
0,64 |
32 60 |
26,2 |
48 |
86 |
9,86 |
64 |
114 |
0,65 |
76 |
132 |
0,15 |
124 206 22,51 |
|
|
|
|
10 18 0,204 |
23 43 |
0,132 |
33 61 |
1,25 |
49 |
87 |
7,02 |
65 |
115 |
0,34 |
78 |
134 |
2,5 |
125 207 |
22,6 |
|
|
|
|
|
|
24 44 |
2,13 |
34 62 |
3,60 |
50 |
88 |
82,56 |
66 |
116 |
14,34 |
79 |
135 |
6,6 |
126 208 53,34 |
|
|
|
|
|
|
26 46 |
0,0032 |
36 64 |
1,16 |
|
|
|
67 |
117 |
7,57 |
80 |
136 |
7,9 |
|
|
|
|
|
|
|
28 48 |
0,179 |
|
|
|
|
|
68 |
118 |
24,01 |
81 |
137 |
11,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
69 |
119 |
8,58 |
82 |
138 |
71 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
120 |
32,97 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
72 |
122 |
4,71 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
74 |
126 |
5,98 |
|
|
|
|
|
|
|
|
|
|
Загальна кількість стабільних та довго живучих ізотопів |
|
|
|
|
||||||||||
|
|
2 |
|
3 |
6 |
|
5 |
|
|
4 |
|
|
10 |
|
|
7 |
|
4 |
|
|
Таблиця 2.3 – Стабільні та довго живучі ізотони з магічним числом нейтронів |
|
|
||||||||||||||||
|
Магічне число нейтронів |
|
|
|
|
|
Ізотони |
|
|
|
|
|
Всього |
|
|||||
|
|
|
2 |
|
|
|
|
|
|
|
12H, 22He |
|
|
|
|
|
2 |
|
|
|
|
|
8 |
|
|
|
|
|
|
|
78N, 88O |
|
|
|
|
|
2 |
|
|
90
