
Геохімія
.pdf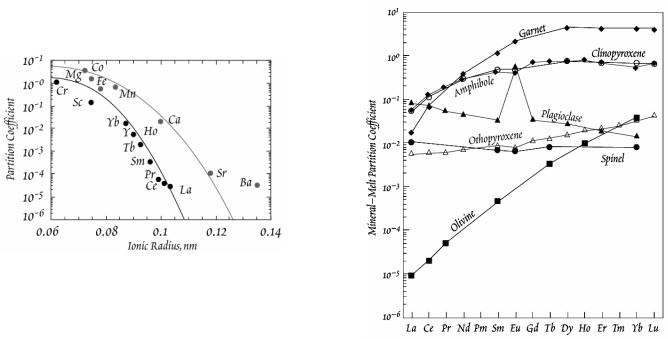
141
Табл. (7.5) -Коефіцієнти розподілу мінерал-розплав в базальтах
|
Олівін |
Ортопі |
Клиноп |
Плагі |
Шпіне |
Гранат |
Амфі |
|
Олівін |
Орто |
Клин |
Плагі |
Шпін |
Грана |
Амфі |
|
|
роксен |
іроксен |
оклаз |
ль |
|
бол |
|
|
пірок |
опіро |
оклаз |
ель |
т |
бол |
|
|
|
|
|
|
|
|
|
|
сен |
ксен |
|
|
|
|
Li |
0.041 |
0.11 |
0.59 |
0.45 |
|
|
|
Pr |
0.000049 |
0.006 |
|
0.056 |
|
|
0.178 |
Be |
0.035 |
|
0.047 |
0.36 |
|
|
|
Nd |
|
0.007 |
0.277 |
0.045 |
|
0.363 |
0.273 |
B |
0.034 |
|
0.027 |
0.117 |
|
0.08 |
|
Sm |
0.000445 |
0.0085 |
0.462 |
0.033 |
0.0064 |
1.1 |
0.425 |
K |
0.00017 |
|
0.0028 |
0.18 |
|
0.002 |
0.35 |
Eu |
|
0.0078 |
0.458 |
0.55 |
0.0061 |
2.02 |
0.387 |
Sc |
0.37 |
0.6 |
0.8 |
0.065 |
0.048 |
0.688 |
|
Gd |
|
0.011 |
|
0.034 |
|
|
0.725 |
V |
0.3 |
2.6 |
1.81 |
0.04 |
38 |
1.48 |
|
Tb |
0.00324 |
0.011 |
|
|
0.0078 |
|
0.779 |
Ga |
0.024 |
|
0.74 |
0.86 |
4.6 |
|
|
Dy |
|
0.015 |
0.711 |
0.03 |
|
4.13 |
0.816 |
Ge |
0.097 |
0.25 |
1.4 |
0.51 |
0.1 |
|
|
Ho |
0.00927 |
0.019 |
|
|
|
|
0.783 |
Rb |
0.000044 |
|
0.0033 |
0.025 |
|
0.007 |
0.437 |
Er |
|
0.021 |
0.66 |
0.02 |
|
3.95 |
0.699 |
Sr |
0.000063 |
0.0068 |
0.157 |
2.7 |
|
0.0099 |
0.184 |
Tm |
|
0.025 |
|
|
|
|
|
Y |
0.0098 |
0.014 |
0.62 |
0.013 |
|
5.42 |
0.634 |
Yb |
0.0366 |
0.032 |
0.633 |
0.014 |
0.0076 |
3.88 |
0.509 |
Zr |
0.00068 |
0.004 |
0.195 |
0.001 |
0.06 |
2.12 |
0.3 |
Lu |
|
0.042 |
0.623 |
|
|
3.78 |
0.645 |
Nb |
0.00005 |
0.015 |
0.0081 |
0.033 |
0.08 |
0.0538 |
0.197 |
Hf |
0.001 |
0.021 |
0.223 |
|
0.05 |
1.22 |
0.638 |
Cs |
0.0015 |
|
0.0039 |
0.026 |
|
|
|
Ta |
0.00005 |
0.015 |
0.013 |
0.11 |
0.06 |
0.11 |
|
Ba |
0.0000034 |
0.0067 |
0.0022 |
0.33 |
|
0.0007 |
0.282 |
Pb |
0.0076 |
|
0.01 |
1.07 |
|
0.0001 |
|
La |
0.0000088 |
0.0056 |
0.052 |
0.082 |
0.01 |
0.0164 |
0.058 |
Th |
0.000052 |
0.0056 |
0.014 |
0.19 |
|
0.0014 |
0.016 |
Ce |
0.000019 |
0.0058 |
0.108 |
0.072 |
|
0.065 |
0.116 |
U |
0.00002 |
0.015 |
0.013 |
0.34 |
|
0.0059 |
|
Data sources: Beattie (1994), Chaussidon and Libourel (1993), Chazot et al. (in press), Dunn and Sen (1994), Hart and Brooks (1974), Hart and Dunn (1993), Hauri et al. (1994), Kennedy et al. (1993), Nagasawa et al. (1980), and compilations by Green (1994), Irving (1978), and Jones (1995).
Джерела: Beattie (1994), Chaussidon and Libourel (1993), Chazot et al. (in press), Dunn and Sen (1994), Hart and Brooks (1974), Hart and Dunn (1993), Hauri et al. (1994), Kennedy et al. (1993), Nagasawa et al.
(1980), Green (1994), Irving (1978), and Jones (1995).
Рис. 7.11 - Залежність коефіцієнту розподілу 2- і 3-валентних іонів між олівіном і силікатним розплавом відіонного радіусу
Рис. 7.15
141

142
5.3. ТЕРМОДИНАМІЧНИЙ КОНТРОЛЬ РОЗПОДІЛУ ЕЛЕМЕНТІВ
Застосування методів термодинаміки в геології має на меті з’ясування критеріїв можливості (неможливості) реалізації фізичних і хімічних процесів в тих чи інших конкретних умовах, а також передбачення межі перебігу процесів до досягнення точки рівноваги.
Термодинаміка при цьому не розглядає конкретних шляхів (механізмів) перебігу процесів і не може дати відповідь на запитання: чому той чи інший процес відбувається так а не інакше?
Фізико-хімічна система – будь-яка сукупність взаємодіючих тіл виділених (реально або уявно) з навколишнього середовища.
За характером взаємодії з зовнішнім середовищем виділяють 3 типи систем: 1) ізольовані (взаємодія відсутня); 2) закриті (здійснюється обмін лише енергією); 3) відкриті (здійснюється обмін і речовиною і енергією).
Параметри, які характеризують стан систем поділяють на:
1)інтенсивні – параметри які можуть приймати цілком визначені значення в кожній точці системи і не залежать від кількості складових частин (системи) – тиск, температура, концентрація;
2)екстенсивні – параметри які характеризують систему в цілому, їх величини залежать від кількості інгредієнтів системи – об’єм і маса як тіл так і системи в цілому, внутрішня енергія, ентропія, ентальпія тощо. Ц параметри мають аддитивний характер.
Термодинамічний стан конкретного тіла визначається його температурою (в К), тиском (в кгс/см2 - атм) і об’ємом – см3/моль.
Нерівноважний стан – стан за якого в системі відбувається (чи може розпочатися в будь-який момент) одностороння направлена зміна її параметрів в наслідок їх невідповідності параметрам стану середовища. Самочинна зміна напрямку таких процесів не допускається.
Стаціонарний стан – це своєрідна відміна нерівноважного стану, за якої система знаходиться у спокої завдяки дії зовнішніх процесів.
Рівноважний стан – такий стан системи, який залишається незмінним при одночасній незмінності навколишнього середовища. (Дії процесів в системі, які можуть вивести систему з рівноважного стану, повністю компенсуються протидією процесів які відбуваються в зовнішньому середовищі).
Будь-який рівноважний стан є динамічним, пов’язаним з одночасним перебігом протилежних за спрямованістю процесів. - в зовнішньому середовищі і в середині системи. Необхідною і достатньою умовою рівноваги в простих системах є рівність інтенсивних параметрів (тиск, температура, хімічний потенціал) у всіх частинах системи.
Простими називають системи стан яких визначається тепловими, механічними і хімічними процесами, а сили поверхневого натягу, магнітні, гравітаційні сили і сили електричної взаємодії значення не мають.
Серед рівноважних станів за ступенем досконалості виділяють: 1) стійкий (стабільний) – система є стійкою як до нескінченно малих так і до кінечних змін параметрів її стану;
2)рухливий (мобільний) – (метастабільний?)
3)нестійкий (лобільний)
Метастабільним станом називають такий стан коли система є стійкою лише до нескінченно малих змін параметрів стану, а при кінечних величинах їх змін переходить в стабільний стан;
142
143
За нестійкої рівноваги система чутливо реагує на будь-яку зміну параметрів зовнішнього середовища і при їх зміні переходить або до стабільної рівноваги або до нерівноважного стану.
Процеси бувають квазістатичними і нестатичними.
Квазістатичні процеси є зворотними і рівноважними, вони проводять систему через низку рівноважних станів, які відрізняються один від одного на нескінченно малу величину. Такий процес повинен відбуватись дуже повільно, настільки повільно щоб порушенням рівноважного стану в кожен момент часу можна було знехтувати. При цьому допускається можливість повернення системи з будь-якого наступного проміжного положення в попереднє, аж до досягнення вихідного стану.
Нестатичні процеси супроводжуються суттєвим відхиленням від рівноваги і є незворотними. Систему де відбувся нестатичний процес можна повернути до попереднього стану лише в тому випадку, якщо вона не ізольована – за рахунок зміни параметрів зовнішнього середовища. Для системи девідбуваються незворотні процеси характерна наявність градієнтів різних властивостей системи в об’ємі та (або) часі.
1-е начало термодинаміки
d’Q=dU+dA |
9.1 |
|
або (для відкритої системи): |
9.2 |
|
m |
|
|
d’Q+1 |
m dnm=dU+dA; |
|
де: d’Q – поглинання системою енергії в тепловій формі, dU – зміна внутрішньої енергії (“+” - приріст, “-” - втрата), dA - робота над зовнішнім середовищем (“-” – робота зовнішніх сил над системою); m - кількість енергії яку вносить в систему 1 моль речовини m, dnm – зміна (“+” або “-”) числа молей речовини m.
При цьому U=1 N uкінетична+1 N uпотенційна+N u0, де uкінетична – кінетична енергія поступального, коливального і обертального руху однієї молекули, яка залежить від температури тіла; uпотенційна – потенційна енергія взаємодії молекул між собою, яка залежить від відстані між молекулами (від молекулярного об’єму тіла), u0 – енергія внутрішньоатомних рухів за температури рівної абсолютному нулю. Таким чином U є функцією температури, тиску і хімічного складу тіла.
З врахуванням того що dA=p dV+dA’ (де: p – тиск, dV – зміна об’єму, dA’ – вся інша, “корисна робота” – електрична, перенесення енергії в хімічних реакціях, подолання поверхневого натягу тощо), рівняння 9.1 можна записати як
d’Q=dU+p dV+dA’ 9.3
Окремі випадки процесів:
1)Ізохорний процес (V=const): QV= UV=CV (T2-T1), де СV - теплоємність системи;
2)Ізобарний процес (P=const): QP= H=U+p V, де H (ентальпія) - загальна енергія системи, яка дорівнює сумі внутрішньої енергії та потенційної енергії тиску;
CP= H/(T2-T1)= dH/dT;
CP=CV+p ( V/ T)P;
для 1 моля ідеального газу cP=cV+R;
де R - універсальна газова постійна (8,31441 Дж К-1 моль-1).
3)Ізотермічний процес (T=const): d’Q=p dV; QT=1 2p dV; ( H= U=0) CT= d’Q/dT= ;
143

144
4)Адіабатичний процес (dQ=0): 0= dU+p dV; або p dV=- dU; (спрямована проти зовнішніх сил робота системи виконується за рахунок внутрішньої енергії)
CS=d’Q/dT=0;
Закон Гесса
(Герман Іванович Гесс, 1802-1850, професор гірничого інституту в Петербурзі).
Тепловий ефект хімічних реакцій, які відбуваються або при постійному зовнішньому тиску, або при постійному об’ємі системи, не залежить від проміжних стадій процесу, а залежить лише від виду і стану вихідних і кінцевих речовин реакції.
Тобто для любої реакції тепловий ефект дорівнює різниці між сумами теплот утворення продуктів реакції і вихідних реагентів.
2-е начало термодинаміки
"Природа в своїх процесах спрямована від менш вірогідних станів до більш вірогідних станів" Л.Больцман
Термодинамічна вірогідність ( ) - це число мікростанів системи завдяки яким реалізується даний макростан.
В якості міри термодинамічної вірогідності системи використовують ентропію: S=f( ). Згідно до Л.Больцмана:
S=k ln +C 9.4
де: k – постійна Больцмана (1,38 1023 Дж/К), а C - невідома постійна інтегрування.
d’Q/dT S |
9.5 |
що для ізольованих систем дає: |
|
dS 0 |
9.6 |
Звідси слідує більш вузьке і конкретне визначення 2-го начала термодинаміки: в ізольованих системах можуть відбуватися лише такі процеси, за яких ентропія системи зростатиме, а сам процес відбуватиметься до тільки до такого стану, за якого ентропія досягає максимально можливого для даних умов значення.
Спільний для 1-го і 2-го начала термодинаміки вираз виглядає так:
dU T dS-d’A 9.7
або, для випадку механічної роботи
dU T dS-p dV 9.8
Постулати Нернста і Планка. 3-е начало термодинаміки.
Постулат Нернста: при зменшенні температури ентропія наближається до визначеного значення
(S0).
Завдяки цьому постулату можна розраховувати ентропію за величиною теплоємності речовини:
144
145
ST |
T |
CP dT |
|
S0 |
9.9 |
|
|
|
|||||
|
0 |
|
T |
|
||
ST |
T |
CV dT |
S0 |
9.10 |
||
|
|
|||||
|
0 |
|
T |
|
||
Постулат Планка: при зменшенні температури до абсолютного нуля ентропія всіх речовин стає однаковою і дорівнює 0. (при T=0 S0=0).
Ентропії всіх тіл при пониженні температури зменшуються і приймають однакову для всіх речовин нульову величину при температурі абсолютного нуля.
Постулат Капустинського.
Постулат А.Ф.(?)Капустинського базується на добре відомому співвідношенні:
( S/ V)T=( P/ T)V 9.11
Звідки
( S/ P)T=-( V/ T)P
Відомо що ( V/ T)P>0, тож:
( S/ P)T<0 9.12
Звідси робимо висновок що із зростанням тиску ентропія системи зменшується а із зменшенням - зростає. Отож постулат А.Ф.(?)Капустинського:
Ентропії всіх речовин при рості тиску і їх ущільненні зменшуються, межею
зменшення ентропії для деякого надвисокого тиску є її значення рівне 0. (при P=
S0=0)
З точки зору Капустинського вже тиску в 1 млн атмосфер достатньо для вирівнювання теплових властивостей речовин і переходу їх в такий мінімальний об’єм, в такий стан коли ентропії починають наближатися до нульового значення.
За гіпотезою А.Ф.Капустинського (який розвинув і обгрунтував ідеї В.М.Лодочнікова, 1935; W.Kuhn and A.Rittman, 1941; W.H.Ramsey, 1948), у земному ядрі, внаслідок величезного тиску, порушується електронна структура атомів. Починаючи з K, електронна структура якого 1s22s2p63s2p6d04s1, виникають умови для вдавлювання в умовах високих тисків зовнішніх електронів на незаповнений 3dрівень. Так, зовнішні 4s2 електрони кальцію, будучи “втиснутими” на рівень 3d, перетворюють його на атом ізокальцію, властивості якого подібні до двовалентного титану. Аналогічний перехід для двохвалентного заліза - d64s2 -> d84s0, призводить до утворення ізозаліза, властивості якого подібні до двохвалентного нікелю. Зникає хімічна індивідуальність атомів і всі елементи одержують однакові металізовані властивості (речовина складається з ядер атомів, що знаходяться в загальній для всіх ядер електронній плазмі). Це визначає одноманітність земного ядра, відсутність розходжень між хімічними елементами (зона «нульового хімізму», «центросфера»). У мантії під впливом сильного тиску змінюються хімічні властивості атомів, тому що електрони переходять на незаповнені внутрішні орбіти. Це зона «виродженого хімізму», або «інтерсфера» (речовина близька до металевого стану, хоча й має силікатний склад). Хімічні ж властивості елементів, що відповідають їх положенню в періодичній системі, виявляються тільки в зоні «нормального хімізму», або «перисфері», яка відповідає земній корі і верхам мантії (верхні 100 км). Таким чином, згідно точки зору Капустинського внутрішня зони планети відрізняються не складом, а станом речовини в умовах величезних тисків.
Термодинамічні функції
При вивченні міграції дуже часто виникає питання про теоретичну можливість реакції в умовах даної температури, тиску і концентрації. Тобто питання полягає у визначенні наявності хімічної
145
146
спорідненості (здатності елементів вступати в хімічні реакції). Згідно відомого "принципу Бертло" (відкритий у 1867 р. французьким хіміком М.Бертло) з усіх можливих в даній системі реакцій відбувається та, виділення тепла при якій найбільше. На жаль цей принцип не універсальний, оскільки відомі самочинні реакції які відбуваються з поглинанням теплоти.
У 80-х роках ХІХ сторіччя У.Гібс (1878), Г.Гельмгольц (1884) та Я.Вант-Гофф (1885) довели що мірилом хімічної спорідненості є не тепловий ефект, а максимальна робота реакції проведеної в умовах ізотермічного зворотного процесу. Ця величина, яку називають "вільною енергією Гібса", "вільною енергією", "функцією Гіббса", "ізобарним потенціалом", "ізотермо-ізобарним потенціалом", і позначають G, F або Z, залежить від природи реагуючих речовин, температури, тиску, вихідних концентрацій (активностей).
Функція Гібса є одною з найвживаних функцій в петрології. Величина вільної енергії тісно пов’язана з ентальпією та ентропією:
G = H - T S; |
9.13 |
Одиницею вільної енергії та ентальпії є кал/моль (кДж/моль), а ентропіїкал/(моль K) або кДж/(моль K).
------------------------------------
Ентальпія (тепломісткість, теплородність) – 1) балансна енергія, яка характеризує різницю між енергіями зв’язку і розриву з’єднання, 2) загальна енергія системи, яка дорівнює сумі внутрішньої енергії та потенційної енергії тиску.
Ентальпія елементів в стандартних умовах (при t=20-25 C, і P=105 Па=1 атм.) прирівнюється до 0. Всі інші енергетичні стани є різницею ентальпій, тобто є відносною енергетичною величиною нестійкого стану. Ця величина називається приростом ентальпії і позначається через H.
Наприклад, молекулярний водень характеризується приростом ентальпії H=0, а атомарний водень має H = 52089 кал =218 кДж (1 кал = 4,1855 Дж). Відповідно, при переході 2H H2 балансна енергія буде зменшуватись на 0-2 52089 кал = -104078 кал (436 кДж), тобто для підтримки атомарного стану водню необхідно щоб він мав енергію на 104078 кал більшу, ніж молекулярний водень.
В залежності від виду часток, стану і характеру зв’язків, маси часток та інших чинників, направлена на розрив енергія теплового руху у різних часток, за однієї і тієї ж температури, може бути відмінною (наприклад атомарний та молекулярний водень). Тому, для розрахунку енергії переходу молекулярного водню в атомарний стан, крім обрахованої енергії необхідно ще врахувати поправку на енергетичну зміну коливального руху у зв’язку із зміною стану часток. Така поправка є поправкою на ступінь невпорядкованості часток і називається приростом ентропії
- S.
Для атомарного водню в кристалічному стані при абсолютному нулі ентропія дорівнює 0. Із зростанням температури на 1 градус ентропія зростає на 27,393 кал/моль, а для молекулярного водню - на 31,211 кал/моль. Виходячи з цього (для реакції 2H H2):
S = 31,211 - 2 27,393 = -23,575 кал/(град моль)
Отримана величина показує, що переході атомарного водню в молекулярний для збереження тої ж інтенсивності теплового руху необхідно енергії на 23,575 кал більше на кожен градус.
Якщо реакція відбувається при t=20 C (тобто Т=273,16+20=293,16К), то необхідна для розриву енергія зменшиться на 293,16 (-23,575)=-6911,247 кал. Віднімаючи отриману поправку визначаємо той надлишок енергії що виділяється в результаті реакції 2H H2.
146
147
--------------------------------
В загальному випадку, для будь-якої хімічної реакції типу
b B + c C <=> d D + e E |
9.14 |
зміна вільної енергії між кінцевими і початковими речовинами в реакції визначається співвідношенням (за постійної температури):
G = H - T S; |
9.15 |
де H - приріст ентальпії, T - температура, а S - приріст ентропії.
За визначенням, якщо G від’ємний, то енергія виділяється і реакція може відбутися самочинно (спонтанно), а якщо позитивний – спонтанна реакція неможлива, необхідні додаткові затрати енергії.
Для наведеного вище прикладу щодо перетворення атомарного водню в молекулярний маємо:
G = H – T S = -104078-(-6911,247)= -97167 кал
Величину G можна розглядати як енергію що вивільняється при утворенні з’єднання. Саме вивільнення енергії свідчить про те, що в новоутвореному з’єднанні зв’язки міцніші.
Величина вільної енергії залежить від кількості присутньої речовини, тому при визначенні G слід враховувати коефіцієнти концентрацій речовин:
Gреакції+b GB + c GC <=> d GD + e GE |
9.16 |
Величини вільних енергій можуть бути отримані з довідників, в яких, зазвичай, наводяться величини стандартної вільної енергії утворення G0, тобто вільної енергії реакції утворення одного моля компонента в певному стандартному стані з чистих елементів які теж перебувають в стандартних станах. Застосовують різні варіанти стандартного стану, найуживаніший з них (зокрема в довідниках): температура - 298,15К (25 C), тиск - 1 атм. (1,013 бар, або 101,325 кПа), активність реагуючої речовини - 1. В експериментальній петрології часто працюють з стандартними станами при тиску 1 бар і необхідній температурі. За визначенням, чисті елементи в їх стандартному стані мають нульову ентальпію утворення.
При рівновазі вільна енергія закритої системи є мінімальною, а G=0. Саме ця умова є критерієм рівноваги.
Відомо, що будь-яка система, яка не перебуває в стані рівноваги, буде самочинно змінюватись з вивільненням енергії.
Якщо розглядати всі перелічені вище реакції в "стандартних умовах" (тобто: температура - 298,15К, тиск - 1 атм, активність реагуючої речовини - 1), то вільна енергія будь-якої реакції, яка в нашому випадку буде названа також "стандартною", є різницею суми вільних енергій продуктів реакції в їх стандартному стані та суми вільних енергій утворення реагентів в їх стандартному стані:
G реакції = G утворення продуктів реакції - G утворення реагентів |
9.17 |
Таким чином, для з’ясування можливості реакції необхідно: 1) написати цю реакцію; 2) за довідниками визначити G0 кожного реагенту; 3) від суми вільних енергій кінцевих продуктів реакції відняти суму вільних енергій вихідних продуктів.
Від’ємна величина G свідчитиме про можливість реалізації реакції в заданому напрямку, а позитивна - про можливість самочинної реакції протилежного напрямку.
Крім вільної енергії при аналізі багатокомпонентних систем використовується також хімічний потенціал. В системі, яка складається з одного компонента І хімічний потенціал ( і) є вільною енергією 1 моля речовини. А для багатокомпонентної системи
147
148
Gсист = j Nj |
9.18 |
де Nj - число молів j-того компоненту.
Для відкритих систем часто застосовується наступний вираз для вільної енергії:
Gсист =-S dT+V dp+1 m m dnm |
9.19 |
Хімічний потенціал компоненту не залежить від маси системи, а в рівноважній системі він має одну й ту ж величину у всіх фазах системи. Наприклад, якщо у рівновазі співіснують олівін ((Mg,Fe)2SiO4) та ортопіроксен ((Mg,Fe)SiO3), то хімічний потенціал заліза і в олівіні і в піроксені рівні.
До речі, саме градієнти хімічних потенціалів в нерівноважних системах є рушійною силою реакцій спрямованих на досягнення рівноважного стану.
Ентальпія, ентропія та вільна енергія залежать від температури і тиску. Зміну ентальпії при зміні температури при постійному тиску можна записати як:
dH = CP dT; |
9.20 |
Де CP - коефіцієнт пропорційності, який називають молярною теплоємністю і який є характеристикою даної речовини. Оскільки він сам є залежним від температури то слід підставити в рівняння (9.20) наступний емпіричний вираз:
|
2 |
; |
9.21 |
CP =a+b T+c/T |
|
||
де a, b і c - експериментально визначені для кожної речовини константи (теж наводяться в довідниках).
Інколи використовують більш складе рівняння Haas-Fisher:
|
2 |
2 |
+g/T |
1/2 |
; |
9.21а |
CP =a+b T+c/T |
|
+fT |
|
|
Інтегруємо (9.20) по температурі з врахуванням (9.21) і отримуємо мольну ентальпію при певній заданій температурі і постійному тиску:
|
|
2 |
T |
|
|
9.22 |
H(T) = H +[a T+b T |
/2-c/T] 298; |
|
||||
аналогічно, для ентропії: |
|
|
|
|
|
|
|
|
|
2 |
T |
298; |
9.23 |
S(T) = S + [a lnT + b T - c/(2 T |
)] |
|
||||
Таким чином, зміну вільної енергії в залежності від температури при постійному тиску можна отримати підставивши рівняння 9.22-9.23 в рівняння (9.13).
В закритій системі зміна вільної енергії при зміні температури і тиску дорівнює:
G= V dP -S dT; |
9.24 |
Ізотермічна залежність G від тиску може бути описана рівнянням
( G/ P)T=V |
9.25 |
Зміна об’єму при зміні температури і тиску визначається із використанням коефіцієнта об’ємного розширення ( ) та коефіцієнта стиснення ( ) речовини:
dV=V ( dTdP) |
9.26 |
Вказані коефіцієнти тісно пов’язані з теплоємністю речовин:
CP-CV=T Vсистеми? 2/ |
9.27 |
148
149
В більшості термодинамічних розрахунків при моделюванні геологічних процесів в земній корі достатньо виправдано використовують припущення що зміна об’єму твердих фаз в реакціях в закритих системах не залежить від тиску та температури. Вираз (9.24) можна використати для отримання рівняння що характеризує нахил межі між двома станами системи - А і В:
GB - GA = (VB-VA) dP - (SB-SA) dT; |
9.28 |
||||||
Оскільки ж на межі GB - GA =0 то ми отримуємо рівняння відоме під назвою рівняння Клаузіса- |
|||||||
Клапейрона: |
|
|
|
|
|
|
|
|
dP |
|
SB SA |
|
S |
|
9.29 |
|
dT |
VB VA |
V |
|
|||
|
|
|
|
||||
Для практичних потреб зміну вільної енергії системи при реакції в довільних умовах можна розрахувати наступним чином:
Gреакції= {( nm G m)кінцева- 9.30
( nk G k)початкова} - { S реакції (T-298)+a ln(T/298)+ b (T-298)+ c [1/(2 T2)- (1/298)2]} + { n R T ln(p2/p1)+ V (p2-p1)}
( S реакції, a, b і c розраховуються за типовою формулою -
X= {( nm Xm)кінцева-( nk Xk)початкова
Термодинамічні розрахунки були б малоефективними без використання одної з ключових функцій статистичної механіки і квантової фізики - так званої функції розподілу (partition function). Адже саме ця функція дозволяє встановити зв’язок (відповідність) між макро і мікростанами речовини (який власне й описують термодинамічні функції).
Q= e- i/k T |
9.31 |
де k - постійна Больцмана (1,38 1023 Дж/К), (k NA=R- газова постійна - 8,31441 Дж К-1 моль-1). Звідси ми можемо отримати закон розподілу Больцмана:
i=e- i/k T/ e- i/k T |
9.32 |
|||
Можна записати наступні вирази: |
|
|||
для величини внутрішньої енергії |
|
|||
2 |
( |
|
|
9.33 |
U=RT |
|
lnQ/ T)V |
|
|
для ентропії: |
|
|
|
|
S=U/T+RlnQ |
9.34 |
|||
149
150
Таблиця 9.1 - Значення термодинамічних функцій для деяких поширених мінералів (за ).
Фаза/ |
Формула |
H°f, |
S°, |
G°f, |
V, |
|
CP |
|
|
назва |
|
кДж/моль |
Дж/(К*моль) |
кДж/моль |
см3/моль* |
a |
b |
c |
|
Водяна пара |
H2O(газ) |
-241.81 |
188.74 |
-228.57 |
24789.00 |
30.54 |
0.01029 |
0 |
|
Вода |
H2O(рідина) |
-285.84 |
69.92 |
-237.18 |
18.10 |
29.75 |
0.03448 |
0 |
|
Вуглекислий |
CO2 |
-393.51 |
213.64 |
-394.39 |
24465.10 |
44.22 |
0.00879 |
861904 |
|
газ |
|
|
|
|
|
|
|
|
|
Кальцит |
CaCO3 |
-1207.30 |
92.68 |
-1130.10 |
36.93 |
104.52 |
0.02192 |
2594080 |
|
Арагоніт |
CaCO3 |
-1207.21 |
90.21 |
-1129.16 |
34.15 |
84.22 |
0.04284 |
1397456 |
|
-кварц |
SiO2 |
-910.65 |
41.34 |
-856.24 |
22.69 |
46.94 |
0.03431 |
1129680 |
|
- кварц |
SiO2 |
-910.25 |
41.82 |
-856.24 |
|
60.29 |
0.00812 |
0 |
|
Кристобаліт |
SiO2 |
-853.10 |
43.40 |
-853.10 |
25.74 |
58.49 |
0.01397 |
1594104 |
|
Коесіт |
SiO2 |
-851.62 |
40.38 |
-851.62 |
20.64 |
46.02 |
0.00351 |
1129680 |
|
Периклаз |
MgO |
-601.66 |
26.94 |
-569.38 |
11.25 |
42.59 |
0.00728 |
619232 |
|
Магнетит |
Fe3O4 |
-1118.17 |
145.73 |
-1014.93 |
44.52 |
91.55 |
0.20167 |
0 |
|
Шпінель |
MgAl2O4 |
-2288.01 |
80.63 |
-2163.15 |
39.71 |
153.86 |
0.02684 |
4062246 |
|
Гематит |
Fe2O3 |
-827.26 |
87.61 |
-745.40 |
30.27 |
98.28 |
0.07782 |
1485320 |
|
Corundum |
Al2O3 |
-1661.65 |
50.96 |
-1568.26 |
25.58 |
11.80 |
0.03506 |
3506192 |
|
Кіаніт |
Al2SiO5 |
-2581.10 |
83.68 |
-2426.91 |
44.09 |
173.18 |
0.02853 |
5389871 |
|
Андалузит |
Al2SiO5 |
-2576.78 |
92.88 |
-2429.18 |
51.53 |
172.84 |
0.02633 |
5184855 |
|
Силіманіт |
Al2SiO5 |
-2573.57 |
96.78 |
-2427.10 |
49.90 |
167.46 |
0.03092 |
4884443 |
|
Альмандин |
Fe3Al2Si3O12 |
-5265.5 |
339.93 |
-4941.73 |
115.28 |
408.15 |
0.14075 |
7836623 |
|
Гросуляр |
Ca3Al2Si3O12 |
-6624.93 |
254.68 |
-6263.31 |
125.30 |
435.21 |
0.07117 |
11429851 |
|
Альбіт |
NaAlSi3O8 |
-3921.02 |
210.04 |
-3708.31 |
100.07 |
258.15 |
0.05816 |
6280184 |
|
К-ПШ |
KAlSi3O8 |
-3971.04 |
213.93 |
-3971.4 |
108.87 |
320.57 |
0.01804 |
12528988 |
|
Анортит |
CaAl2Si2O8 |
-4215.60 |
205.43 |
-3991.86 |
100.79 |
264.89 |
0.06190 |
7112800 |
|
Жадеїт |
NaAlSi2O6 |
-3011.94 |
133.47 |
-2842.80 |
60.44 |
201.67 |
0.04770 |
4966408 |
|
Діопсид |
CaMgSi2O6 |
-3202.34 |
143.09 |
-3029.22 |
66.09 |
221.21 |
0.03280 |
6585616 |
|
Енстатит |
MgSiO3 |
-1546.77 |
67.86 |
-1459.92 |
31.28 |
102.72 |
0.01983 |
2627552 |
|
Форстерит |
Mg2SiO4 |
-2175.68 |
95.19 |
-2056.70 |
43.79 |
149.83 |
0.02736 |
3564768 |
|
Кліноцоізит |
Ca2Al3Si3O12(OH) |
-68798.42 |
295.56 |
-6482.02 |
136.2 |
787.52 |
0.10550 |
11357468 |
|
Тремоліт |
Ca2MgSi8O22(OH)2 |
-12319.70 |
548.90 |
-11590.71 |
272.92 |
188.22 |
0.05729 |
4482200 |
|
Хлорит |
MgAl(AlSi3)O10(OH)8 |
-8857.38 |
465.26 |
-8207.77 |
207.11 |
696.64 |
0.17614 |
15677448 |
|
Pargasite |
|
NaCa2Mg4Al3Si8O22(O |
-12623.40 |
669.44 |
-11950.58 |
273.5 |
861.07 |
0.17431 |
21007864 |
|
|
H)2 |
|
|
|
|
|
|
|
Флогопіт |
KMg3AlSi3O10(OH)2 |
-6226.07 |
287.86 |
-5841.65 |
149.66 |
420.95 |
0.01204 |
8995600 |
|
Мусковіт |
KAl3Si3O10(OH)2 |
-5972.28 |
287.86 |
-5591.08 |
140.71 |
408.19 |
0.110374 |
10644096 |
|
Гібсит |
Al(OH)3 |
-1293.13 |
70.08 |
-1155.49 |
31.96 |
36.19 |
0.19079 |
0 |
|
Беміт |
AlO(OH) |
-983.57 |
48.45 |
-908.97 |
19.54 |
60.40 |
0.01757 |
0 |
|
Брусит |
Mg(OH)2 |
-926.30 |
63.14 |
-835.32 |
24.63 |
101.03 |
0.01678 |
2556424 |
|
Дані наведені для стандартного стану (298.15 K і 0.1 МПа). H°f - стандартна ентальпія утворення сполуки; S° - ентропія в стандартному стані; V - молярний об’єм; a, b і c - константи для обрахунку теплоємності (при постійному тиску) в рівнянні: Cp = a+bT–cT-2 (Дж/K*моль). За Helgeson та інші (1978), із змінами.
*см3/моль=Дж/МПа
150
