
- •Міністерство освіти і науки україни
- •Частина і. Термодинаміка
- •1.1 Основи термодинаміки
- •1.1.1 Основні поняття технічної термодинаміки. Основні термодинамічні параметри. Рівняння стану.
- •1.1.2 Газові суміші
- •1.1.3 Калоричні параметри стану
- •1.1.4 Ентропія
- •1.1.4.1 Робота зміни об’єму
- •1.1.5 Робота і теплота
- •1.1.6 Перший закон термодинаміки
- •1.1.7 Теплоємність
- •1.1.8 Теплоємність металів і металовмісних сполук
- •1.1.9 Термодинамічні процеси ідеальних газів у закритих системах
- •Політропний процес
- •1.1.10 Другий закон термодинаміки
- •Цикл Карно
- •1.1.11 Формулювання другого закону термодинаміки
- •1.2 Основи хімічної кінетики
- •1.2.1 Швидкість хімічних реакцій
- •1.2.2 Вплив температури на швидкість хімічних реакцій
- •1.2.3 Хімічна рівновага
- •1.2.4 Константа рівноваги хімічної реакції залежить від температури.
- •1.3 Основи хімічної термодинаміки, поняття хімічної термодинаміки
- •1.3.1 Основи хімічної термодинаміки
- •1.3.2 Закон Гесса і його наслідки
- •1.3.3 Залежність теплового ефекту хімічної реакції від температури. Закон Кірхгофа
- •1.4 Деякі явища в рідних середовищах і на поверхні розподілу фаз
- •1.4.1 Розчинність газів
- •1.4.2 Розподіл компонента між двома рідинами
- •1.4.3 Поверхневий натяг
- •1.4.4 Адсорбція
- •1.4.5 Умова змочування і незмочування рідин
- •1.4.6 Дисоціація окисів
- •2 Теплообмін при зварюванні
- •2.1 Теплопровідність
- •2.1.1 Теплопровідність під час стаціонарного режиму і граничних умов 1 роду
- •2.1.2 Частинні випадки рівняння теплопровідності
- •Крайові умови
- •2.1.3 Теплопровідність за наявності внутрішніх джерел теплоти
- •Необмежена пластина
- •Циліндричний стержень
- •2.1.4 Необмежена плоска стінка
- •2.1.5 Циліндрична стінка
- •2.1.6 Теплопровідність під час стаціонарного режиму і граничних умовах III роду (теплопередача)
- •2.1.7 Теплопередача через плоску стінку
- •Розв'язання
- •2.2 Конвективний теплообмін
- •2.2.1 Основні поняття та визначення конвективного теплообміну
- •2.2.2 Узагальнюючі залежності (рівняння подібності) конвективного теплообміну
- •2.3 Теплообмін випроміненням
- •2.3.1 Основні поняття і визначення
- •2.3.3 Випромінення сірих тіл
- •2.3.4 Теплообмін випроміненням між твердими тілами
- •2.3.5 Теплові екрани
- •2.3.6 Випромінення газів
- •Перелік використаних і рекомендованих джерел
1.1.2 Газові суміші
Суміш ідеальних газів, які хімічно не взаємодіють між собою, називається ідеальною газовою сумішшю. Відповідно до закону Дальтона

де Pi – парціальний тиск i-го компонента суміші;
Pn – тиск суміші.
Склад газової суміші може задаватись масовими g, об’ємними частками r. Під масовою часткою розуміють відношення маси компонента газу до маси суміші газу

Відношення парціального об’єму Vi компонента газу до об’єму суміші газу Vc називається об’ємною часткою компонента газової суміші
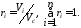
Виходячи із визначення парціального об’єму, за законом Бойля-Маріотта можна записати

Якщо склад газової суміші заданий об’ємними частками, молярну масу суміші знаходять за формулою

А в тому випадку, коли заданий масовий склад суміші, молярну масу знаходять за формулою

Питома газова стала суміші заданої масовими частками може бути обчислена за формулою
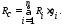
Якщо суміш задана об’ємними частками, газову сталу визначають за формулою

Співвідношення між газовими і об’ємними частками газової суміші

1.1.3 Калоричні параметри стану
До калоричних параметрів стану відноситься внутрішня енергія, ентальпія і ентропія. Термодинамічна система в кожному стані має енергію E, що включає зовнішню енергію Езов , яка складається з енергії системи в полі зовнішніх сил, а також внутрішньої енергії U.
Якщо рух системи відсутній і зміна її потенціальної енергії дорівнює нулеві, то повна енергія системи буде дорівнювати її внутрішній енергії. Внутрішня енергія складається з кінетичної енергії Uк поступального, обертального руху молекул і коливального руху атомів, а також потенціальної енергії UП сил взаємодії між молекулами.
Кінетична енергія руху молекул залежить від температури T, потенціальна енергія залежить від середньої відстані між молекулами, тобто від об’єму газу V. Оскільки T і V є параметрами стану, то внутрішня енергія є також функцією стану робочого тіла. Для будь-яких двох параметрів, що визначають цей стан, можна записати:

Внутрішня енергія одиниці маси речовини

називається питомою внутрішньою енергією (Дж/кг).
Оскільки внутрішня енергія – калоричний параметр стану, її зміна не залежить від термодинамічного шляху процесу, а визначається тільки початковими і кінцевими станами системи

Для кругового процесу

Внутрішня енергія реального газу залежить від температури і об’єму тіла, а внутрішня енергія ідеального газу залежить тільки від температури тіла. Внутрішня енергія є екстенсивним параметром стану, тому вона має властивість адитивності, відповідно до якої внутрішня енергія термодинамічної системи дорівнює сумі внутрішніх енергій її складових частин
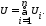
Внутрішню енергію при t = 0 °C вважають рівною нулеві.
При термодинамічних розрахунках широко використовується ентальпія

Для системи, що містить 1 кг робочого тіла, питому ентальпію знаходять за формулою

Величини, що входять до даної формули, є функціями стану, тому ентальпія є також функцією стану. З цього випливає, що dh є повний диференціал, а це означає, що її зміна не залежить від характеру процесу, а визначається початковими і кінцевими станами системи:

Для кругового
процесу
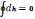
 .
.
При t = 0 °C значення ентальпії і внутрішньої енергії вважають рівним нулеві.
