
- •Міністерство освіти і науки україни
- •Частина і. Термодинаміка
- •1.1 Основи термодинаміки
- •1.1.1 Основні поняття технічної термодинаміки. Основні термодинамічні параметри. Рівняння стану.
- •1.1.2 Газові суміші
- •1.1.3 Калоричні параметри стану
- •1.1.4 Ентропія
- •1.1.4.1 Робота зміни об’єму
- •1.1.5 Робота і теплота
- •1.1.6 Перший закон термодинаміки
- •1.1.7 Теплоємність
- •1.1.8 Теплоємність металів і металовмісних сполук
- •1.1.9 Термодинамічні процеси ідеальних газів у закритих системах
- •Політропний процес
- •1.1.10 Другий закон термодинаміки
- •Цикл Карно
- •1.1.11 Формулювання другого закону термодинаміки
- •1.2 Основи хімічної кінетики
- •1.2.1 Швидкість хімічних реакцій
- •1.2.2 Вплив температури на швидкість хімічних реакцій
- •1.2.3 Хімічна рівновага
- •1.2.4 Константа рівноваги хімічної реакції залежить від температури.
- •1.3 Основи хімічної термодинаміки, поняття хімічної термодинаміки
- •1.3.1 Основи хімічної термодинаміки
- •1.3.2 Закон Гесса і його наслідки
- •1.3.3 Залежність теплового ефекту хімічної реакції від температури. Закон Кірхгофа
- •1.4 Деякі явища в рідних середовищах і на поверхні розподілу фаз
- •1.4.1 Розчинність газів
- •1.4.2 Розподіл компонента між двома рідинами
- •1.4.3 Поверхневий натяг
- •1.4.4 Адсорбція
- •1.4.5 Умова змочування і незмочування рідин
- •1.4.6 Дисоціація окисів
- •2 Теплообмін при зварюванні
- •2.1 Теплопровідність
- •2.1.1 Теплопровідність під час стаціонарного режиму і граничних умов 1 роду
- •2.1.2 Частинні випадки рівняння теплопровідності
- •Крайові умови
- •2.1.3 Теплопровідність за наявності внутрішніх джерел теплоти
- •Необмежена пластина
- •Циліндричний стержень
- •2.1.4 Необмежена плоска стінка
- •2.1.5 Циліндрична стінка
- •2.1.6 Теплопровідність під час стаціонарного режиму і граничних умовах III роду (теплопередача)
- •2.1.7 Теплопередача через плоску стінку
- •Розв'язання
- •2.2 Конвективний теплообмін
- •2.2.1 Основні поняття та визначення конвективного теплообміну
- •2.2.2 Узагальнюючі залежності (рівняння подібності) конвективного теплообміну
- •2.3 Теплообмін випроміненням
- •2.3.1 Основні поняття і визначення
- •2.3.3 Випромінення сірих тіл
- •2.3.4 Теплообмін випроміненням між твердими тілами
- •2.3.5 Теплові екрани
- •2.3.6 Випромінення газів
- •Перелік використаних і рекомендованих джерел
1.4 Деякі явища в рідних середовищах і на поверхні розподілу фаз
1.4.1 Розчинність газів
Розглянемо
систему, яка складається із двох фаз і
газоподібної, при цьому один із компонентів
газової фази може розчинятись у рідині.
Рівновага наступить тоді коли швидкість
розчеплення цього компонента ( газу ) в
рідкій фазі
 дорівнює
швидкості входу цього компонента із
розчину
дорівнює
швидкості входу цього компонента із
розчину .
Очевидно, що за заданої температури
швидкість розчинення газу в рідині
пропорційна його парціальному тиску,
тобто
.
Очевидно, що за заданої температури
швидкість розчинення газу в рідині
пропорційна його парціальному тиску,
тобто ,
а швидкість виділеного газу з рідини
пропорційна його концентрації в рідкій
фазі
,
а швидкість виділеного газу з рідини
пропорційна його концентрації в рідкій
фазі ,
,
тоді
 ,
,
де
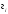 -
константа Генрі, вона дорівнює розчинності
газу при тиску
-
константа Генрі, вона дорівнює розчинності
газу при тиску
Константа Генрі залежить від температури:
 ,
,
 -
зміна ентропії при розчиненні.
-
зміна ентропії при розчиненні.
1.4.2 Розподіл компонента між двома рідинами
Якщо в гетерогенну систему, яка складається з двох рідин які не змішуються між собою, ввести третю речовину, яка розчиняється в обох рідинах, то ця речовина розподіляється між рідинами за законом розподілу, який формулюється так: відношення концентрації речовини розподіленої між собою двома рідинами, які не змішуються між собою, є величиною сталою і не залежить від температури. Математично цей закон можна записати:
 ,
,
де
 -
концентрація розчиненої речовини в
першому розчиннику;
-
концентрація розчиненої речовини в
першому розчиннику;
 -
концентрація розчиненої речовини в
другому розчиннику;
-
концентрація розчиненої речовини в
другому розчиннику;
На законі розподілу ґрунтується екстракція речовини із розчину за формулою іншого розчина. Нехай в V мл розчину міститься до грамів екстрагованої речовини. Ця кількість розчину змішується в Vв мл розчина. Після одноразової екстракції в початковому розчині залишається q, грамів екстрагованої речовини.

З цього рівняння випливає:

Після другої екстракції таким самим об’ємом Vb мл cвіжого розчинника, кількість речовини, яка залишається в першому розчиннику.

Після
повторних екстракцій однаковим об’ємом
Vb
мл
одного і того ж розчинника, кількість
 речовини, яка залишається в вихідному
розчині.
речовини, яка залишається в вихідному
розчині.


Користуючись законом розподілу, можна із розплаву виділяти сірку фосфор та інші домішки металу.
1.4.3 Поверхневий натяг
На
границі розподілу фаз властивості фази
відрізняються від властивостей цієї ж
фази на віддалі від границі розділу. У
центральних об’ємах
фази кожна частинка зрівноважена дією
оточуючих її частин, у той час як у
периферійній області взаємодія
поверхневих частин не зрівноважена. У
цьому випадку виникають сили поверхневого
натягу, які намагаються зменшити зовнішню
поверхню. Величина поверхневого натягу
має одиницю вимірювання
 і позначається буквою
і позначається буквою .
.
Поверхневий
натяг
 виражає
максимальну роботу утворення одиниці
поверхні і дорівнює зміні ізотермічного
потенціалу в даному процесі. При утворенні
поверхні площиною
виражає
максимальну роботу утворення одиниці
поверхні і дорівнює зміні ізотермічного
потенціалу в даному процесі. При утворенні
поверхні площиною
 зміна ізобарного потенціалу виражається
величиною:
зміна ізобарного потенціалу виражається
величиною:

де
 -
величина поверхні.
-
величина поверхні.
Для
будь-якого процесу
 ,
тому зміна ентропії при утворенні нової
поверхні можна виразити таким рівнянням:
,
тому зміна ентропії при утворенні нової
поверхні можна виразити таким рівнянням:


а зміна ентропії:

Внаслідок
того, що при підвищенні температури
поверхневий натяг зменшується
 ,
то
,
то .
Це означає, що утворення нової поверхні
супроводжується зростанням ентропії
і поглинанням теплоти.
.
Це означає, що утворення нової поверхні
супроводжується зростанням ентропії
і поглинанням теплоти.
Умовою
загального умовного самочинного
протікання процесу за постійних
температур і тиску є
 ;
стосовно поверхневих процесів
;
стосовно поверхневих процесів .
Звідси випливає, що поверхневі процеси
самочинно прозодять в сторону зменшення
поверхневої енергії. Поверхнева енергія
може зменшуватись під дією поверхнево
активних речовин.
.
Звідси випливає, що поверхневі процеси
самочинно прозодять в сторону зменшення
поверхневої енергії. Поверхнева енергія
може зменшуватись під дією поверхнево
активних речовин.
