
- •Справочный материал по Физиологии.
- •Глава 25 – Органы дыхания.
- •Внешнее дыханиЕ
- •Лёгочная вентиляция
- •Оценка функции внешнего дыхания
- •Альвеолярная вентиляция
- •Вентиляционно–перфузионные отношения
- •Контроль вентиляции
- •Функция внешнего дыхания и гомеостаз
- •Кислотно–щелочное равновесие
- •Гипоксия
- •Гиперкапния
- •Дыхательные адаптивные механизмы
- •Экстремальные состояния
- •Другие функции органов дыхания
- •Звукообразование и речь
- •Кондиционирование воздуха
- •Просвет воздухоносных путей
- •Иммунная защита
- •Метаболические функции лёгких
Вентиляционно–перфузионные отношения
Для оценки лёгочного газообмена, помимо характеристики перфузии (Q) и вентиляции (V), также важно вентиляционно-перфузионное отношение (VА/Q). Это отношение оценивают для отдельной альвеолы (в этом случае значениеVзаменяют наVA— альвеолярная вентиляция), для лёгких в целом (в этом случае значениеQравно значению сердечного выброса) и для участка лёгочной ткани.
Норма. В целом в лёгкихVА/Qсоставляет 0,8 (в норме допускается физиологический дисбалансV/Q, эквивалентный 2% шунтирования лёгочной артериальной крови напрямую в лёгочную венозную циркуляцию без газообмена).
НизкиезначенияVА/Qуказывают на неадекватную вентиляцию нормально снабжаемых кровью участков лёгкого. В результате происходит снижение Pao2(т.е. развивается гипоксемия).
Несмотря на окклюзию альвеол или их заполнение жидкостью, гипоксемия может быть скорригирована применением кислорода, поскольку произойдёт насыщение кислородом участков с альвеолярной гипоксией.
Если в участке лёгкого альвеолярная вентиляция отсутствует, то VА/Q= 0, т.е. газообмена нет. В результате происходитшунтированиекровисправаналево, т.е. венозная кровь смешивается с артериальной кровью. Эта форма гипоксемии устойчива к оксигенотерапии, поскольку кислород не достигает аэрогематического барьера.
† ВысокиезначенияVА/Qуказывают на адекватную вентиляцию слабо снабжаемых кровью участков лёгких. Уровень кислородного обмена низок, т.к. доступный Hb способен связать ограниченное количество кислорода (см. в главе 24).
Если в участке лёгкого нет кровотока, т.е. полностью отсутствует газообмен, то VА/Qравно бесконечности. Весь кислород уходит к участкам «мёртвого» альвеолярного пространства, что делает вентиляцию неэффективной.
Наличие «мёртвого» альвеолярного пространства приводит к задержке диоксида углерода и, следовательно, к гипоксии. Гиперкапния (повышенное Paco2) стимулирует дыхательный центр, усиливая дыхание и увеличивая вентиляцию, что нормализует Paco2, но не может увеличить сниженное Pao2.
Для пациентов с нарушениями VА/Qтипично снижение Po2, выраженное в большей степени, чем увеличение Pco2. Однако, Pco2 в дальнейшем возрастает, если лёгочная патология не позволяет увеличить вентиляцию. В результате возникает гипоксемия и гиперкапния, т.е. острая дыхательная недостаточность.
Альвеолярно-артериальныйградиентпокислороду— разница между альвеолярным Po2(РАо2) и артериальным Pco2(Раco2). При уменьшении альвеолярно-артериального градиента отношениеVА/Qувеличивается. Расчёт градиента помогает отличить гиповентиляцию от других причин гипоксемии и оценить тяжесть лёгочного заболевания.
Контроль вентиляции
Общая схема регуляции дыхания (вентиляции) приведена на рисунке 25–8. Функцию нервной регуляции дыхания выполняют дыхательные нейроны — множество нервных клеток, расположенных в стволовой части мозга. Контроль дыхательных движений (эфферентная нервная импульсация к дыхательным мышцам) осуществляется как непроизвольно(автоматический ритм дыхательных нейронов стволовой части мозга, на рисунке — «генератор ритма»), так ипроизвольно(в этом случае эфферентная нервная импульсация поступает к дыхательным мышцам, минуя дыхательные нейроны ствола мозга; на рисунке: «высшие отделы ЦНС»«спинной мозг»«дыхательные мышцы»). Адекватное функционирование этих и других контуров регуляции дыхания обеспечивает нормальное дыхание (эупноэ).
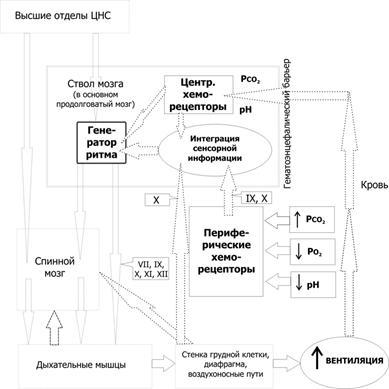
Рис.25–8.Нервныйконтрольвентиляции[2]. Связи между контролирующими (нервные центры), исполнительными (дыхательные мышцы) и чувствительными (хемо- и механорецепторы) блоками даны стрелками (в том числе пунктирными для восходящей — афферентной — импульсации, а точечными для нисходящей — эфферентной — импульсации). Римскими цифрами обозначены черепные нервы (VII — лицевой, содержит двигательные, чувствительные и парасимпатические волокна; IX — языкоглоточный, повреждение нерва сопровождается нарушением глотания, анестезией верхней трети глотки, снижением нёбных и глоточных рефлексов; X — блуждающий, содержит двигательные, чувствительные и вегетативные волокна; XI — добавочный, иннервирует грудино-ключично-сосцевидную и трапециевидную мышцы; XII — подъязычный, иннервирует мышцы языка, грудино-подъязычную, грудино-щитовидную и лопаточно-подъязычную мышцы). В правой части схемы стрелки относятся к крови в кровеносной системе. Жирным прямоугольником выделены структуры ствола мозга, паренхима которого отделена от циркулирующей крови гематоэнцефалическим барьером (см. рис. 25–11).
Регуляция дыхания направлена на выполнение двух задач: во-первых, автоматическаягенерациячастотыисилысокращениядыхательныхмышц, во-вторых,подстройкаритмаиглубиныдыхательныхдвиженийк реальным потребностям организма (в первую очередь, к изменениям метаболических параметров в видеPo2,Pco2иpH артериальной крови иPco2иpH межклеточной жидкости мозга).
Система регуляции дыхания состоит из 3 основных блоков: рецепторного (хемо- и барорецепторы, регистрирующие и передающие информацию в мозг), регуляторного, или контролирующего (совокупность дыхательных нейронов) и эффекторного (дыхательные мышцы, непосредственно осуществляющие вентиляцию лёгких). На рисунке 25–8 представлены образующие систему регуляции дыхания блоки — контролирующие(нервные центры),исполнительные(дыхательные мышцы),рецепторные(хемо- и механорецепторы) и связи между этими блоками. Таким образом, вся система регуляции дыхания состоит из нескольких взаимосвязанных регуляторных контуров.
Нервныецентрырасположены в стволе мозга (в основном, в составе продолговатого мозга). Схема регуляции дыхания предусматривает наличие генератора ритма дыхательных движений и центра интеграции сенсорной информации. Под терминами «генератор ритма» и «интегратор сенсорной информации» следует понимать абстрагированные интегральные понятия, а не конкретные нервные структуры, так как соответствие анатомических структур рассматриваемым понятиям установлено далеко не во всех случаях.
Генераторритмавключает нейроны, расположенные преимущественно в составе продолговатого мозга, а также моста и некоторых других отделов ствола мозга. Разные группы нейронов генерируют разного спектра пачки импульсов — потенциалы действия (ПД) — на разных фазах дыхательных движений, в то числе либо преимущественно во время вдоха (инспираторные нейроны), либо преимущественно во время выдоха (экспираторные нейроны). Карта расположения инспираторных и экспираторных нейронов в составе структур продолговатого мозга приведена на рисунке 25–9.
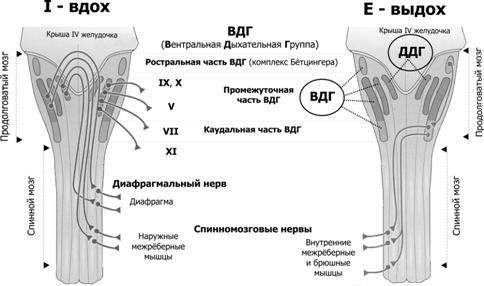
Рис.25–9.Инспираторные(слева,Inspiration)иэкспираторные(справа,Expiration)группынейроновиихсвязисдыхательнымимышцами[2]. Дорсальный (сзади) вид на продолговатый и спинной мозг (мозжечок удалён). Римскими цифрами обозначены черепные нервы. Вся совокупность дыхательных нейронов подразделяется с анатомической точки зрения на вентральную и дорсальную дыхательные группы (ВДГ и ДДГ соответственно). И ВДГ, и ДДГ представлены билатерально, т.е. дублированы.Дорсальнаядыхательнаягруппа(ДДГ) содержит преимущественно инспираторные нервные клетки (в том числе нейроны важного комплекса ядер вегетативной нервной системы — ядер одиночного пути, получающих сенсорную информацию от внутренних органов грудной и брюшной полостей по нервным волокнам языкоглоточного и блуждающего нервов).Вентральнаядыхательнаягруппа(ВДГ) содержит как инспираторные, так и экспираторные нейроны. В ростро–каудальном направлении ВДГ состоит из ростральной части — комплекс Бётцингера (содержит в основном экспираторные нервные клетки и в том числе позадилицевого ядра), промежуточной (содержит преимущественно инспираторные нейроны двойного и околодвойного ядер) и каудальной (экспираторные нейроны позадидвойного ядра) частей.Направлениеимпульсацииотдыхательныхнейронов: 1. от нервных клеток ДРГ к ВДГ, а также к премоторным нейронам, далее к мотонейронам и к основным инспираторным мышцам; 2. от промежуточной части ВДГ в конечном итоге к основным и вспомогательным инспираторным мышцам; 3. от каудальной части ВДГ к дополнительным экспираторным мышцам.
Входящиесигналы. Генератор ритма получает нисходящую из коры головного мозга импульсацию, а также нервные сигналы от нервных клеток интегратора сенсорной информации и непосредственно от центральных хеморецепторов.
Выходящиесигналы. Нервная импульсация от генератора ритма направляется к иннервирующим дыхательные мышцы двигательным нервным клеткам соответствующих ядер черепных нервов (VII, IX–XII) и к мотонейронам передних рогов спинного мозга (их аксоны в составе спинномозговых нервов направляются к дыхательным мышцам).
Механизмритмической активности генератора не установлен. Предложено несколько моделей, учитывающих индивидуальные особенности электрогенной мембраны групп однотипных нервных клеток (например, наличие разных ионных каналов), спектр синаптических связей (в том числе осуществляемых при помощи разных нейромедиаторов), наличие пейсмейкерных (со свойствами водителя ритма) дыхательных нейронов (таковые обнаружены) или пейсмейкерных свойств локальных нейронных сетей. Нет ясности и в вопросе о том, является ли ритмическая активность свойством ограниченной группы нервных клеток или свойством всей совокупности дыхательных нейронов.
Интеграторсенсорнойинформацииполучает чувствительную информацию от разнообразных хемо- и механорецепторов, расположенных в органах дыхания и дыхательных мышцах, по ходу магистральных кровеносных сосудов (периферические хеморецепторы), а также в продолговатом мозге (центральные хеморецепторы). Помимо этих прямых сигналов, интегратор получает множество информации, опосредованной различными структурами мозга (в том числе и от высших отделов ЦНС). Импульсация от нервных клеток интегратора, направляясь к нейронам генератора ритма,модулируетхарактер разрядов от них.
Чувствительныеструктуры, сигналы от которых прямо или опосредованно (через интегратор сенсорной информации) влияют на ритмическую активность генератора ритма, включают периферические и центральные хеморецепторы, барорецепторы стенки артерий, механорецепторы лёгких и дыхательных мышц. Наиболее существенное значение на деятельность генератора ритма имеет осуществляемый периферическими и центральными хеморецепторами контроль pH и газов крови.
Периферическиехеморецепторы(каротидные и аортальные тельца) регистрируют в артериальной крови pH, Po2(Pao2) и Pco2, они особенно чувствительны к уменьшению Po2(гипоксемии) и в меньшей степени — к увеличению Pco2(гиперкапнии) и уменьшению pH (ацидозу).
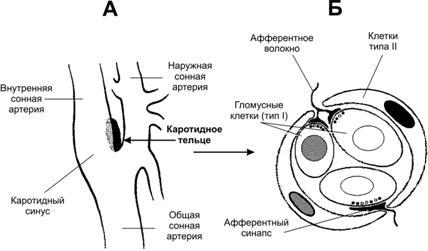
Рис.25–10.Каротидный(сонный)синусикаротидное(сонное)тельце[11].А.Каротидныйсинус— расширение просвета внутренней сонной артерии тотчас у места её ответвления от общей сонной артерии. В стенке артерии области расширения присутствуют многочисленные барорецепторы, регистрирующие значения АД и передающие эту информацию в ЦНС по нервным волокнам, проходящим в составе синусного нерва (Херинга) — ветви языкоглоточного нерва.Каротидноетельценаходится в области бифуркации общей сонной артерии.Б.Клубочеккаротидноготельцасостоит из 2–3 клеток типа I (гломусные клетки), окружённых поддерживающими клетками (тип II). Клетки типа I образуют синапсы с терминалями афферентных нервных волокон.
Каротидноетельце(рис. 25–10) состоит из скоплений клеток (клубочков, гломусов), погружённых в густую сеть кровеносных капилляров (интенсивность перфузии телец наибольшая в организме, в 40 раз больше перфузии головного мозга). Каждый клубочек содержит 2–3 хемочувствительные гломусные клетки, образующие синапсы с терминальными разветвлениями нервных волокон синусного нерва — ветви языкоглоточного нерва. В тельцах также находятся нервные клетки симпатического и парасимпатического отделов вегетативной нервной системы. На этих нейронах и на гломусных клетках заканчиваются преганглионарные симпатические и парасимпатические нервные волокна, а на гломусных клетках также постганглионарные нервные волокна из верхнего шейного симпатического узла [терминали этих волокон содержат светлые (ацетилхолин) или гранулярные (катехоламины) синаптические пузырьки].
Гломусныеклеткисвязаны друг с другом при помощи щелевых контактов, их плазмолемма содержит потенциалозависимые ионные каналы, клетки могут генерировать ПД и содержат разные синаптические пузырьки, содержащие ацетилхолин, дофамин, норадреналин, вещество P и метионин–энкефалин.
МеханизмрегистрацииPo2,Pco2иpH окончательно не установлен, но приводит к блокаде K+‑каналов, что вызывает деполяризацию плазмолеммы гломусных клеток, открытию потенциалозависимых Ca2+‑каналов, внутриклеточному увеличению [Ca2+] и секреции нейромедиаторов.
Синапсымежду гломусными клетками и афферентами синусного нерва. Под влиянием освобождаемых из гломусных клеток нейромедиаторов в терминалях генерируется постсинаптический потенциал и далее ПД. Эти чувствительные нейроны в свою очередь образуют синапсы с дыхательными нейронами ядра одиночного пути в составе ДДГ (см. рис. 25–9).
Аортальные(парааортальные)тельцарассыпаны по внутренней поверхности дуги аорты и содержат гломусные хемочувствительные клетки, образующие синапсы с афферентами блуждающего нерва.
Центральныехеморецепторы(нервные клетки стволовой части мозга) регистрируют в межклеточной жидкости мозга pH и Pco2, они особенно чувствительны к увеличению Pco2(гиперкапнии), а часть из них к уменьшению pH (ацидозу). Существенно, что центральные хеморецепторы расположены кнутри от гематоэнцефалического барьера, т.е. они отделены от крови в системе общей циркуляции (в частности, находятся в более кислой среде).
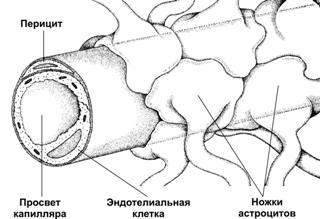
Рис.25–11.Гематоэнцефалическийбарьеробразован эндотелиальными клетками кровеносных капилляров мозга. Базальная мембрана, окружающая эндотелий и перициты, а также астроциты, ножки которых полностью охватывают капилляр снаружи, не являются компонентами барьера. [11].
Гематоэнцефалическийбарьер(рис. 25–11) изолирует мозг от временных изменений состава крови. Непрерывный эндотелий капилляров, клетки которого связаны между собой цепочками плотных контактов — основа гематоэнцефалического барьера. Гематоэнцефалический барьер функционирует как фильтр. Наибольшей проницаемостью обладают вещества нейтральные (например, O2и CO2,) и растворимые в липидах (например, никотин, этиловый спирт, героин), но проницаемость ионов (например, Na+, Cl–, H+, HCO–3) низка.
pHиPco2. Поскольку проницаемость барьера для CO2велика (в отличие от H+и HCO–3), а CO2легко диффундирует через клеточные мембраны, отсюда следует (см. уравнение 25–12), чтокнутриотбарьера(в интерстициальной жидкости, в ликворе, в цитоплазме клеток)наблюдаетсяотносительныйацидоз(сравнительно с кровью кнаружи от барьера, см. табл. 25–4) и что увеличение Pco2приводит к большему уменьшению значения pH, чем в крови. Другими словами, в условиях ацидоза возрастает хемочувствительность нейронов кPco2иpH.
Таблица 25–4. Характеристика содержания (мМ) разных компонентов в ликворе и артериальной крови [2]
|
|
Ликвор |
Кровь |
Отношение«ликвор/кровь» |
|
Na+ K+ Ca2+ Mg2+ Cl– HCO3– H2PO4– и HPO42– pH PСО2 (мм рт.ст.) Аминокислоты Белки (г/л) Осмоляльность (мОсм) |
147 2,9 1,1 1,1 113 22 0,9 7,33 44 0,7 0,3 290 |
153 4,7 1,3 0,6 110 24 0,75 7,40 40 2,6 70 290 |
0,96 0,62 0,85 1,8 1,03 0,92 1,2 0,99 1,1 0,27 0,004 1 |
Уравнение25–12
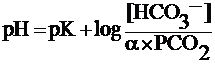
Уравнение Хендерсона–Хассельбальхарассматривает соотношение трёх
переменных — рН, Pсо2, концентрации
бикарбоната ([HCO3–]) — и
двух констант (рК и),
где рК — обратный логарифм константы
диссоциации угольной кислоты (6,1), а![]() —
константа растворимости СО2в
плазме (0,03 ммоль/л/мм рт.ст.). В норме
[HCO3–] плазмы составляет 24
ммоль/л, а PСО2артериальной крови
40 мм рт.ст., что в итоге позволяет решить
уравнение. Таким образом, согласно
уравнению Хендерсона–Хассельбальха,
увеличение PСО2приводит к уменьшению
pH при любом значении [HCO3–].
—
константа растворимости СО2в
плазме (0,03 ммоль/л/мм рт.ст.). В норме
[HCO3–] плазмы составляет 24
ммоль/л, а PСО2артериальной крови
40 мм рт.ст., что в итоге позволяет решить
уравнение. Таким образом, согласно
уравнению Хендерсона–Хассельбальха,
увеличение PСО2приводит к уменьшению
pH при любом значении [HCO3–].
Чувствительные к ацидозу (хемочувствительные к Pco2иpH) нейроны, активность которых влияет на лёгочную вентиляцию, обнаружены в вентролатеральной части продолговатого мозга, в двойном ядре, ядрах одиночного пути продолговатого мозга, а также в гипоталамусе и в голубоватом месте и в ядрах шва моста. Многие из этих хемочувствительных нейронов относятся к серотонинергическим нервным клеткам.
Барорецепторыстенкиартерийивен. Эти механорецепторы реагируют на изменения давления в просвете и в стенке сосудов, они образованы терминалями волокон, проходящих в составе блуждающего и языкоглоточного нерва. Барорецепторы особенно многочисленны в дуге аорты, сонных артериях (см. рис. 25–10А), лёгочном стволе, лёгочных артериях и в стенке крупных вен большого и малого круга кровообращения. Барорецепторы участвуют в рефлекторной регуляции кровообращения и дыхания, увеличение АД может привести к рефлекторной гиповентиляции или даже остановке дыхания (апноэ), а понижение АД способно вызвать гипервентиляцию.
Рецепторывоздухоносныхпутейиреспираторногоотделарегистрируют изменения объёмов лёгких, наличие посторонних частиц и раздражающих веществ и проводят информацию по нервным волокнам блуждающего и языкоглоточного (от верхних отделов воздухоносных путей) нервов к нейронам дорсальной дыхательной группы (см. рис. 25–9). К рецепторам этой группы относятся медленно адаптирующиеся рецепторы растяжения, быстро адаптирующиеся ирритантные рецепторы и J–рецепторы.
Медленноадаптирующиесярецепторырастяжениярасположены среди ГМК стенки воздухоносных путей. Они реагируют на увеличение объёма лёгочной ткани (раздувание ткани лёгкого), регистрируя растяжение стенки воздухоносных путей, и проводят пачки импульсов по миелинизированным нервным волокнам. Особенность этих механорецепторов — медленная адаптируемость (при возбуждении рецепторов импульсная активность продолжается длительное время). Эти рецепторы возбуждаются при расширении просвета воздухоносных путей (бронходилатации) и запускают рефлексХеринга–Бройера (при раздувании лёгкого происходит уменьшение дыхательного объёма и увеличение частоты дыхания; другими словами, рефлекс Херинга–Бройера направлен на подавление длительности вдоха и увеличение продолжительности выдоха). Одновременно и рефлекторно возникает тахикардия (увеличение ЧСС).
У новорождённых этот рефлекс контролирует дыхательный объём при нормальном дыхании (эупноэ).
У здоровых взрослых лиц рефлекс включается только при гиперпноэ — значительном увеличении дыхательного объёма (свыше 1 л), например, при значительной физической нагрузке.
При обструктивных заболеваниях увеличенный объём лёгкого постоянно стимулирует рецепторы растяжения, что приводит к отсрочке следующего вдоха на фоне длительного затруднённого выдоха.
Быстроадаптирующиеся(ирритантные)рецепторырасположены между эпителиальными клетками слизистой оболочки крупных воздухоносных путей. Они (как и медленно адаптирующие рецепторы растяжения) реагируют на сильное раздувание лёгочной ткани, но главным образом на действие поступающих при вдохе раздражающих ткани едких газов (например, аммиака), табачного дыма, пыли, холодного воздуха, а также на наличие в стенке воздухоносных путей гистамина (освобождается из тучных клеток при аллергических реакциях), Пг ибрадикининов(поэтому их также называют ирритантными — раздражающими — рецепторами). Возбуждение от рецепторов распространяется по миелинизированным афферентным нервным волокнам блуждающего нерва. Особенность этих рецепторов — быстрая адаптируемость (при возбуждении рецепторов импульсная активность практически прекращается в течение одной секунды). При возбуждении ирритантных рецепторов увеличивается сопротивление воздухоносных путей, рефлекторно возникает задержка дыхания и кашель.
J–рецепторы(от англ. «juxtacapillary» — околокапиллярные) расположены в межальвеолярных перегородках, являются как хемо– так и механорецепторами. J–рецепторы возбуждаются при перерастяжении ткани лёгкого, а также при воздействии различных экзо– и эндогенных химических соединений (капсаицин,гистамин,брадикинин,серотонин, Пг). Пачки импульсов от этих рецепторов направляются в ЦНС по безмиелиновым нервным волокнам (C‑волокна) блуждающего нерва. Стимуляция этих рецепторов приводит к рефлекторной задержке дыхания с последующим появлением частого и поверхностного дыхания, сужению просвета воздухоносных путей (бронхоконстрикции), увеличению секреции слизи, а также к падению АД и урежению ЧСС (брадикардии).
Одышка. J–рецепторы реагируют на переполнение кровью лёгочных капилляров и увеличение объёма интерстициальной жидкости альвеол, что возможно при левожелудочковой недостаточности и приводит к появлению диспноэ (одышки).
Внелёгочныерецепторы
Рецепторылицаиносовойполости. Их стимуляция при погружении в воду рефлекторно вызывает остановку дыхания, брадикардию, чихание.
Рецепторыносоглоткииглотки. При их возбуждении развивается сильное инспираторное усилие («шмыгание»), перемещающее посторонний материал из носоглотки в глотку. Эти рецепторы важны и для глотания, когда одновременно закрывается гортанная щель (впрочем, новорождённые могут дышать и глотать одновременно).
Рецепторыгортани. Их раздражение рефлекторно вызывает остановку дыхания (апноэ), кашель и сильные экспираторные движения, необходимые для предупреждения попадания постороннего материала в дыхательные пути (аспирация).
Механорецепторысуставовимышц(в том числе нервно–мышечные веретёна). Поступающая от них информация необходима для рефлекторной регуляции мышечного сокращения. Возбуждение этих рецепторов в какой-то степени обусловливает ощущение одышки (диспноэ), возникающей в том случае, когда дыхание требует больших усилий (например, при обструкции дыхательных путей).
Болевыеитемпературныерецепторы. Изменения вентиляции могут возникать в ответ на раздражение различных афферентных нервов. Так, в ответ на боль часто наблюдается задержка дыхания, за которой следует гипервентиляция.
ЦНСилёгочнаявентиляция. ЦНС функционирует не только в качестве генератора ритма (см. рис. 25–8) и модулятора этого центрального генератора («интегратор сенсорной информации» на рисунке), не только влияет на активность генератора ритма в связи с выполнением других функций воздухоносных путей (голосообразование и обоняние), но и модулирует параметры ритма дыхания при выполнении других функций, контролируемых ЦНС (например, жевание, глотание, рвота, дефекация, терморегуляция, различные эмоции, пробуждение от сна и так далее). К таким отделам ЦНС относятся в частности ретикулярная формация моста, лимбическая доля большого мозга, гипоталамус промежуточного мозга, кора большого мозга.
Сонидыхание. Дыхание во время сна контролируется менее строго, чем во время бодрствования; в то же время сон оказывает мощный эффект на параметры дыхания и в первую очередь на чувствительность хеморецепторов кPСО2и на ритм дыхания.
В течение фазы «медленного» сна ритм дыхания в целом становится более регулярным, чем в состоянии бодрствования, но чувствительность хеморецепторов к PСО2понижается, как и эфферентные влияния на дыхательные мышцы и мышцы глотки.
Во время фазы «быстрого» сна происходит дальнейшее снижение чувствительности к P PСО2, но ритм дыхания становится нерегулярным (вплоть до отсутствия всякого ритма).
Барбитураты подавляют активность генератора ритма и во время сна увеличивают периоды апноэ.
Дыхательныерасстройствавовремясна, или синдром ночного апноэ (различают синдром патологического храпа, синдром апноэ–гипопноэ сна и синдром ожирения–гиповентиляции) может быть обусловлен обструктивными (ожирение, небольшие размеры ротоглотки) или необструктивными (патология ЦНС) причинами. Апноэ во время сна, как правило, смешанное, сочетает обструктивные и неврологические расстройства. Пациенты могут иметь сотни подобных эпизодов во время сна на протяжении одной ночи. Обструктивное ночное апноэ — одно из многочисленных расстройств сна (частота — 8–12% общей взрослой популяции). Более половины случаев заболевания имеет тяжёлое течение и может приводить к внезапной смерти во время сна.
