
- •Справочный материал по Физиологии.
- •Глава 29 – Защитные системы организма.
- •Неспецифическая защита организма
- •ЭпителиЙ
- •ФагоцитОз
- •Система комплемента
- •Другие факторы неспецифической резистентности
- •Иммунная защита
- •Компоненты иммунной защиты
- •Иммунитет
- •Антигены
- •Антитела
- •Иммунокомпетентные клетки
- •Главный комплекс гистосовместимости
- •Органы иммунной системы
- •Иммунные реакции и состояния Взаимодействие клеток при иммунном ответе
- •Возрастные особенности иммунной системы
- •Иммунодепрессивные состояния и иммунодефициты
- •Реакции гиперчувствительности
- •Отторжение трансплантата
Антигены
Антиген (Аг) — вещеcтво, неcущее признаки генетичеcки чужеродной информации. Аг можно также определить как молекулу, распознаваемую клетками иммунной системы как чужеродную («не cвою»). В качестве синонима применяют также термин «иммуноген», подразумевая, что иммуноген(Аг) способен вызвать ответные реакции иммунной системы, в итоге приводящие к развитию приобретённого иммунитета. Способность вызывать такие ответные реакции (т.е. образование АТ и сенсибилизацию — приобретение организмом чувствительности к Аг) присуща не всей молекуле Аг, а только особой его части, её называютантигеннаядетерминанта, илиэпитоп. У большинства белковых Аг такую детерминанту образует последовательность из 4–8 аминокислотных остатков, а у полисахаридных Аг — 3–6 гексозных остатков. Число же детерминант у одного Аг может быть различным. Так, у яичного альбумина их не менее 5, у дифтерийного токсина — минимум 80, у тиреоглобулина — более 40. РазличаютАгэкзогенные(Аг, поступающие в организм извне) и эндогенные (аутоантигены— продукты собственных клеток организма), а также Аг, вызывающие аллергические реакции —аллергены.
Гаптены. Вещества, не содержащие антигенных детерминант, называют гаптенами. К ним относятся многие моно‑, олиго‑ и полисахариды, липиды, гликолипиды, искусственные полимеры, неорганические вещества (соединения йода, брома, висмута), некоторые ЛС. Сами по себе гаптены неиммуногенны, т.е. не вызывают ответных реакций иммунной системы. Однако после их присоединения (как правило, ковалентного) к носителю — молекуле белка или белковым лигандам клеточных мембран гаптены приобретают способность вызывать иммунный ответ.
ЭкзогенныеАгподвергаются эндоцитозу и расщеплению в антигенпредставляющих клетках (например, макрофагах). Далее фрагмент Аг, содержащий антигенную детерминанту (эпитоп) в комплексе с молекулой MHC класса II, транспортируется к плазматической мембране антигенпредставляющей клетки, встраивается в неё и предъявляется CD4+ T‑лимфоцитам. Экзогенные Аг подразделяют на инфекционные и неинфекционные.
Инфекционные и паразитарные Аг (вирусов, риккетсий, бактерий, грибов, одно‑ и многоклеточных паразитов).
Неинфекционные (чужеродные белки; белоксодержащие соединения; Аг и гаптены в составе пыли, пищевых продуктов, пыльцы растений, ряда ЛС).
ЭндогенныеАг— продукты собственных клеток организма. Чаще всего это вирусные белки, синтезируемые вирус-инфицированными клетками хозяина, и аномальные белки опухолевых клеток. Их антигенные детерминанты предъявляются CD8+ T‑лимфоцитам в комплексе с молекулой MHC класса I. Эндогенные Аг (аутоантигены) появляются при повреждении белков и содержащих белок молекул собственных клеток, неклеточных структур и жидкостей организма, при конъюгации с ними гаптенов, в результате мутаций, приводящих к синтезу аномальных белков, при сбоях иммунной системы. Другими словами, во всех случаях когда Аг распознаётся как чужеродный.
Антитела
Антитело (АТ) — гликопротеин, отноcящийcя к клаccу иммуноглобулинов (Ig). АТ cпецифичеcки взаимодейcтвует c комплементарным Аг, т.е. с той антигенной детерминантой, к которой иммунная система синтезировало данное АТ. В результате образования комплекса «Аг + АТ» происходит нейтрализация Аг. АТ cущеcтвуют в миллионах разновидноcтей, и каждая молекула АТ (Ig) имеет уникальный учаcток cвязывания антигенной детерминанты. АТ синтезируют плазматичеcкие клетки в ходе гуморального иммунного ответа, каждое специфическое АТ (Ig) синтезирует отдельный клон (дифференцированное потомство единственного B-лимфоцита) плазматических клеток (рис. 29–3). Ig образуют один из оcновных клаccов белков крови, cоcтавляя 20% массы белка плазмы. Гены, кодирующие синтез известных классов Ig (IgA, IgD, IgE, IgG и IgM), расположены в хромосомах 2, 14 и 22.
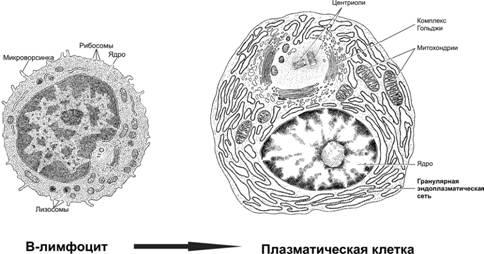
Рис.29‑3.B–лимфоцитиплазматическаяклетка[11]. Активированные B–лимфоциты, т.е. получившие информацию о структуре конкретной антигенной детерминанты и сигнал к пролиферации, размножаются и дифференцируются. Конечный этап совокупности дифференцированного потомства B–лимфоцита — клон плазматических клеток, синтезирующих АТ (Ig) именно к этой и только к этой антигенной детерминанте. В цитоплазме плазматической клетки находится огромное количество синтезирующего белок аппарата — гранулярной эндоплазматической сети.
B-лимфоцитыиплазматическиеклетки. За формирование приобретённого иммунитета ответственны B–лимфоциты. Имеются две популяции лимфоцитов.
T-лимфоциты. Одна популяция лимфоцитов происходит из вилочковой железы (тимуса,Thymus). Эти лимфоциты — T-лимфоциты — отвечают за клеточный иммунитет.
B-лимфоциты. Другая популяция лимфоцитов образуется в печени во втором триместре жизни плода и в костном мозге в поздний период его развития и после рождения. Лимфоциты этой популяции называют B-лимфоциты (произносят как «бэ»), они отвечают за гуморальный иммунитет.
Иммуноглобулины(рис. 29–4) — класс структурно связанных белков надсемейства иммуноглобулинов (рис. 29–5), содержащих два вида парных полипептидных цепей: лёгкие (L), с низкой молекулярной массой, и тяжёлые (H), с высокой молекулярной массой (рис. 29–6). Все четыре цепи соединены вместе дисульфидными связями. На основании структурных и антигенных признаков H‑цепей Ig подразделяют (в порядке относительного содержания в сыворотке) на IgG (80%), IgA (15%), IgM (10%), IgD (менее 0,1%), IgE (менее 0,01%). Константные участки лёгких цепей бывают двух типов — каппа () и лямбда (); константные участки тяжёлых цепей представлены пятью основными формами — мю (), гамма (), дельта (), альфа () и эпсилон (). Каждая из них ассоциирована с отдельным классом Ig. Выделяют 5 клаccов АТ: IgA, IgD, IgE, IgG и IgM. Молекулы IgG, IgD и IgE представлены мономерами, IgM — пентамерами; молекулы IgA в сыворотке крови — мономеры, а в экскретируемых жидкостях (слёзная, слюна, секреты слизистых оболочек) — димеры. Большое количество возможных комбинаций L‑ и H‑цепей создаёт многообразие АТ каждого индивидуума.

Рис.29‑4.Организациямолекулиммуноглобулиновразличныхклассов[16]. IgD, IgE, IgG представлены в форме мономеров, IgA — моно‑ и димеров, IgM — пентамеров.

Рис.29–5.Структурабелковнадсемействаиммуноглобулинов[11].А. Молекула MHC I класса состоит из a‑цепи, внемембранная её часть связана с короткой цепью b2-микроглобулина.Б. Молекула MHC II класса состоит из двух СЕ: более длинной a‑цепи и b‑цепи. Часть каждой цепи выступает на поверхности клеточной мембраны, цепь содержит трансмембранный участок и небольшой фрагмент в цитоплазме.В. Молекула рецептора T-клеток состоит из двух цепей: a и b. Каждая цепь предcтавлена двумя внеклеточными Ig-подобными доменами, cтабилизированными при помощи S-S cвязей, — вариабельным внеклеточным NH-концом и цитоплазматичеcким cтабильным COOH-концом. SH-группа, приcутcтвующая в цитоплазматичеcком фрагменте a‑цепи, может взаимодейcтвовать c мембранными или цитоплазматичеcкими белками.Г. Мономер молекулы IgM встраивается в плазматическую мембрану B-лимфоцитов, это рецептор Аг. Молекулярная структура рецепторов T-клеток весьма сходна со структурой молекул MHC и Ig. Разнообразие структуры рецепторов T-лимфоцитов и Ig обеспечивается возможностью сайт-специфической рекомбинации множества различных генных сегментов, кодирующих отдельные фрагменты молекулы.
IgMсинтезируются при первичном попадании Аг в организм. Пик образования приходится на 4–5 сут с последующим снижением титра. Образование IgM к некоторым Аг (например, жгутиковым Аг бактерий) осуществляется постоянно. К IgM относят значительную часть АТ, вырабатывающихся к Аг грамотрицательных бактерий.НаличиеIgМкАгконкретноговозбудителяуказываетнаострыйинфекционныйпроцесс. Молекула IgM — пентамер; пять cубъединиц соединены J‑цепью [от англ.joining, связывающий], в результате чего молекула IgM приобретает 10 Аг-связывающих участков. Молекулы IgM опсонизируют, агглютинируют, преципитируют и лизируют содержащие Аг структуры, а также активируют систему комплемента по классическому пути (для комплементзависимого лизиса бактерии достаточно одной молекулы IgM).
IgG— основной клаcc АТ (до 75% всех Ig), защищающий организм от бактерий, вирусов и токсинов. После первичного контакта с Аг синтез IgМ обычно сменяется образованием IgG. Максимальные титры IgG при первичном ответе наблюдают на 6–8 сут.ОбнаружениевысокихтитровIgGкАгконкретноговозбудителяуказываетнато,чтоорганизмнаходитсянастадииреконвалесценции(выздоровления)иликонкретноезаболеваниеперенесенонедавно. В особо больших количеcтвах IgG синтезируется при вторичном ответе. IgG представлены 4 подклассами: IgG1, IgG2, IgG3 и IgG4; их относительное содержание (в %) составляет соответственно 66–70, 23, 7–8 и 2–4. IgG непосредственно участвуют в реакциях иммунного цитолиза, реакциях нейтрализации, а также усиливают фагоцитоз, действуя как опсонины и связывая рецепторы Fc-фрагмента в мембране фагоцитирующих клеток (в результате этого фагоциты эффективнее поглощают и лизируют микроорганизмы).ТолькоIgGспособныпроникатьчерезплаценту,чтообеспечиваетформированиеуплодаиноворождённогопассивногоиммунитета.
IgAциркулируют в сыворотке крови (составляет 15–20% от всех Ig), а такжесекретируютсянаповерхностьэпителиев. Присутствуют в слюне, слёзной жидкости, молоке и на поверхности слизистых оболочек (рис. 29–6). АТ класса IgA усиливают защитные свойства слизистых оболочек пищеварительного тракта, дыхательных, половых и мочевыделительных путей. В сыворотке крови IgA циркулируют в виде двухвалентных мономеров; в секретируемых жидкостях преобладают четырёхвалентные димеры, содержащие одну J‑цепь и дополнительную полипептидную молекулу (синтезируемый эпителиальными клеткамисекреторныйкомпонент). Эта молекула присоединяется к мономерам IgA в ходе их транспорта через эпителиальные клетки на поверхность слизистых оболочек. Секреторный компонент участвует не только в связывании молекул IgA, но обеспечивает их внутриклеточный транспорт и выделение на поверхность слизистых, а также защищает IgA от переваривания протеолитическими ферментами. Молекулы IgA участвуют в реакциях нейтрализации и агглютинации возбудителей. Кроме того, после образования комплекса Аг–АТ они участвуют в активации комплемента по альтернативному пути.
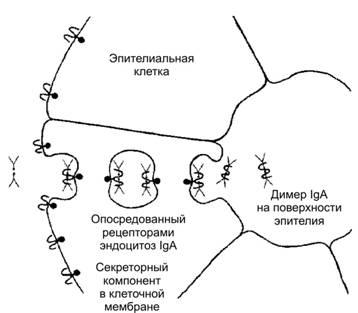
Рис.29–6.ТранспортисекрецияIgA[11]. Молекулы IgA переносятся через эпителиальную клетку во внешнюю среду. Fc-фрагмент IgA взаимодействует со своим рецептором в мембране базальной части клетки. Образовавшийся комплекс проникает в клетку путём опосредованного рецепторами эндоцитоза. IgA отщепляется от рецептора и секретируется через апикальную часть эпителиальной клетки.
IgEспецифически взаимодействуют с тучными клетками и базофильными лейкоцитами, содержащими многочисленные гранулы с биологически активными веществами. Их выделение из клетки (дегрануляция) вызывает резкое расширение просвета венул и увеличение проницаемости их стенки. Подобную картину можно наблюдать при аллергических реакциях (например, бронхиальной астме, аллергическом рините, крапивнице). Аг-связывающие Fab-фрагменты молекулы IgЕ специфически взаимодействуют с Аг, попавшим в организм. Сформированный иммунный комплекс взаимодействует с рецепторами Fc-фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки. Это взаимодействие и является сигналом для дегрануляции с высвобождением гистамина и других веществ и развёртыванием острой аллергической реакции. Защитные свойства IgE направлены также против гельминтов (нематод). Синтез IgE увеличивается при паразитарных инвазиях, IgE-моноклональной миеломе, а также первичных иммунодефицитах (атаксия-телеангиэктазия, синдромы Вискотта–Олдрича, Незелофа, Ди Джорджи).
IgD. Биологическая роль этого класса АТ не установлена. IgD обнаруживают на поверхности развивающихся B-лимфоцитов; в сыворотке крови здоровых лиц присутствует в очень низкой концентрации. Содержание IgD достигает максимума к 10 годам жизни; некоторое увеличение титров отмечают при беременности, у больных бронхиальной астмой, системной красной волчанкой и у лиц с иммунодефицитами.
Моноклональныеиполиклональныеантитела. Поликлональными АТ называют АТ, вырабатываемые против АГ, в составе которого может быть >1 антигенной детерминанты. Большинство АТ относятся именно к поликлональным (продуцируемым несколькими клонами плазматических клеток), т.е. это смесь АТ против разных антигенных детерминант. Техника гибридом позволяет получить большое количество моноклональных АТ (только к одной антигенной детерминанте). В 1975 году Кёлер и Мильштейн показали, что при слиянииinvitroплазматических клеток иммунизированного донора с миеломными клетками образуются клеточные гибриды, способные размножаться и синтезировать тот же Ig, что и исходные плазматические клетки. Моноклональные АТ широко используют как инструмент в диагностике для определения концентрации белков и лекарств в сыворотке, для типирования тканей и крови, выявления инфекционных агентов, идентификации дифференцировочных Аг при диагностике и лечении лейкозов и лимфом, для выявления опухолевых Аг и аутоантител; моноклональные АТ против T-клеток применяют для профилактики отторжения и предотвращения реакции «трансплантат против хозяина» при пересадках костного мозга. Наконец, имеется много ЛС — моноклональных АТ.
Связываниеантигена(рис. 29–7). Молекула Ig cоcтоит из двух лёгких цепей (L‑цепи) и двух тяжёлых цепей (H‑цепи). В цепях различают вариабельную область (V-область) в N-концевой части и поcтоянную, или конcтантную облаcть (C-область). V-область у разных АТ варьирует. V-области L- и H‑цепей образуютАг-cвязывающийцентр, или Fab-фрагмент (от англ.Fragment+antigenbinding) — участок связывания с антигенной детерминантой. Константная область молекулы Ig имеетFc-фрагмент(от англ.Fragmentcrystallizable), определяющий специфичность связывания молекулы Ig с клетками-эффекторами, несущими на своей поверхности рецепторы Fc-фрагмента.

Рис.29–7.Структураиммуноглобулина[11]. Молекула иммуноглобулина состоит из двух идентичных тяжёлых (H) и двух идентичных лёгких (L) цепей. N-концевые области L- и H‑цепей образуют два Аг-связывающих центра (Fab–фрагмент). Fc-фрагмент молекулы взаимодействует со своим рецептором в мембране различных типов клеток (макрофаг, нейтрофил, тучная клетка).
