
kr1
.pdfальфагемолизином стафилококка. Слой агара должен быть равномерно окрашенным в красный цвет.
2. Стафилококки. Схема лабораторной диагностики вызываемых
заболеваний. Носительство. Фаготипирование.
Посев крови.
1день: Кровь забирают из вены после тщательной обработки спиртов, затем йодной настойкой, затем снова спиртом. Посев крови производят у постели больного. Кровь в количестве 5-10мл засевают на жидкие питательные среды в соотношении 1/10-1/60, для того, чтобы путем разведения ослабить бактерицидные свойства крови. Одновременно используют питательные среды для аэробных и факультативно-анаэробных микроорганизмов. Посевы немедленно доставляют в лабораторию и помещают в термостат.
Питательные среды для посева крови: среды для аэробных и факультативно-анаэробных бактерий - сахарный бульон (МПБ+глюкоза), двухфазная среда (МПБ+глюкоза+МПА), среды для облигатно-анаэробных бактерий – тиогликолевая среда (Редуцирующие вещества, такие как тиогликолят и цистин - обеспечивают анаэробные условия, достаточные даже для строгих анаэробов) , бульон Шедлера (без тиогликолята).
2-36дни: посевы инкубируют до 6н с ежедневным просмотром посевов первые 8 дней. При появлении видимого роста делают мазки, окрашивают их по Граму и, в зависимости от результатов, делают высевы на соответствующие плотные питательные среды для выделения ЧК и ее дальней идентификации. При отсутствии роста с сахарного бульона на 3 и 5 дни делают высев на кровяной агар. При отрицательном результате на 6 день выдается предварительный отрицательный ответ.
Схема исследования отделяемого раны:
1этап: микроскопия мазка по Граму, посев на питательный среды: кровяной агар (для анаэробов и факультативных анаэробов), сахарный бульон (для факультативных анаэробов), тиогликолевая среда ( для анаэробов). Инкубация посевов в термостате 5 суток с ежедневным просмотром. При отсутствии роста – отрицательный ответ.
2этап: выделение ЧК и ее идентификация.
3этап: определение антибиотикорезистентности и внутривидовое типирование.
Исследование гноя:
1день: микроскопия мазка по Граму, посев на кровяной агар или сахарный бульон. 2день: учет роста на кровяном агаре и микроскопия мазка по Граму. Если вокруг колоний
есть зона гемолиза, топроизводят откол колоний и высев с сахарного бульона на кровяной агар.
3день: выбор и постановка тестов, необходимых для индентификации выделенной культуры.
Тест на плазмокоагулазу: плазмокоагулаза выявляется при посеве испытуемой культуры в стерильной цитратной плазме крови. Посевы инкубируют при 37°С в течение 2—5 ч. В случае выработки фермента происходит свертывание плазмы.
Тест на ДНКазу: В агаре для теста на ДНКазу источником питательных веществ, необходимых для роста, является триптон. Хлорид натрия поддерживает осмотический баланс. Высокомолекулярная дезоксирибонуклеиновая кислота обеспечивает обнаружение дезоксирибонуклеазы (ДНКазы), которая деполимеризует ДНК. После инкубации среды, засеянной тестовыми штаммами, чашка заполняется соляной кислотой, что приводит к выпадению полимеризованной ДНК в осадок и замутнению среды. Микроорганизмы, разрушающие ДНК, образуют чистую зону вокруг области роста.
Эта среда в основном используется для идентификации стафилококков, но может также применяться для обнаружения активности ДНКазы других микроорганизмов.
Тест на каталазу: Выросшую культуру снимают с поверхности агара неметаллическим инструментом и суспендируют в капле 3%-ной перекиси водорода на предметном стекле.

Немедленно и через 5 мин наблюдают за образованием пузырьков визуально или в микроскоп с малым увеличением.
Окислительно-ферментативный тест с маннитом: при окислении маннита в аэробных условиях образуется уксусная кислота, которая закисляет среду, что выявляется с помощью индикатора. В анаэробных условиях стафилококки, в отличие от микрококков, способны ферментировать манит с образованием кислых продуктов, которые также выявляются с помощью индикатора.
ОПРЕДЕЛЕНИЕ НЕКРОТОКСИНА производится путем внутрикожного введения кролику 0,2 мл взвеси 2 млрд, суточной агаровой культуры стафилококка в физиологическом растворе. Наблюдение за животным ведется в течение 24-48 часов. Как положительная реакция расценивается лишь инфильтрат с желтоватым центром, темным ободком и яркокрасной каймой по периферии с последующими явлениями некроза.
Определение чувствительности стафилококков к новобиоцину: Стафилококки по чувствительности к новобиоцину дифференцируют на Staphylococcus aureus, epidermidis и saprophyticus. Минимальная подавляющая концентрация для Staphylococcus aureus и epidermidis составляет 2 мкг. При данной концентрации новобиоцина и больше 2 мкг растут S. aureus и S. epidermidis. При концентрации новобиоцина меньше 2 мкг растут S. saprophyticus.
4день: учет результатов тестов. Если все тесты положительны, значит из мазка выделен золотистый стафилококк. Определение антибиотикорезистентности диско-диффузионным методом: на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35о-37оС в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах.
Выявление бактерионосителей золотистого стафилококка.
Бактерионоситель может быть злостный, т.е. постоянный, а может быть транзиторный или временный, например после перенесенной ОРВИ. Транзиторный бактерионоситель может заражаться как одним и тем же штаммом, так и разными.
Исследуемым материалом служат мазки из носовых ходов. 1день: посев исследуемого материала на ЖСА. 2день: производится учет результатов, откол подозрительных колоний (лецитиназо+) на МПА для выделения ЧК. 3-4день: постановка тестов для идентификации выделенной культуры (тесты см.выше).
Фаготипирование.
В различных местностях циркулируют разные фаготипы стафилококков. Поэтому определение их у стафилококковых культур имеет большое значение для выяснения возможного источника инфекции и путей ее распространения. Среди
плазмокоагулирующих стафилококков по номенклатуре Международного Комитета по фаготипированию различают 22 типа фагов.
Определение лизируемости стафилококков названными бактериофагами выполняется следующим образом.
ПОДГОТОВКА КУЛЬТУР К ФАГОТИПИРОВАНИЮ Определение плазмокоагулирующей способности культур (бактериофагами цитируется
только коагулазоположительные штаммы). Подготовка культуры: посев в МПБ с pH -7, 2-7, 4, выращивание при +37 °C 18-24 часа. На следующий день - пересев в свежий МПБ с тем же pH, подращивание культуры в термостате в течение 3 часов.
ФАГОТИПИРОВАНИЕ Чашки со свежеприготовленным 1,25% МПА подсушить в термостате в течение 1-1,5 часов.
Разделить дно чашки карандашом по стеклу на 23-24 квадрата, в каждом из которых подписать типы испытуемых бактериофагов. Засеять чашку 0,2 мл 3-4 часовой культуры выделенного стафилококка и равномерно распределить шпателем по поверхности среды. Подсушить посев в термостате при +37 °C в течение 30-45 минут. В каждый квадрат петлей нанести каплю соответствующего бактериофага в десятикратном разведении (1:10), произведенном в бульоне Хоттингерa (Питательная среда предназначена для культивирования различных микроорганизмов, таких как энтеробактерии, синегнойная палочка, стафилококки, некоторые виды стрептококков. При необходимости может быть обогащѐн углеводами, солями. Представляет собой жидкость от светло-жѐлтого до светлокоричневого цвета.Состав: перевар по Хоттингеру, натрия хлорид). Каплю фага подсушить, чашки поставить в термостат на 18-20 часов в перевернутом виде. Учет результатов и определение фаготипа стафилококка производится по наличию стерильного пятна на месте лизиса культуры. Положительным считается результат, степень лизиса при котором определяют не менее как на 2 плюса. В этом случае зона лизиса составляет около 50% площади в месте нанесения бактериофага. Во многих случаях культуры стафилококков лизируются не одним, а несколькими фагами, образуя своеобразую фагомозаику из стерильных пятен. Стафилококки, обнаруживающие одну и ту же мозаику или отличающиеся на 1 фаг, считаются идентичными.
3. Стрептококки. Биологические свойства. Классификация. Принципы
лабораторной диагностики вызываемых инфекций.
Семейство Streprococcaceae, род Streptococcus, 50 видов, среди которых патогеные S.pyogenes, S.pneumoniae и др., условно-патогенные и микробы сапрофиты.
Морфология: ланцетовидные мелкие грам+ шаровидные неподвижные клетки, не образуют спор. Некоторые виды имеет капсулу, через которую проходят фимбрии. В мазках располагаются в виде цепочек или попарно. Полиморфны.
Культуральные свойства: растут на плотных питательных средах, обогащенных кровью или сывороткой с добавлением сахаров, образуя бело-серые плоские, мутные колонии при оптимальной температуре 37градусов и рН=7,8. Крупные мукоидного типа колонии характерны для штаммов, имеющих капсулу, крупные шероховатые – для штаммов, имеющих М-АГ, мелкие гладкие – для сапрофитов. На жидких питательных средах образуют мелкозернистый пристеночный и придонный осадок.
Б/х свойства: хемоорганотрофы, факультативные анаэробы, микроаэрофилы (для роста необходим СО2). Биохимическая активность меньше выражена, чем у стафилококков. Обладают метаболизмом бродильного типа, ферментируют углеводы с образованием кислоты, молоко не свертывают, протеолитическими свойствами не обладают, каталазо-, оксидазо-.
Антигенная структура: По предложению Ребекки Лэнсфилд (1933), согласно наличию специфических углеводов в клеточной стенке стрептококки делят на 17 серогрупп (наиболее важные — A, B, C, D, G). Такое разделение возможно с помощью
серологических реакций, т.е. путем определения требуемых антигенов по их взаимодействию с известными антителами стандартных сывороток. У стрептококков грА среди белков клеточной стенки выделяют М-АГ и Т-АГ. По М-АГ различают около 100, по Т-АГ несколько десятков сероваров группы А. Помимо них, в клеточной стенке находится рецептор, способный реагировать с Fc-фрагментом Ig. У стрептококковых АГ имеется сходство с АГ некоторых клеток макроорганизма.
Упрощенная классификация стрептококков, встречающихся у человека
Группы |
Основные |
Гемолиз |
Серогруппа |
Роль а |
стрептококко |
виды |
|
по Ленсфильд |
патологии |
в |
|
|
|
человека |
Стрептококки |
S. pyogenes |
Бета-гемолиз |
А |
Скарлатина! |
грА |
|
|
|
Тонзилиты, |
|
|
|
|
рожа, ГСИ, |
|
|
|
|
ревматизм, |
|
|
|
|
гломерулонеф |
|
|
|
|
рит |
Стрептококки |
S. agalacticae |
Альфа- и |
В |
Сепсис |
грВ |
|
бетагемолиз |
|
новорожденн |
|
|
|
|
ых, |
|
|
|
|
менингиты |
Энтерококки |
S. faecalis, |
Альфа-, бета-, |
D |
Эндокардиты, |
|
S.faecium |
иногда гамма- |
|
ГСИ, |
|
|
гемолиз |
|
пищевые |
|
|
|
|
токсикоинфек |
|
|
|
|
ции |
Пневмококки |
S. pneumoniae |
Альфа- |
- |
Пневмонии, |
|
|
гемолиз |
|
менингиты |
Зеленящие |
S. sanguis, |
Альфа- |
Сборная |
ГСИ |
стрептококки |
S.mitis, |
гемолиз |
группа (все |
(относительн |
|
S.salivarius, |
|
группы, |
о редко), |
|
S.mutans |
|
кроме А) |
Кариес |
Факторы патогенности: Адгезия за счет М-белка и липотейхоевых кислот. Агрессия за счет капсулы и М-белка, которые обеспечивают защиту микроорганизма от фагоцитоза, связывание фибрина и фибриногена. Это маскирует рецепторы для связывания комплемента. Проникновению фагоцитов в очаг воспаления препятствует аминопептидаза микроба. Стрептококки продуцируют ферменты инвазии: фибринолизин, гиалуронидазу, липазу и протеазу.
Токсинообразование: экзотоксины – гемолизины (стрептолизин О и S), обладающие цитотоксическим действием на эритроциты; лейкоцидин, повреждающий лейкоциты; эритрогенин (скарлатинозный токсин), вызывающий кожную сыпь. Некоторые штаммы грА продуцируют кардиогепатический токсин, поражающий миокард и печень. Фермент ДНКаза разрушает ядра клеток макроорганизма. По отношению к эритроуитам се стрептококки подразделяются на бета-гемолитические (полностью разрушают гемоглобин, четкая зона гемолиза), альфа-гемолитические (зеленящие, т.е. разрушающие гемоглобин до метгемоглобина, называют вириданс), гамма-гемолитические (зоны гемолиза не видно на питательных средах с кровью человека, называют антигемолитикус).

Заболевания, вызываемые стрептококками можно разделить на 3 группы:
1.Острые заболевания, вызываемые только стрептококками, либо стрептококками с другими микроорганизмами, где стрептококк играет ведущую роль: послеродовые сепсисы, скарлатина, ангина, рожа, гломерулонефрит, подострый и острый эндокардиты;
2.Хронические заболевания, где стрептококк главный или единственный: ревматическая лихорадка (поражает клапаны сердца), хронический тонзилит.
3.Инфекции, где стрептококк не главный: менингит, пневмония, сепсис.
Стрептококки группы A
Большинство болезней человека вызывается β-гемолитическими стрептококками из серогруппы A. Практически все они принадлежат одному виду — S. pyogenes (Streptococcus pyogenes, гноеродный стрептококк). Это стрептококк в мед. литературе иногда называется аббревиатурой БГСА — бета-гемолитический стрептококк серологической группы А. В холодное время года его носительство в носоглотке школьников достигает 20-25%.
S. pyogenes известен с древности, но своего пика заболеваемость достигла в 19-м веке. Он вызывает: рожистое воспаление (рожу), скарлатину (симптомы: ангина + повышенная температура + мелкоточечная сыпь + интоксикация). Однако носогубной треугольник всегда остается свободным от сыпи, язык при скарлатине — зернистый и ярко-красный; стрептококковые фарингиты (воспаление глотки) и ангины, а также осложнения: гнойные = ранние (развиваются во время ангины): отит, синусит, мастоидит (воспаление ячеек сосцевидного отростка височной кости), паратонзиллярный абсцесс, шейный лимфаденит (воспаление шейных лимфоузлов), менингит, бактериемия, эндокардит, пневмония; негнойные = поздние (начинаются через 1-3 недели после стихания воспаления в горле): постстрептококковый гломерулонефрит, токсический шок, развивающиеся в стадии выздоровления (на 8-10-й день от начала болезни), и острая ревматическая лихорадка (ревматизм). Ранние осложнения обусловлены заносом инфекции в другие части организма по кровеносным (гематогенно) и лимфатическим (лимфогенно) путям. Так может распространяться любая опасная инфекция, а не только стрептококки. Поздние осложнения связаны с системным воспалением и аутоиммунным механизмом, то есть иммунная система начинает уничтожать собственные здоровые ткани и органы.
Стрептококки группы B
Сюда относится S. Agalactiae, который обитает в ЖКТ и во влагалище 25-45% беременных. При прохождении плода по родовым путям матери происходит его колонизация. S. agalactiae вызывает бактериемии и менингиты новорожденных со смертностью в 10-20% и остаточными явлениями у половины выживших. У молодежи и взрослых людей S. agalactiae часто становится причиной стрептококковых пневмоний как осложнений после
ОРВИ. Сам по себе S. agalactiae не вызывает воспаление легких, а вот после гриппа — запросто.
S. pneumoniae (пневмококк). Это основной возбудитель внебольничных («амбулаторных») бактериальных пневмоний, а также менингитов.
Негемолитические (зеленящие) стрептококки. К негемолитическим (α-гемолитическим,
зеленящим) стрептококкам относят S. anginosus, S. bovis, S. mittis, S. sanguis и другие. Они живут в ротовой полости, где составляют до 30-60% всей микрофлоры, а также обитают в кишечнике.
Характерные поражения — бактериальные эндокардиты (воспалительные процессы в эндокарде клапанов сердца). Зеленящие стрептококки составляют 25-35% всех возбудителей бак. эндокардитов. Поскольку зеленящих стрептококков во рту обитает очень много, они легко попадают в кровоток (это называется бактериемия) при стоматологических процедурах, чистке зубов и т. д. Проходя через полости сердце, зеленящие стрептококки часто оседают на сердечных клапанах и приводят к их злокачественным поражениям. Бактериальный (инфекционный) эндокардит относится к разновидности сепсиса («заражения крови»; в отличие от бактериемии при сепсисе бактерии размножаются в кровотоке). Лечить его очень трудно, а без лечения антибиотиками смертность при бактериальном эндокардите в течение года близка к 100%. Используется длительный прием высоких доз антибиотиков. Если у пациента есть пороки сердца, стоят искусственные клапаны или он ранее перенес бактериальный эндокардит, риск заразиться повторно становится слишком велик. Таким людям назначается профилактическая доза антибиотика перед посещением стоматолога. К негемолитическим стрептококкам также относится бактерия S. Mutans, широко известная тем, что является возбудителем кариеса. Эта бактерия ферментирует сахар, который попадает в ротовую полость, до молочной кислоты. Молочная кислота вызывает деминерализацию зубов. В принципе, ферментировать сахар до молочной кислоты умеют многие бактерии во рту, но только S. mutans и лактобациллы способы это делать при низких значениях pH, то есть в кислой среде. Поэтому после еды рекомендуется чистить зубы или хотя бы тщательно полоскать рот. Ученые не оставляют надежды создать вакцину против S. mutans, которая одновременно станет и вакциной от кариеса.
Синегнойная палочка. Биологическая характеристика. Принципы диагностики и профилактики вызываемых инфекций.
Микробиологическая диагностика.
Материалом для исследования служат:
1)слизь из зева при ангине и скарлатине;
2)кровь при эндокардите и подозрении на сепсис;
3)гнойное отделяемое из очага поражения;
4)мокрота при заболеваниях органов дыхания;
5)моча при заболеваниях почек и мочевыводящих путей.
При подозрении на сепсис сеют у постели больного 10-15 мл крови во флакон, содержащий 100-150 мл сахарного бульона (соотношение крови и среды 1:10). Лучшие и надежные результаты дают посевы крови в среду Китт-Тароцци* с полужидким агаром. В нем будут расти и анаэробные стрептококки. Посевы крови инкубируют в термостате при 37 ° С. При росте стрептококков на дне среды появляется осадок. В среде Китт-Тароцци может образовываться и газ. В мазках из осадка обнаруживают грамположительные стрептококки в виде длинных цепочек. Пневмококки располагаются короткими цепочками или парно в виде ланцетовидными клеток, возвращенных друг друга утолщенными концами. Для энтерококков свойственно парное расположение, реже тетрадами или кучками, но гроздьями. Отдельные клетки энтерококков полиморфные (большие и малые). При отсутствии роста посевы выдерживают в термостате в течение 3-4 недель, периодически проводя бактериоскопию. Культуру, выросшую после бактериоскопии пересевают в чашку с кровяным агаром для определения типа гемолиза. Через 18-20 ч
вырастают типичные колонии, окруженные светлой зоной (бета-гемолиз) или зоной позеленения (альфа-гемолиз). Хотя способность к гемолизу не имеет абсолютного диагностического значения, все же при исследовании стрептококков, выделенных от человека, нельзя исключать негемолитические колонии гамма-стрептококков. За очень редким исключением они не связаны с инфекционными заболеваниями. Чтобы лучше и точнее идентифицировать выделенные гемокультуры стрептококков колонии с кровяного агара рекомендуют отсеивать на простой МПА, молоко с метиленовым синим, желчный бульон(900 мл МПБ, 100 мл желчи) или желчно-кровяной агар. Гемолитические стрептококки серогруппы А не растут на простых и желчных средах, не обесцвечивают метиленовый синий в молоке. Энтерококки хорошо растут на агаре с желчью. Далее различные виды стрептококков можно дифференцировать по биохимическим свойствам. Но биохимические признаки стрептококков не являются постоянными, что в некоторой степени обесценивает использование этих тестов.
Раневое отделяемое, слизь из зева и носа, собранные ватными тампонами, а также мокроты, ликвор, мочу и т.д. сеют на кровяной агар. Материал наносят на среду в небольшом количестве, а затем петлей или шпателем рассеивают его легкими штрихами по всей поверхности. Не рекомендуется втирать изучаемый материал в агар. Для повышения частоты посева стрептококков тампоны после посева на кровяной агар еще у постели больного погружают в пробирку со средой Китти-Тароцци, к которому добавляют полужидкий агар и 2-3 капли дефибринированной крови кролика. Посев инкубируют 3-4 ч при 37 ° С, а затем высевают на чашки с кровяным агаром, выделяют и идентифицируют по обычной схеме.
Для быстрой идентификации бета-гемолитических стрептококков серогруппы А используют экспресс-метод с помощью реакции иммунофлюоресценции. Для этого мазок из выделенной культуры фиксируют в 95% спирте в течение 15 мин, окрашивают соответствующими люминесцуючимы сыворотками и рассматривают под люминесцентным микроскопом. Практически все гемолитические стрептококки группы А чувствительны к бацитрацину и дают положительный ПИР-тест,то есть гидролизует пирролидонил-бетанафтиламид. Еще быстрее стрептококки этой группы определяют в мазках из рото-и носоглотки, обрабатывая их современными коммерческими тестнаборами. Групповые А-антигены стрептококков экстрагируют с помощью ферментов или других химических реагентов и определяют их в реакциях латекс-агглютинации, коаглютинации или иммуноферментным анализом. Стрептококки группы В, как правило, нечувствительны к действию бацитрацину, раскладывают гиппурат и дают положительный КАМП-тест (усиление гемолиза под влиянием дисков, содержащих стафилококковый бетагемолизин). Дальнейшую идентификацию проводят серотипированием в реакциях латексагглютинации или коаглютинации с коммерческими реагентами или мечеными моноклональными антителами.
Стрептококки в мазках из влагалища можно быстро идентифицировать с помощью таких же тест-систем, как для стрептококков группы А. Для определения вирулентности выделенных культур стрептококков используют биопробу на белых мышах или устанавливают концентрацию поверхностного М-протеина, характерного только для патогенных штаммов. Для этого получают солянокислый экстракты из молодых культур стрептококков и определяют в них содержание М-антигена. При определении альфа-и бета-гемолитических стрептококков в воздухе операционных, родильных залов, комнат для новорожденных, манипуляционных и других больничных помещений делают посевы воздуха седиментационным методом или с помощью аппарата Кротова на среду Гарро (до растопленного МПА добавляют 5% дефибринированной крови и 0, 2% водного 0,1% раствора ганцианвиолету). Энтерококки и сапрофитная микрофлора на этой среде не растут.
Серологическое исследование
При хронических стрептококковых инфекциях выделить возбудителя, как правило, не удается, особенно при длительном лечении больных антибиотиками и другими противомикробными препаратами. В таком случае проводят серологические исследования: определение стрептококкового антигена в сыворотке крови и моче, титрования антител к О-стрептолизин, гиалуронидазы и ДНК-азы. Антиген стрептококков определяют в РСК. Необходимые для этого антистрептококови сыворотки получают путем гиперимунизации кроликов убитой культурой бета-гемолитических стрептококков серогруппы А. Титром антигена считают то наибольшее разведение сыворотки, которое задерживает гемолиз. Лучшие результаты получают при постановке РСК на холоде. В последнее время для выявления стрептококковых антигенов в сыворотке крови довольно успешно используют метод ИФА. При определении стрептококковых антигенов в моче больных используют реакцию преципитации. Осадок утренней порции мочи после центрифугирования обрабатывают противострептококковых Преципитирующие сывороткой. Результат учитывают через час при комнатной температуре. Стрептококковые антигены в сыворотке крови и моче часто обнаруживают при скарлатине, ангине, ревматизме. Определение антител против О-стрептолизин (антистрептолизина-О) проводят внесением рабочей дозы стандартного препарата О-стрептолизин в ряд пробирок с кратными разведениями сывороток (1:25, 1:50, 1:100 и т.д.). Смесь инкубируют в термостате в течение 15 мин, затем во все пробирки вносят по 0,2 мл 5% взвеси эритроцитов кролика и снова помещают в термостат на 60 мин. При наличии антистрептолизина в крови больных гемолиза не наступает. Пробирка с наибольшим разведением сыворотки, в которой есть выраженная задержка гемолиза, содержит 0,5 AO (антитоксических здиниць) антистрептолизина-О. Для определения антител против гиалуронидазы (антигиалуронидазы) в сыворотке больных в разных разведениях вносят стандартную дозу гиалуронидазы и рабочую дозу гиалуроновой кислоты, которую готовят из пупочных канатиков новорожденных. При наличии антигиалуронидазы в пробирках образуется сгусток после добавления уксусной кислоты. Пробирка с наименьшим количеством сыворотки, в которой есть сгусток, содержащий 1 AO (антитоксическое единицу) антигиалуронидазы. При ревматизме и стрептококковом гломерулонефрите в сыворотке крови обнаруживают> 500 AO антистрептолизина и> 800-1000 AO антистрептогиалуронидазы уже с первых дней болезни. Именно при этих заболеваниях чаще всего проводят обе серологические реакции. Во многих странах используют коммерческие тест-системы для определения антител ло стрептолизин, гиалуронидазы, стрептокиназы, ДНК-азы и других экзоферментов стрептококков.
*реакция преципитации - формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах, избыток одного из них снижает уровень образования иммунного комплекса. Реакцию преципитации ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др.
* среда Китта-Тароцци - состоящая из концентрированного МПБ, глюкозы и агара. На дно пробирки для адсорбции кислорода помещают кусочки вареной печени или фарша слоем 1,0–1,5 см и заливают 6–7 мл среды. Перед посевом среду кипятят 10–15 мин для удаления воздуха, затем быстро охлаждают, а после посева заливают стерильным вазелиновым маслом. Материал, содержащий спороносные анаэробы, высевают в две пробирки со средой Китта–Тароцци, одну из них прогревают 30 мин при температуре 80°С для уничтожения вегетативных форм сопутствующей микрофлоры.
4. Синегнойная палочка. Биологическая характеристика. Принципы
диагностики и профилактики вызываемых инфекций.
Семейство Pseudomonadaceae, род Pseudomonas.
Морфология: грампрямая или слегка изогнутая палочка, подвижна (монотрихи или амфитрихи), спор не образуют, имеют фимбрии, в мазках располагается одиночно, парами или короткими цепочками. Могут синтезировать слизь (капсульное вещество), особенно более вирулентные мукоидные штаммы.
Культуральные свойства. Растет с широком диапозоне рН и температур. Оптимум роста – 37градусов, но хорошо растет и при 42градусов, что является отличительным свойством данного микроба. Хорошо растут на простых питательных средах. На жидких средах образует серовато — серебристую пленку на поверхности. На плотных средах образует гладкие, круглые, слизистые колонии. Уже к концу суток вследствие синтеза пигмента пиоцианина появляется сине — зеленое окрашивание культуры и в ряде случаев — самих сред. Другие виды псевдомонад могут продуцировать пигменты желтого цвета с зеленой флюоресценцией (P.fluorescens, P.putida), красный (пиорубин), коричнево — черный (пиомеланин), зеленый (пиовердин), желтый (альфа-оксифеназин) с запахом жасмина.
Б/х свойства. Облигатный аэроб, хемоорганотроф. Оксидазо+, каталазо+. Для синегнойной палочки характерна низкая сахаролитическая активность (окисляет только глюкозу в аэробных условиях), высокая протеолитическая и гемолитическая активность : образование на кровяном агаре зоны бетагемолиза. Разжижают желатин, гидролизуют казеин, восстанавливают нитраты в нитриты. Синтезирует триметиламин, придающий культурам приятный запах жасмина. Продуцирует выработку бактериоцинов — пиоцинов. Пигмент пиоцианин обладает свойствами пиоцина, действующего на грамположительные
играмотрицательные бактерии, в том числе и на другие штаммы псевдомонад. Антигенная структура. Микробы имеют липополисахаридный термостабильный О-АГ и белковый термолабильный Н-АГ двух типов. По О-АГ проводят серотипирование штаммов синегнойной палочки (группоспецифический антиген). По Н-АГ разделяют на серовары. Н-АГ обладает протективными свойствами, на их основе создаются вакцины. О- антигенный комплекс синегнойной палочки — сложный макромолекулярный агрегат ЛПС
ибелков. Типо-или группоспецифические АГ P. aeruginosa представлены липополисахаридами; они являются основными структурными компонентами О-АГ, обусловливающими его специфичность. На основе структуры О-АГ проводят серологическое типирование. Белковый компонент О-АГ — антигенный комплекс, общий для псевдомонад, то есть родовой О-АГ. По структуре О-АГ выделяют более 20 серогрупп. Н-антигенный комплекс синегнойной палочки представлен термолабильными белками низкой специфичности, обусловленной различиями в строении флагеллинов. Выявлено 15 различных типов Н-АГ. Н-АГ обнаруживают лишь у жизнеспособных, подвижных бактерий, не подвергшихся какому-либо воздействию дезинфицирующих или антимикробных средств.
Факторы патогенности: фиксация за счет фимбрий и гликопротеина внеклеточной слизи, они же защищают микроба от фагоцитоза. Ферменты агрессии: фосфолипазы, гликопротеин, нейраминидаза, эластаза (оеспечивает проникновение и распространение микроорганизма). Протеаза разрушает белки, в том числе и АТ.
Токсические свойства: эндотоксин наружной мембраны клеточной стенки и экзотоксины. Эндотоксин обеспечивает интоксикацию организма и повреждает макрофаги. Экзотоксины A и S блокируют фактор элонгации, что приводит к нарушению синтеза белков на рибосомах, и разрушают эритроциты. Экзотоксин S – летальный токсин – оказывает общетоксическое действие. Лейкоцидин поражает гранулоциты, гемотоксин – эритроциты, гистотоксин – многие клетки, энтеротоксин – энтероциты слизистой оболочки ЖКТ, что нарушает водно-солевой обмен в организме. Синтез этих токсинов детерминируется плазмидами.
Патогенез: Синегнойная палочка — оппортунистический патоген, внеклеточный паразит, размножение которого связано со способностью противостоять действию защитных факторов организма. Возбудитель вызывает тяжелые гнойно — септические процессы (септицемия вызывает гибель 30-70% пациентов). Это связано с наличием разнообразных
факторов патогенности и R- плазмид, обусловливающих множественную устойчивость к антибиотикам, к действию антисептиков и дезинфектантов.
Лабораторная диагностика. Свое название P.aeruginisa получила за голубовато — зеленое окрашивание отделяемого ран и перевязочного материала. Основным методом диагностики является бактериологический. Для посевов используют кровь, спиномозговую жидкость, раневое отделяяемое, гной, мочу, мокроту. Важным является обнаружение пигмента пиоцианина. В жидкой среде его выявляют добавлением небольшого объема хлороформа
— наблюдается сине — зеленое окрашивание. Учитывают термофильность бактерий – рост при 42градусах. При микроскопии обнаруживают грамотрицательные палочки, пробы на цитохромоксидазу и каталазу положительны, +способность окислять глюкозу. культуры типируют в РА с О- и Н- антисыворотками. Видовая идентификация в пределах рода ведется с учетом биохимических, культуральных и антигенных свойств. Внутривидовая идентификация, имеющая эпидемиологическое значение, проводится с помощью АТ, бактериофагов, а также на основе молекулярных особенностей ДНК или рибосомальной РНК. Серологические методы: обнаружение АТ к АГ синегнойной палочки (экзотоксину А, ЛПС) в РСК*, РПГА*, ИФА* и других серологических реакциях.
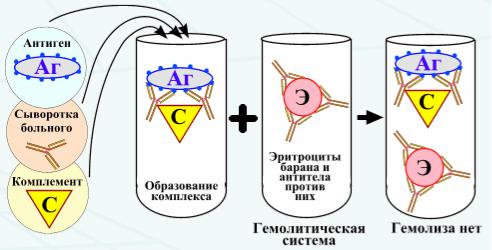
РСКРеакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигенов и антител они образуют иммунный комплекс, к которому через Fcфрагмент антител присоединяется комплемент (С), т.е. происходит связывание комплемента комплексом антиген - антитело. Если же комплекс антиген - антитело не образуется, то комплемент остается свободным. PCK проводят в две фазы 1-я фаза - инкубация смеси, содержащей антиген + антитело + комплемент, 2-я фаза (индикаторная) - выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген - антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет (реакция положительная). Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит - антиэритроцитарное антитело, вызывая гемолиз (реакция отрицательная).
Схема РСК с сывороткой больного
