
fiz_osnovy_elektroniki_КЛ
.pdfМинистерство образования Российской Федерации
Владивостокский государственный университет экономики и сервиса
________________________________________________________
Г.А. ГУДАКОВ
ФИЗИЧЕСКИЕ ОСНОВЫ ЭЛЕКТРОНИКИ
Курс лекций
Владивосток Издательство ВГУЭС
2003
1
ББК 32.841
Г 93
Рецензенты: Галкин Н.Г., д-р физ.-мат. наук, заведующий лабораторией ИАПУ ДВО РАН; Кузнецова С.В., канд. физ.-мат. наук, кафедра физики и технологии материалов для полупроводниковой микроэлектроники ИФИТ ДВГУ
Гудаков Г.А.
Г 93 ФИЗИЧЕСКИЕ ОСНОВЫ ЭЛЕКТРОНИКИ: Курс лекций. – Владивосток: Изд-во ВГУЭС, 2003. – 156 с.
Курс «Физические основы электроники» является базовым для многих курсов специальности "Бытовая радиоэлектронная аппаратура": радиоматериалы и радиокомпоненты, электроника и микроэлектроника, метрология и радиоизмерения, аналоговые устройства РЭА, усилительные устройства БРЭА и других отраслей радиоэлектроники, которые базируются на материалах и знании их свойств.
Для студентов специальностей 201500 "Бытовая радиоэлектронная аппаратура" и 201700 "Средства радиоэлектронной борьбы".
ББК 32.841
© Издательство Владивостокского государственного университета экономики и сервиса, 2003
2
ВВЕДЕНИЕ
Курс «Физические основы электроники» является теоретическим, основополагающим для ряда курсов специальности "Бытовая радиоэлектронная аппаратура".
Последующие курсы: радиоматериалы и радиокомпоненты, электроника и микроэлектроника, устройства СВЧ и антенны, усилительные устройства БРЭА, основы телевидения, устройства записи и воспроизведения сигналов, аналоговая и цифровая аудио-видеотехника и т.д. Может показаться, что ряд физических явлений не используется в радиоэлектронике, но история ее развития уже показала, что явления, сегодня не использующиеся, завтра могут быть использованы. Примеры: гетеропереходы, шоттковские переходы и другие.
3
1. ОБЩИЕ СВОЙСТВА ТВЁРДЫХ ТЕЛ
Электрические, магнитные и диэлектрические свойства вещества зависят прежде всего от валентных электронов. В твѐрдых телах эти электроны образуют неоднородное, размытое облако электронного заряда вокруг более тяжелых ядер, которые более неподвижны, чем электроны, и занимают более определѐнные положения. Непосредственно увидеть глазом это нельзя, но специальные методы позволяют получать много сведений о структуре твѐрдых тел. С помощью оптического микроскопа можно увидеть отдельные зѐрна в поликристаллическом теле, а электронный микроскоп позволяет увидеть тонкие детали строения зѐрен. С помощью ионного проектора (к≤107 раз) ясно различаются отдельные атомы и симметрия их расположения, различаются дефекты структуры (атомы внедрения), т.е. некоторые аспекты строения твѐрдых тел можно рассмотреть и визуально.
Основное
За счѐт электронов атомы объединяются в кристаллы.
При медленном охлаждении образуются монокристаллы, при быстром охлаждении – поликристаллы, при очень быстром охлаждении – аморфные тела.
Различают чистые кристаллы и кристаллы с дефектами.
Типы связи атомов, образование кристаллов, их дефектность – это основа разнообразных свойств твѐрдых тел.
1.1. Силы связи Внутренняя структура твѐрдых тел
Атомы в твѐрдых телах располагаются периодически по кристаллу. Для установления такой устойчивой структуры необходимо, чтобы между ними действовали: a) силы притяжения, препятствующие удалению частиц друг от друга, и б) силы отталкивания, не позволяющие частицам слиться друг с другом.
1.1.1 Силы Ван-дер-Ваальса
Это наиболее общие силы связи, действующие при взаимодействии любых атомов. Впервые Ван-дер-Ваальс дал объяснение различия свойств идеального и реального газа, предложил поправки в уравнения идеального газа. Для идеального газа
pv RT ,
4
а для реального
p a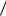 v 2
v 2 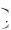 v b
v b RT ,
RT ,
где a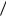 v 2 и b – поправки, учитывающие взаимодействие атомов. В чис-
v 2 и b – поправки, учитывающие взаимодействие атомов. В чис-
том виде эти силы проявляются между молекулами с насыщенными химическими связями (O2, H2, N2 и др.).
В общем случае связи Ван-дер-Ваальса включают: 1) дисперсионное, 2) ориентационное и 3) индукционное взаимодействия.
Дисперсионное взаимодействие
а |
б |
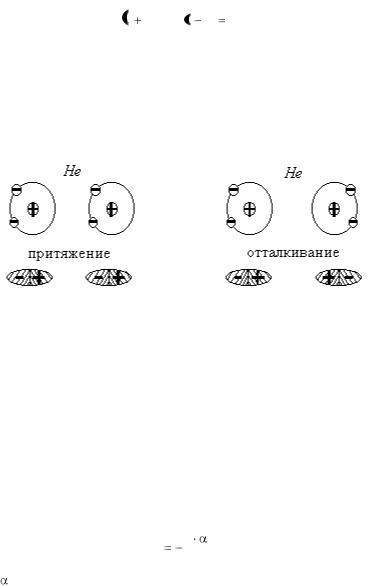
Рис. 1.1. Дисперсионное взаимодействие
Распределение электронной плотности He обладает сферической симметрией, вследствие чего электронный момент равен нулю. Это средний момент, однако создаются мгновенно меняющиеся электронные диполи. При сближении двух атомов между движением электронов этих атомов устанавливается корреляция (согласование), которая приводит к возникновению сил взаимодействия (рис. 1.1 a, б). При положении, указанном на рис. 1.1а, энергия системы понижается, т.е. приводит к притяжению атомов He, и эта конфигурация более вероятна и чаще встречается. Силы связи, возникающие вследствие согласованного
движения электронов в соседних атомах, принято называть дис-
персионными силами. Энергия дисперсионного взаимодействия
3 |
2 J |
|
|
|
U д |
|
|
, |
(1.1) |
|
4r 6 |
|||
|
|
|
|
|
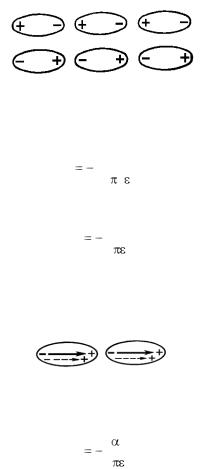
где – поляризуемость, J – энергия возбуждения, r – расстояние между атомами. Этот расчет впервые проведен Лондоном в 1930 г.
5
Ориентационное взаимодействие
Если молекулы обладают дипольным моментом М (т.е. являются полярными), то между ними возникает электростатическое взаимодействие, которое стремится расположить молекулы в строгом порядке, при этом энергия системы уменьшается. Тепловое движение нарушает этот порядок. Поэтому энергия системы зависит от температуры.
Рис. 1.2. Ориентационное взаимодействие
Для высоких температур
Uop |
|
M 4 |
. |
(1.2) |
||
24 |
2 |
02 kTr6 |
||||
|
|
|
||||
Для низких температур
U op |
|
M 2 |
. |
(1.3) |
|
2 |
0 r 3 |
||||
|
|
|
Индукционное взаимодействие
Полярные молекулы с высокой поляризуемостью могут вызывать наведенную поляризацию нейтральных молекул.
Рис. 1.3. Индукционное взаимодействие
Энергия индукционного взаимодействия
Uин |
|
M |
2 |
. |
(1.4) |
|
|
|
|
||||
8 |
02 r 6 |
|||||
|
|
|
||||
Итак, при сближении двух молекул могут иметь место все три типа связи, т.е. Uс = Uд + Uор + Uин. Эти связи реализуются по-разному, причем энергия связей Ван-дер-Ваальса невелика (табл. 1.1).
6
|
|
|
Таблица 1.1 |
|
|
|
|
|
|
|
|
Доля, % |
|
|
Соединения |
|
|
|
|
д |
ин |
ор |
||
|
||||
|
|
|
|
|
H2O |
19 |
4 |
77 |
|
|
|
|
|
|
CO |
100 |
- |
- |
|
|
|
|
|
|
HCI |
81 |
4 |
15 |
|
|
|
|
|
|
NH3 |
50 |
5 |
45 |
|
|
|
|
|
1.1.2. Ионная связь
Атомы, стоящие в таблице Менделеева рядом с инертными газами, обладают склонностью принимать их конфигурацию за счет принятия электронов у атомов щелочных металлов, у которых электроны связаны слабо с ядром атома.
Так, у галоидов, стоящих непосредственно перед инертными газами, недостает одного электрона для заполнения устойчивого слоя. Поэтому они обладают высоким сродством к дополнительному электрону. Связь между галоидами и металлами осуществляется следующим образом: вначале происходит перезарядка обоих атомов – электрон атома металла переходит к атому галоида, при этом металл становится , а галоид  . Эти ионы взаимодействуют по закону Кулона как два разно-
. Эти ионы взаимодействуют по закону Кулона как два разно-
именных заряда. Такая связь называется ионной (или полярной).
Энергия напряжения ионов:
|
F |
|
|
dU от |
r |
r |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
от |
|
|
|
dr |
|
|
|
|
|
0 |
|
||
|
|
|
|
|
|
|
|
|
|
; |
(1.5) |
|||
|
|
|
|
dU пр |
|
|||||||||
|
F |
|
|
r |
r |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
пр |
|
|
|
dr |
|
|
|
|
|
0 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
U c |
|
|
B |
|
|
|
|
q 2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
, |
(1.6) |
|
|
|
r n |
|
|
|
|
|
|
||||||
|
|
|
4 |
|
0 r |
|
||||||||
где n >1, или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Uc |
q2 |
1 |
|
1 |
|
для N молекул; |
|
|||||||
4 0 r |
|
|
n |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
7
U реш |
NA |
q2 |
1 |
1 |
, |
(1.7) |
|
4πε0 r0 |
n |
||||||
|
|
|
|
|
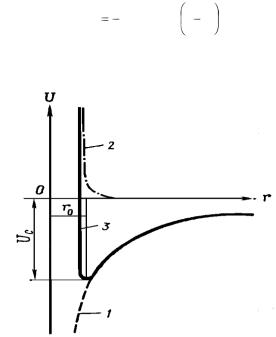
где А – постоянная Маделунга (рис. 1.4).
Рис. 1.4. 1 – притяжение; 2 – отталкивание; 3 – энергия связи Uс
В табл. 1.2 приведены экспериментальные значения связи для ряда ионных кристаллов
|
|
|
|
Таблица 1.2 |
|
|
|
|
|
|
Uc, кДж/моль |
|
|
|
Кристалл |
|
|
|
Погрешность, % |
Экспер. |
|
Теорет. |
||
|
|
|
||
|
|
|
|
|
NaCl |
- 752 |
|
- 754 |
< 0,2 |
|
|
|
|
|
RbBr |
- 635 |
|
- 645 |
~ 1,5 |
|
|
|
|
|
CsJ |
- 595 |
|
- 585 |
~ 2 |
|
|
|
|
|
1.1.3. Ковалентная связь
Эта связь осуществляется за счет обобществления электронов двух соседних атомов. Если два атома водорода расположены на расстоянии r≈50 А, то вероятность, что электрон системы А окажется вблизи атома
8
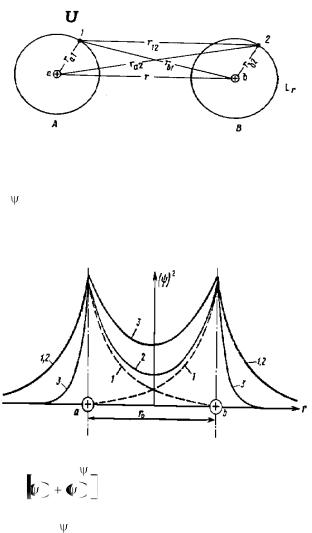
В равно одному разу в 1012 лет, поэтому атомы А и В можно считать изолированными. Если расстояние r≈2 А, то наступает заметное перекрытие электронных оболочек и частота перехода электрона равна 1014 раз в секунду, при дальнейшем сближении частота обмена становится такой большой, что теряет смысл говорить о принадлежности электрона 1 к атому А или электрона 2 к атому В (рис. 1.5).
Рис. 1.5. Ковалентная связь
Это новое состояние – электроны обобществлены. Электронная плотность 2 показана на рис. 1.6. Увеличение плотности электронных состояний между ядрами вызывает уменьшение энергии системы и приводит к возникновению сил притяжения между атомами (т.е. электронное облако как бы стягивает ядра друг к другу).
Рис. 1.6. Электронная плотность 1 – ( )2 для изолированных атомов;
2 – |
2 |
2 |
– суммарные электронные плотности |
1 |
2 |
изолированных атомов: А и В; 3 – ( )2 – при обобществлении электронов
9

Гейтлер и Лондон в 1927 г. рассчитали энергию двух сближѐнных
атомов H2:
– при антипараллельных спинах
U S |
2E0 |
|
k |
A |
; |
(1.7) |
|
1 |
S 2 |
||||||
|
|
|
|
||||
– при параллельных спинах |
|
|
|
|
|
|
|
Ua |
2E0 |
|
k |
A |
, |
(1.8) |
|
1 |
S 2 |
||||||
|
|
|
|
||||
где 2E0 – суммарная энергия изолированных атомов;
k – энергия электростатического взаимодействия электронов с ядрами, между электронами, ядер между собой (k<0);
A – энергия обменного взаимодействия (А<0), это дополнительная энергия взаимодействия, которая появляется при обобщении электронов
(|А|>|k|);
0 ≤ S ≤ 1 – так называемый интеграл неортогональности.
Состояния с энергией US – симметричные, с U0 – антисимметричные. Так как k<0, A<0 и S<1, то из (1.7) следует, что US<2E0 – это соответствует возникновению притяжения. Наличие min на кривой US(r) говорит о существовании устойчивой системы из двух атомов.
Рис. 1.7. Зависимость энергии сближенных атомов от r: 1 – Uа, 2 – Us
Для разрушения структуры требуется энергия: A=Uc (табл. 1.3). Ковалентная связь образуется в том направлении, в котором расположена большая часть электронного облака, соответствующая валентным электронам, т.е. эта связь имеет направленный характер. Особенностью ковалентной связи является также насыщаемость, т.е. только определенное количество атомов может взаимодействовать (H2 – третий отталкивается).
10
