
fiz_osnovy_elektroniki_КЛ
.pdf
|
|
Таблица 1.3 |
|
|
|
Вещество |
Uc, кДж/моль |
Uc, кДж/кг |
|
|
|
CO |
1080 |
38 |
|
|
|
H2 |
440 |
220 |
Алмаз (C) |
680 |
56 |
|
|
|
Si |
440 |
16 |
|
|
|
Ge |
350 |
5 |
|
|
|
1.1.4. Металлическая связь
Образование металлического состояния нельзя объяснить с помощью ионной или ковалентной связи. В самом деле ионная связь возникает между атомами с разным родством к электрону (атомы металла обладают одинаковым сродством к электрону).
С другой стороны, у атомов металла мало валентных электронов для образования ковалентных связей. Так, медь (Cu) имеет один валентный электрон (4S). В решетке Cu каждый атом окружен 12-ю ближайшими соседями (для ковалентной связи, следовательно, мало валентных электронов). Это указывает на то, что в металлах действует особый вид связи, называемой металлической. В чем природа этой связи? В жидком или твердом состоянии атомы сближаются настолько, что у металлов слабо связанные валентные электроны приобретают способность покидать свои атомы и свободно перемещаться внутри решетки (т.е. между ионами металла электроны распределены сравнительно однородно по всей решетке). На это также указывает высокая электропроводность металлов, осуществляющаяся за счет свободных электронов.
Рис. 1.8. Металлическая связь
На рис. 1.8 показано распределение плотности электронов между узлами кристаллической решетки алюминия Al. Только непосредствен-
11

но у узлов она резко возрастает из-за наличия внутренних оболочек атома Al. Таким образом, металлическая связь осуществляется свободными электронами. Эти электроны стягивают ионы до таких расстояний, при которых силы отталкивания уравновешивают силы металлической связи. В случае валентной связи обобществляются только пары электронов, а при металлической связи в обобществлении участвуют все атомы кристалла и все свободно перемещающиеся электроны.
1.1.5. Водородная связь
Водородная связь возникает в том случае, когда атом водорода связан с очень электроотрицательным атомом (O, F, Cl, N, и т.п.). Так, например, молекула воды H2O, как уже говорили, образуется за счет ковалентной связи, а сами молекулы между собой притягиваются за счет связи, называемой водородной.
Рис. 1.9. Водородная связь
Энергия водородных связей на порядок меньше ковалентной связи. Связь О Н – устанавливающая связь между атомами O одной молекулы и атомом H другой молекулы, ведет себя как маленький диполь –δ О и +δ H. Эта связь молекул жидкости (H2O, спиртов, кислот и др.) обусловливает повышение температуры кипения, вязкости, аномальное изменение объема. Так, для H2O без водородных связей tкип=-80 C [1]. Плотность воды 0–4 C растет из-за разрыва водородных связей, а даль-
ше термическое расширение превалирует.
1.1.6. Сопоставление различных видов связей
Силы Ван-дер-Ваальса наиболее универсальны. Они возникают во всех без исключений случаях. Но они слабы ( 104Дж/моль) и в чистом виде проявляются при взаимодействии нейтральных атомов и молекул, имеющих заполненные оболочки. Эти структуры мало устойчивы и летучи.
Ионная связь – типичная химическая связь и распространенная среди неорганических и интерметаллических соединений (Me-Se, Me-N и др. – сплавы металлов с некоторыми неметаллическими элементами,
12

обладающие металлической природой и свойствами – H, B, C, Si). Ее энергия 106 Дж/моль.
Ковалентная связь (валентная) широко распространена в органических соединениях и в некоторых металлических и интерметаллических соединениях. Ее энергия 106 Дж/моль.
Водородная связь слаба, но все же играет важную роль в природе. В реальных телах каждая связь в чистом виде почти не встречается.
Практически всегда имеет место наложение двух или более типов связи. Одна из них, определяющая структуру и свойства тел, имеет превалирующие значения.
1.2. Силы отталкивания
Для образования устойчивой системы из взаимодействующих атомов или молекул необходимо, чтобы между ними возникали не только силы притяжения, но и силы отталкивания, препятствующие беспредельному сближению частиц и их полному слиянию (в противном случае, не было бы атомов и других частиц вещества). Источником сил отталкивания являются силы кулоновского взаимодействия ядер. Энергия этого взаимодействия зависит от расстояния между ядрами и степени экранирования их электронными оболочками. Квантово-механичес-
кий расчет дает для U от e r a , где r – расстояние между ядрами,
a , где r – расстояние между ядрами,
а = 0,53  – радиус первой боровской орбиты. U от(r) быстро падает с увеличением расстояния r.
– радиус первой боровской орбиты. U от(r) быстро падает с увеличением расстояния r.
Рис. 1.10. Силы (а) и энергия (б) взаимодействия
13

Так, при изменении расстояния между протоном и атомом H с r =2а до r = а/2 (в 4 раза) U от увеличивается в ~300 раз. Итак, независимо от природы сил связи при сближении атомов имеет место следующее:
1.При достаточно большом расстоянии силы притяжения растут при сближении – 1.
2.На малом расстоянии возрастают силы отталкивания, которые начинают расти быстрее сил притяжения – 2.
3.Результирующая сила отталкивания и притяжения – 3.
При r = r0 Fот = Fприт и результирующая Fрез = 0, а энергия взаимодействия достигает минимального значения: r0 – это расстояние устой-
чивого равновесия. Энергия связи Uc – это та работа, которую нужно затратить, чтобы развести атомы в бесконечность. Частицы не могут свободно покидать свои положения равновесия, так как это приводит к увеличению сил, стремящихся вернуть их в положение равновесия.
14

2. НЕКОТОРЫЕ ЭЛЕМЕНТЫ ГЕОМЕТРИИ КРИСТАЛЛОВ
Атомы под действием сил связи в твердых телах располагаются периодически на расстояниях r0 по осям x, y, z, образуя, таким образом, определенный «узор» с определенной симметрией. Такие твердые тела называют кристаллами, а расположение атомов в них кристаллической структурой (или решеткой). Здесь мы рассмотрим, как образуются кристаллы, основные типы кристаллических структур и математическое описание этих структур.
2.1. Образование кристаллов. Кристаллическая решетка
Начнем с того, что вспомним всеобщий закон природы – любая система стремится к минимуму энергии. При охлаждении жидкого металла в твердой фазе образуется равновесное состояние с определенным расположением атомов. Согласно вышеупомянутому закону можно уверенно сказать, что энергия всех атомов твердого тела меньше, чем у жидкого. Пусть в жидкой фазе при медленном охлаждении два атома расположились так, что их энергия минимальна (рис. 2.1 а).
Рис. 2.1. Плотная упаковка круглых шаров на плоскости
Согласно кривой Uc = f(r) расстояние между ними r = r0. Следующий атом, взаимодействуя с ними, займет такое положение, которое также соответствует минимуму Uc (рис. 2.1 б) и т.д. (рис. 2.1 в, г). То есть за счет взаимодействия атомы располагаются в определенном порядке относительно друг друга. Т.е. мы нарисовали плоскую кристаллическую структуру. Трехмерные кристаллы состоят из множества атомных плоскостей, сложенных друг с другом в определенном порядке. Существует несколько способов такой упаковки. В такой повторяющейся структуре можно выделить элементарные ячейки, из которых можно построить весь кристалл. Одной из таких ячеек (блоков) может служить ромб или параллелограмм (рис. 2.2).
Трансляция (перемещение блока на расстояние, кратное межатомному расстоянию) этого блока позволяет построить весь кристалл. В трехмерных структурах элементарной ячейкой служит параллелепипед со сторонами a, b, c. Всю кристаллическую решетку можно построить, транслируя элементарную ячейку по осям x, y, z. Бывают самые разнообразные кристаллические структуры.
15

Рис. 2.2. Кристаллическая решетка, полученная путем трансляции элементарной ячейки
2.2.Типичные кристаллические решетки
2.2.1.Простая кубическая структура
Образуется элементарный куб (a = b = c, = =  = 90 – параметрическая система).
= 90 – параметрическая система).
Рис. 2.3. Простая кубическая ячейка
Каждый атом является собственностью восьми ячеек, поэтому на одну элементарную ячейку приходится один атом, а каждый атом имеет 6 соседей.
2.2.2. Объемно-центрированная кубическая структура
На одну ячейку приходится два атома и 8 соединений (рис. 2.4 а).
Рис. 2.4. Объемно-центрированная (а) и гранецентрированная (б) ячейки
16

2.2.3. Гранецентрированная кубическая структура
На одну ячейку приходятся 4 атома и 12 соседей (рис. 2.4 б). Многие элементы кристаллизируются в одну из этих трех модифи-
каций. Но ряд элементов и очень многие химические соединения имеют другие структуры.
2.2.4. Структура алмаза
Некоторые из элементов представляют собой комбинации из рассмотренных структур. В этих комбинированных структурах одна решетка проникает внутрь другой. Одной из таких структур является решетка алмаза. Для нас она интересна в том плане, что такую структуру имеют очень многие полупроводники. Структура алмаза представляет сочетание двух гранецентрированных кубических решеток, вставленных друг в друга. У одной решетки начало координат совпадает с точкой (0, 0, 0), а у другой – сдвинута вдоль диагонали куба в точку (а/4, а/4, а/4). Каждый атом имеет 4 ближайших соседей. Элементарная ячейка включает 8 атомов. Эту объемную структуру для наглядности изображают на плоскости.
Рис. 2.5. Плоская решетка с базисом ( A )
На рис. 2.6, а показана объемная решетка с базисом, а на рис. 2.6 б – элементарная ячейка структуры алмаза.
2.3. Некоторые характеристики элементарных кубических структур
В кристаллических структурах выделяют следующие характеристики: а) количество ближайших соседей (координатное число); б) атомный радиус; в) количество атомов в элементарном кубе.
17

Рис. 2.6. Структура алмаза
Для описания структур эти характеристики представлены в табл. 2.1.
Таблица 2.1
|
ПК |
ОЦК |
ГЦК |
Алмаз |
|
|
|
|
|
Координатное число |
6 |
8 |
12 |
4 |
Атомный радиус (а – ребро куба) |
а/2 |
a |
3 |
|
a 2 |
|
a 3 |
|
|
|
|
|
|
|
|
||
|
4 |
4 |
8 |
|
||||
|
|
|
|
|||||
|
|
|
|
|
|
|
||
Количество атомов в элементарной ячейке |
1 |
|
2 |
4 |
8 |
|
||
2.4. Индексы узлов, направлений, плоскостей
Положение |
любой частицы в решетке определяется вектором |
r x y z r |
ma nb pc , где m, n, p – целые числа; а, b, c – па- |
раметры решетки (т.е. наименьшее значение вектора трансляции).
Рис. 2.7. Узел, соответствующий индексу [[mnp]].
18

2.4.1. Индексы узлов
Положение любого узла решетки относительно начало координат определяется заданием его трех координат: x = ma, y = nb, z = pc. Если за единицу измерения длины вдоль осей решетки принять параметры решетки (a, b, c), то координаты узла будут просто числами n, m, p. Эти числа называют индексами узла.
Индексы узла записываются [[mnp]].
Например, если узел задан координатами x = -2a, y = -b, z = 3c, то его индекс – 213 .
2.4.2. Индексы направлений
Для описания направления в кристалле выбирается прямая, проходящая через начало координат. Еѐ положение определяется индексами первого узла, через который проходит [[mnp]]. Направление обозначают [mnp].
Рис. 2.8. Основные узлы и направления в кубическом кристалле
2.4.3 Индексы плоскостей
Положение плоскости определяется заданием трех отрезков A, B, C, которые они отсекают на осях решетки. Индексы такой плоскости находятся следующим образом. Выражают отрезки A, B, C в осевых единицах и записывают величины, обратные им: 1/A, 1/B, 1/C.
Полученные дроби приводят к общему знаменателю. Пусть это будет число D. Целые числа h = D/A, k = D/B, l = D/C и являются индексами плоскости → (hkl). Например: A=1/2; B=2; C= 1/3; 1/A=2; 1/B=1/2; 1/C=3; D= 2; D/A= 4= h; D/B=1= k, D/C=6=l, т.е. индекс этой плоскости (416).
19
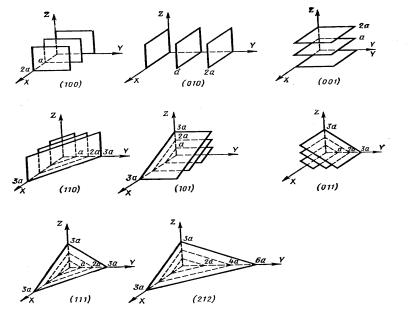
Рис. 2.9. Основные плоскости кубической решетки
2.5. Классификация решеток
По типу связи решетки выделяют:
а) ионные или координационные (ионная связь); б) поляризационные или молекулярные (связь Ван-дер-Ваальса); в) атомные (ковалентная связь); г) металлические (металлическая связь); д) с водородной связью.
20
