
02.Углеводороды
.pdf
|
CH2 |
|
|
|
CH2 |
|
|||
H2C |
|
CH2 |
+ Cl2 |
|
H2C |
|
|
CHCl |
+ HCl |
|
|
|
|||||||
H2C |
|
|
|
|
|
|
|
||
CH2 |
|
|
H2C |
CH2 |
|
||||
|
CH2 |
|
|
|
CH2 |
|
|||
циклогексан |
|
|
хлорциклогексан |
|
|||||
Циклобутаны реагируют с галогенами в обоих направлениях – присоединяют галоген, размыкая цикл, и замещают атом водорода галогеном без размыкания цикла.
Гидрогалогенирование. Циклопропан и его гомологи реагируют с галогеноводородами с разрывом цикла и присоединяют галогеноводороды в соответствии с правилом Марковникова:
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
+ HBr |
|
CH3 |
|
CH2 |
|
CHBr |
|
R |
|
|
|
|
|
|
|||||||
|
|
|
||||||||||
R |
|
HC |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Циклоалканы с большим (чем три) числом углеродных атомов в цикле с галогеноводородами не реагируют.
Окисление. При действии сильных окислителей циклоалканы (с разрывом цикла) превращаются в двухосновные кислоты с тем же числом углеродных атомов:
H2C |
CH2 |
[ O ] |
|
|
|
|
|
|
|
|
|
|
|||
CH2 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
HOOC |
|
CH2 |
|
CH2 |
|
CH2 |
|
CH2 |
|
COOH |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||
H2C |
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
циклогексан |
|
|
|
гександиовая кислота |
|||||||||||
Реакции сужения и расширения циклов. При нагревании в присутствии кислот Льюиса как катализаторов может происходить сужение или расширение циклов циклоалканов и их производных. Например, этилциклобутан при нагревании с AlCl3 изомеризуется в метилциклопентан:
|
|
CH2 |
|
CH3 |
|
|
CH3 |
||
|
|
|
|
|
|||||
|
|
|
|
|
AlCl3; t |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этилциклобутан |
метилциклопентан |
||||||||
58
=============================================================
2.6. ОДНОЯДЕРНЫЕ АРЕНЫ
=============================================================
2.6.1. СТРОЕНИЕ БЕНЗОЛА. АРОМАТИЧНОСТЬ
Простейшим представителем одноядерных ароматических углеводородов является бензол C6H6. Соединению этого состава приписывались разные структурные формулы, но все они не объясняли в полной мере химических свойств бензола. В 1865 г. немецкий химик А. Кекуле предложил для бензола циклическую структуру с чередующимися одинарными и двойными связями:
H
H C C
C C C
C  H
H
H C C
C C C
C H
H
H
В 1872 г. Кекуле выдвинул осцилляционную гипотезу, согласно которой три двойные связи в молекуле бензола не фиксированы, а непрерывно перемещаются (осциллируют) между двумя возможными положениями:
Правильно отражая некоторые свойства бензола, формула Кекуле тем не менее не согласовывалась с рядом установленных фактов. По-прежнему оставалось неясным, почему при наличии в молекуле трех двойных связей бензол проявляет значительную инертность в реакциях присоединения и гораздо более склонен к реакциям замещениям, почему он устойчив к нагреванию и действию окислителей. Все это возвращало химиков к пересмотру структуры бензола.
В соответствии с современными представлениями, основанными на данных квантовой химии и физико-химических исследований, молекула бензола представляет собой правильный плоский шестиугольник. Все углеродные атомы находятся в состоянии Sp2-гибридизации. При этом каждый атом углерода образует три - связи (одну С Н и две С С), лежащие в одной плоскости под углом 120 ° друг к другу, и предоставляет одну p-орбиталь для образования замкнутой сопряженной системы, электронная плотность которой равномерно распределена (делокализована) между углеродными атомами и сконцентрирована в основном над и под плоскостью - скелета молекулы. Делокализация -электронной плотности и выравненность связей в бензольном
59

кольце графически изображается в виде окружности внутри правильного шестиугольника:
или
Однако наряду с таким изображением в химии широко используется и формула Кекуле, которая особенно удобна для описания механизмов реакций.
Но, применяя формулу Кекуле, необходимо подразумевать делокализацию - электронной плотности и выравненность связей в бензольном кольце.
Совокупность специфических свойств бензола, а именно, высокая стабильность, инертность в реакциях присоединения и склонность к реакциям замещения, получила общее название ароматичность, или ароматические
свойства.
В 1931 г. немецкий ученый Э. Хюккель на основе квантовохимических расчетов с помощью метода МО сформулировал правило стабильности циклических сопряженных систем, которое представляет собой теоретически обоснованный метод, позволяющий предсказать, будет ли циклическая сопряженная система ароматической или нет. Согласно правилу Хюккеля
критерием ароматичности органического соединения является наличие в его структуре плоского цикла, содержащего замкнутую сопряженную систему,
включающую (4n + 2) -электронов, где n 0, 1, 2, 3 и т. д.
К наиболее распространенным ароматическим системам, содержащим 6-электронов (n 1) относятся бензол и его производные.
2.6.2. НОМЕНКЛАТУРА И ИЗОМЕРИЯ ОДНОЯДЕРНЫХ АРЕНОВ
По заместительной номенклатуре ИЮПАК одноядерные арены рассматривают как продукты замещения бензола: метилбензол, этилбензол, винилбензол и т. д. При наличии в бензольном кольце двух и более заместителей их положение указывают цифрами. Нумерацию атомов углерода бензольного кольца осуществляют таким образом, чтобы заместители имели возможно меньшие номера. В дизамещенных бензолах наряду с цифровым обозначением положений заместителей применяют также приставки: орто- (о-) (положения 1,2); мета- (м-) (положения 1,3) и пара- (п-) (положения 1,4).
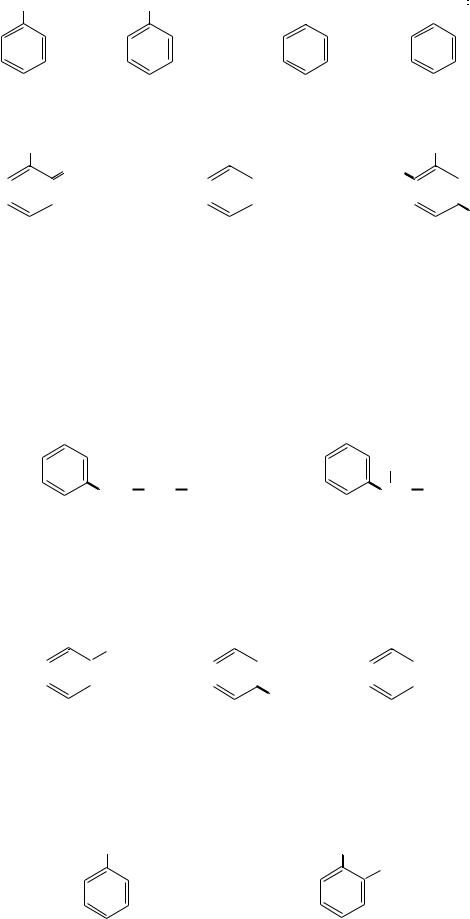
Кроме названий по заместительной номенклатуре, в ряду одноядерных аренов сохранились и тривиальные названия: толуол, ксилол, кумол и другие. Ниже приведены некоторые представители аренов (тривиальные названия даны после заместительных):
60
CH3 |
C2H5 |
H3C |
|
|
CH |
|
CH3 |
|
CH |
|
CH2 |
||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метилбензол |
этилбензол |
изопропилбензол |
винилбензол |
(толуол) |
|
(кумол) |
(стирол) |
|
|
CH3 |
|
H3C |
|
|
CH |
|
CH3 |
|
|
C2H5 |
||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||||
|
2 |
|
|
|
|
CH3 |
1 |
|
|
|
|
|
H C 1 |
|
2 |
|
|
|
|
|||||
3 |
1 |
2 |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
3 |
|||||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
5 |
|
6 |
|
|
|
|
|
|
4 |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||||
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|||
1,2-диметилбензол |
1-изопропил-4-метилбензол |
1,4-диметил-2-этилбензол |
||||||||||||||||||||||
(о-ксилол) |
|
(п-цимол) |
|
|
|
|
|
|
|
|
|
|
||||||||||||
Изомерия гомологов бензола обусловлена разными структурами, числом и положением заместителей в бензольном кольце. Однозамещенные гомологи бензола не имеют изомеров положения, поскольку все атомы углерода в бензольном кольце равноценны. Вместе с тем для них характерна изомерия, обусловленная разной структурой заместителя:
|
CH3 |
CH2 CH2 CH3 |
CH CH3 |
пропилбензол |
изопропилбензол |
Дизамещенные бензолы существуют в трѐх изомерных формах, имеющих разное положение заместителей в бензольном кольце (изомеры положения):
|
CH3 |
|
CH3 |
|
CH3 |
|||||||||
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|||
1,2-диметилбензол |
1,3-диметилбензол |
1,4-диметилбензол |
||||||||||||
|
(о-ксилол) |
(м-ксилол) |
(п-ксилол) |
|||||||||||
Кроме того, для гомологов бензола характерна изомерия, обусловленная разным числом заместителей в бензольном кольце, например:
CH2CH3 |
CH3 |
CH3
этилбензол |
о-ксилол |
61
2.6.3. СПОСОБЫ ПОЛУЧЕНИЯ ОДНОЯДЕРНЫХ АРЕНОВ
2.6.3.1. ПРИРОДНЫЕ ИСТОЧНИКИ
Основными природными источниками ароматических углеводородов являются нефть и каменный уголь.
Получение из нефти. В сырой нефти содержится небольшое количество ароматических углеводородов. Поэтому с целью увеличения их массовой доли нефть подвергают так называемой ароматизации, т. е. нагревают при высокой температуре и давлении в присутствии катализаторов. При этом протекают процессы дегидрирования, изомеризации и циклизации. Ниже приведены схемы некоторых типичных реакций:
|
|
|
3000C; Pt |
|
|
|
|
|
+ |
|
|
3H2 |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|||||||||||||
циклогексан |
|
|
|
бензол |
|
|
|
|||||||||
|
|
|
|
|
|
|
5000C |
|
|
CH3 |
||||||
CH3CH2CH2CH2CH2CH2CH3 |
|
|
|
|
|
+ 4H2 |
||||||||||
|
|
|
|
|
||||||||||||
|
|
Cr2O3 / Al2O3 |
|
|
||||||||||||
|
гептан |
|
|
толуол |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
0 |
|
|
|
|
|
|
CH3 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3CH2CH2CH2CH2CH2CH2CH3 |
|
|
|
500 C |
|
|
|
|
+ 4H2 |
|||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Cr2O3 / Al2O3 |
|
|
|
|
||||||||||
|
октан |
|
|
|
|
о - ксилол |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
В результате ароматизации исходное сырье, содержащее около 10 % аренов и 65 % алканов, превращается в продукт, включающий 50 65 % аренов.
Получение из каменного угля. При нагревании каменного угля без доступа воздуха до 1000 1300оС образуется кокс, коксовый газ и каменноугольная смола. В коксовом газе содержится бензол и толуол. В каменноугольной смоле бензол, толуол, ксилолы, нафталин, антрацен, фенолы и многие другие всего более 120 индивидуальных веществ.
2.6.3.2. СИНТЕТИЧЕСКИЕ МЕТОДЫ ПОЛУЧЕНИЯ БЕНЗОЛА И ЕГО ГОМОЛОГОВ
Циклотримеризация алкинов. При нагревании в присутствии катализаторов алкины образуют бензол и его гомологи (см. раздел «Алкины»):
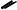 CH
CH
CH CH
CH CH
 CH
CH
t0
кат.
62

Взаимодействие смеси алкил- и арилгалогенидов с металлическим натрием (реакция Вюрца Фиттига). При этом образуются гомологи бензола:
|
|
|
Br |
|
|
|
|
|
|
|
C2H5 |
|
|
|
+ 2Na |
+ Br |
|
C2H5 |
|
|
|
|
+ 2NaBr |
|
|
||||||||||
бромбензол |
бромэтан |
|
|
этилбензол |
|||||||
В качестве побочных продуктов в процессе реакции Вюрца Фиттига образуются алканы, а также дифенил и его гомологи:
2 C2H5Br |
+ 2Na |
|
|
CH3CH2CH2CH3 |
+ 2NaBr |
||
|
|||||||
|
|
|
|
бутан |
|
||
2 C6H5Br |
+ 2Na |
|
|
C6H5 |
|
C6H5 |
+ 2NaBr |
|
|
|
|||||
|
|
|
|
дифенил |
|
||
Алкилирование ароматических углеводородов по Фриделю Крафтсу.
Реакция Фриделя Крафтса (1887 г.) представляет собой общий метод получения гомологов бензола, основанный на взаимодействии ароматических углеводородов с алкилирующими агентами галогеналканами, алкенами и спиртами (см. ниже).
Дегидрирование циклогексана и его производных. Н.Д. Зелинский показал, что при каталитическом воздействии палладия или платины на циклогексан и его производные при температуре 300 оС от них отщепляется водород с образованием бензола и его производных:
|
|
|
|
|
|
|
3000C; Pt |
|
|
|
|
|
+ |
3H2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||
циклогексан |
|
|
|
|
бензол |
|
||||||||||
|
|
CH3 |
3000C; Pt |
|
|
CH3 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
3H2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||||
метилциклогексан |
|
|
метилбензол |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
(толуол) |
|
||||
2.6.4. ХИМИЧЕСКИЕ СВОЙСТВА БЕНЗОЛА И ЕГО ГОМОЛОГОВ
Реакционная способность бензола и его гомологов определяется главным образом наличием в структуре замкнутой -электронной системы, которая является областью повышенной электронной плотности молекулы и способна притягивать положительно заряженные частицы электрофилы. Поэтому ароматические углеводороды, как и алкены, обладают нуклеофильным
63
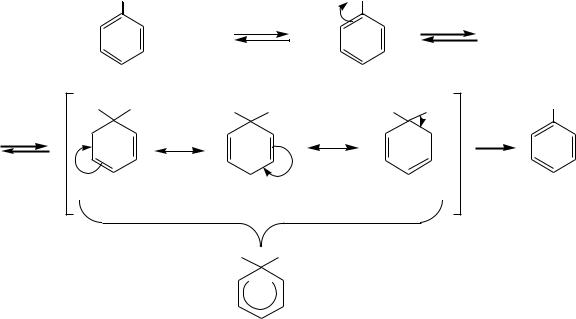
характером. Однако арены, в отличие от ненасыщенных соединений, при взаимодействии с электрофильными реагентами более склонны к реакциям замещения, а не присоединения, поскольку при этом сохраняется их ароматическая система. Эти реакции носят название реакций электрофильного замещения SE.
Реакции присоединения для аренов менее характерны, так как они приводят к нарушению ароматичности, с трудом вступают ароматические углеводороды и в реакции окисления.
2.6.4.1. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SE)
Механизм реакций электрофильного замещения в бензольном ядре
включает несколько ступеней. Сначала происходит атака -электронной системы бензольного кольца электрофильной частицей X+. В результате их электростатического взаимодействия образуется неустойчивый -комплекс, представляющий собой координационное соединение, в котором бензольное кольцо донор электронов, а электрофил акцептор. Образование -комплекса является быстрой и обратимой стадией реакции. Ароматичность бензольного кольца при этом не нарушается.
|
H |
|
+ |
H |
|
|
|
|
X |
|
|
||
|
+ |
|
|
|
|
|
|
+ X |
|
|
|
|
|
|
|
|
комплекс |
|
|
|
X |
H |
X |
H |
X |
H |
X |
|
||||||
+ |
|
|
|
|
+ |
|
|
|
|
|
|
|
- H+ |
|
|
+ |
|
III |
|
|
|
I |
II |
|
|
|
|
|
|
X |
H |
|
|
|
|
|
|
+ |
|
|
|
|
комплекс |
IV |
|
|
|
|
Поглощая некоторое количество энергии, -комплекс превращается затем |
||||||
в -комплекс |
(карбкатион). |
В отличие от |
-комплекса, |
в -комплексе |
||
электрофильная частица образует ковалентную связь с одним из атомов углерода бензольного кольца за счет двух его -электронов. При этом происходит нарушение ароматической системы бензольного цикла, так как один из атомов углерода переходит из состояния Sp2- в состояние Sp3-
64
гибридизации. Оставшиеся четыре -электрона бензольного кольца делокализованы между пятью атомами углерода.
Строение -комплекса можно представить в виде резонансного гибрида структур I, II, III, но чаще его изображают структурой IV. Далее -комплекс отщепляет протон от атома углерода, связанного с электрофилом, и тем самым восстанавливает ароматичность бензольного кольца.
К наиболее важным реакциям электрофильного замещения в бензольном ядре относятся реакции нитрования, галогенирования, алкилирования, ацилирования и сульфирования.
Нитрование. Это процесс замещения атома водорода в бензольном ядре на нитрогруппу NO2. В качестве нитрующих агентов в реакции нитрования чаще всего используют смесь концентрированных азотной и серной кислот (нитрующую смесь):
|
H2SO4; 600C |
|
NO2 |
|||||
+ HNO 3 |
|
|
|
|
|
+ H2O |
||
|
|
|
||||||
|
|
|
|
|
|
|
||
|
||||||||
|
|
нитробензол |
||||||
Атакующей электрофильной частицей в реакции нитрования является ион нитрония NO2+, который образуется в результате кислотно-основной реакции между азотной и серной кислотами, где азотная кислота играет роль основания.
1. H SO |
|
|
|
|
|
|
|
H + |
+ |
HSO - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
2 |
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2. |
.. |
|
|
|
NO |
|
|
+ H + |
|
|
|
|
|
|
|
|
|
+ |
|
|
NO |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
||||||||||||||||
H |
|
O |
|
|
|
|
|
|
|
|
|
H |
|
|
O |
|
|
|
|
|
|
|
H O |
+ |
|
NO |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
.. |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
O |
N |
|
H |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
3. |
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H |
+ |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
комплекс |
|
|
|
|
|
комплекс |
|
|
нитробензол |
||||||||||||||||||||||||||
4. |
H + |
+ |
|
HSO - |
|
|
|
|
|
|
|
H |
SO |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Галогенирование. Замещение атома водорода в бензольном ядре на атом хлора или брома осуществляют действием на бензол и его гомологи свободного хлора или брома в присутствии катализаторов кислот Льюиса (AlCl3, FeBr3, ZnCl2 и других):
65
|
|
|
Cl |
|||
+ Cl2 |
FeCl3 |
|
|
|
+ HCl |
|
|
||||||
|
|
|
|
|
||
|
||||||
|
|
хлорбензол |
||||
Под действием катализатора, на атоме металла которого имеется дефицит электронной плотности, молекула галогена поляризуется. Связь в ней рвется гетеролитически, давая катион галогена, который и служит атакующим электрофилом.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1. |
|
Cl |
|
|
|
Cl + FeCl3 |
|
|
|
|
|
Cl |
+ FeCl4 |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
Cl |
||||||||||||
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
Cl |
|
H |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2. |
|
|
|
|
|
|
|
+ Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
- H+ |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
комплекс |
|
|
|
|
|
комплекс |
|
|
|
|||||||||||
|
бензол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлорбензол |
|||||||||||||||||||
3. |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
FeCl4 |
|
|
|
|
|
|
HCl + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
H + |
|
|
|
|
|
|
|
FeCl3 |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Алкилирование по Фриделю Крафтсу. Для введения алкильной группы в молекулу бензола и его гомологов в качестве электрофильных реагентов чаще всего используют галогеналканы. Взаимодействие аренов с галогеналканами происходит в присутствии катализаторов кислот Льюиса (AlCl3, FeCl3, ZnCl2, BF3, SnCl2 и др.), из которых наиболее часто применяют хлорид алюминия:
|
|
|
C2H5 |
|||
+ C2H5Cl |
AlCl3 |
|
|
|
|
+ HCl |
|
|
|
|
|||
|
|
|
|
|||
|
|
|
|
|
||
|
||||||
хлорэтан |
|
этилбензол |
||||
Атакующей электрофильной частицей в реакции алкилирования по Фриделю Крафтсу является карбкатион, который образуется при взаимодействии галогеналкана с кислотами Льюиса.
1. C2H5 |
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Cl + AlCl 3 |
|
|
|
|
|
C2H5 |
+ AlCl 4 |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
H |
+ |
H |
|
|
|
|
|
|
|
|
|
|
|
C H |
||||||||||||||||
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
|
C H |
5 |
|
H |
|
|
2 5 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||||
2. |
|
|
|
|
+ C2H+5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
комплекс |
|
|
|
|
комплекс |
- H |
|
|
|||||||||||||
бензол |
|
|
|
|
|
|
|
|
|
|
|
этилбензол |
|||||||||||||||||||
66

+ |
|
3. H + AlCl 4 |
HCl + AlCl 3 |
Помимо галогеналканов, для алкилирования аренов могут быть использованы спирты и алкены. Реакции с участием спиртов протекают в присутствии кислот Льюиса или минеральных кислот (H3PO4, H2SO4):
+ C2H5OH |
AlCl3 |
|
C2H5 |
H2O |
|||
|
|
|
|
+ |
|||
|
|
|
|
||||
|
|
|
|
||||
|
|||||||
|
|
|
|
|
|
|
|
Алкилирование аренов алкенами требует присутствия в качестве катализатора кислоты Льюиса и минеральной кислоты как источника протонов:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+; AlCl |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
+ CH2 |
|
CH |
|
CH3 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
пропилен |
|
|
кумол |
|||||||||
|
|
Ацилирование по Фриделю-Крафтсу. Ацилированием называют процесс |
||||||||||||||||||||
введения |
|
в молекулу |
органического |
соединения ацильной группы |
||||||||||||||||||
R |
|
C |
|
|
|
O . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Ацилирование бензола и его гомологов по Фриделю Крафтсу обычно осуществляют галогенангидридами или ангидридами карбоновых кислот в присутствии кислот Льюиса. Реакция служит общим методом получения ароматических кетонов:
O
+ CH3 C Cl
Cl
|
|
|
|
|
O |
|
AlCl3 |
|
|
|
C |
CH3 |
+ HCl |
|
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетилхлорид ацетофенон
Электрофилом, атакующим бензольное кольцо, в реакции ацилирования
является ацилиевый ион |
+ |
|
|
O . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
R |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1. |
CH3 |
|
|
C |
|
Cl |
+ AlCl 3 |
|
|
|
|
CH3 |
|
|
|
C |
|
|
O + |
AlCl 4 |
|
|
|
O |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||||||||||||||||||||
|
H |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
|
H |
|
CH3 |
|
C |
|
|
H |
|
|
C CH |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
||||
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2. |
|
|
|
|
|
+ CH3 |
|
C |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
комплекс |
|
|
|
|
|
|
|
|
комплекс |
- H |
|
|
||||||||||||||||||
|
бензол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетофенон |
||||||||||||||||||||||||||
3. |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AlCl 4 |
|
|
|
|
|
|
|
HCl |
|
+ AlCl 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
H + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
67
