
01.Введение
.pdfГлава 1. ВВЕДЕНИЕ
=============================================================
Органическая химия – это наука, изучающая углеводороды и их производные.
Органическая химия как самостоятельная наука сформировалась в начале XIX в. Название «органическая» предложено Берцелиусом в 1808 г. Оно произошло от слова «организм», поскольку в то время предметом изучения органической химии являлись вещества, образующиеся только в живых организмах якобы с участием особой «жизненной силы» (виталистические представления). И хотя последующее развитие показало ошибочность виталистического взгляда на происхождение органических веществ, первоначальное название сохранилось, но смысл его принципиально изменился.
Современная органическая химия – одна из обширных областей естествознания. Выделение еѐ в самостоятельный раздел химической науки вызвано большим количеством и многообразием органических соединений, существенным различием их реакционной способности, а также исключительной важностью их в жизни человека. На сентябрь 2009 г. описано 50 млн. индивидуальных органических веществ. Ежегодно число их значительно увеличивается. Большинство этих соединений никогда не существовали в природе. Они синтезированы в химических лабораториях. Органическая химия стремительно развивает свой особый, рукотворный материальный мир. Она стала основным источником получения новых материалов, лекарственных препаратов, средств защиты растений, красителей, различных видов топлива и многих других нужных человеку веществ.
1.1.СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
ТЕОРИЯ А. М. БУТЛЕРОВА
Крупнейшим событием в развитии органической химии явилось создание в 60-х годах ХІХ в. великим русским учѐным А. М. Бутлеровым теории химического строения органических соединений. Используя открытие четырѐхвалентности атома углерода (Ф. Кекуле) и способности атомов углерода соединяться в длинные цепи (А. Купер), А. М. Бутлеров установил, что:
1.Входящие в состав молекул органических соединений атомы связаны
друг с другом в строго определѐнном порядке, согласно их валентности. Последовательность связывания атомов в молекуле называется химическим строением.
2.Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от того, в какой последовательности они связаны между собой, т. е. от химического строения молекулы.
3

3.Образующие молекулу атомы или группы атомов, связанные непосредственно или через другие атомы, оказывают взаимное влияние
друг на друга, от чего зависит реакционная способность молекулы.
4.Изучив реакционную способность вещества, можно установить его строение и, наоборот, по строению вещества судить о его свойствах.
Таким образом, теория химического строения органических соединений А. М. Бутлерова – это учение о взаимосвязи, расположении и взаимном влиянии атомов в молекуле органических веществ. Она позволила не только систематизировать накопившийся к тому времени в органической химии огромный материал, но и предсказать существование новых соединений, а также указать пути их синтеза. По значимости еѐ можно сравнить с периодическим законом Д. И. Менделеева. Блестящим подтверждением теории стало получение в 1867 г. А. М. Бутлеровым предсказанного им изобутана и других углеводородов. Сегодня теория химического строения дополнена и развита стереохимическими, электронными и др. представлениями о строении органических веществ, но не теряет своей актуальности и является важнейшей частью теоретического фундамента органической химии.
1.2. СПОСОБЫ ИЗОБРАЖЕНИЯ ОРГАНИЧЕСКИХ МОЛЕКУЛ. ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Органические вещества могут быть изображены с помощью
молекулярных или структурных формул.
Молекулярные (брутто-) формулы показывают, какие атомы и в каком количестве входят в состав молекулы, но не дают информации о строении вещества. Одной и той же молекулярной формуле могут соответствовать два и более соединений. Так, молекулярную формулу С2Н6О имеет этиловый спирт С2Н5ОН и диметиловый эфир СН3 – О – СН3.
Структурные (графические) формулы отражают природу атомов, входящих в состав молекулы, их число и последовательность связывания:
|
|
|
H |
|
|
H |
|
|
|
|
|
|
H H H |
|
|
|
|
H H |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
C |
H |
|||||||||||||||||||||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
C |
|
|
H |
H |
|
C |
|
Cl |
|
|
H |
|
|
C |
|
|
C |
|
C |
|
H |
|
C |
|
|
|
C |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
H |
|
|
H |
|
|
|
|
|
|
H H H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
метан |
хлорметан |
|
|
|
|
|
|
|
|
|
|
пропан |
|
|
|
|
циклопропан |
|||||||||||||||||||||||||||
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H O H |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H |
|
C |
|
|
C H |
H |
|
C |
|
|
C |
|
|
|
H |
H |
|
C |
|
C |
|
C |
|
H |
||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
этилен |
|
|
|
|
|
|
|
|
ацетилен |
|
|
H ацетонH |
|
|||||||||||||||||||||||||||||
Химические связи в структурной формуле условно принято обозначать чертой. Атом углерода в органических соединениях всегда четырѐхвалентный. За счѐт этих валентностей образуются связи атомов углерода между собой и с атомами других химических элементов.
4

Для удобства записи часто используют сокращѐнные структурные формулы, в которых часть связей не обозначается, а приводятся лишь те, которые необходимы для однозначного описания структуры молекулы:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
||
CH4 |
|
|
CH3Cl |
CH3 |
|
CH2 |
|
CH3 |
H2C |
|
|
|
CH2 |
||||||
|
|
|
|
|
|||||||||||||||
метан |
|
|
хлорметан |
|
|
|
пропан |
|
циклопропан |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||
H2C |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
CH2 |
HC |
|
CH |
CH3 |
|
C |
|
CH3 |
||||||||||
|
|
||||||||||||||||||
|
|
|
|
||||||||||||||||
|
этилен |
ацетилен |
|
ацетон |
|||||||||||||||
Существует также упрощѐнный способ написания структурных формул. Этим способом углеродный остов молекулы изображают только валентными связями без обозначения атомов углерода и связей С–Н:
|
|
|
O |
гексан |
циклобутан |
бензол |
фуран |
Изомеры – это соединения, имеющие одинаковый качественный и количественный состав, но разное строение и поэтому разные физические и химические свойства.
Различают два основных вида изомерии – структурную (изомерия строения) и пространственную (стереоизомерия). Молекулы структурных изомеров отличаются порядком связи атомов в молекуле, т. е. химическим строением:
а) строением углеродной цепи. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||
CH3 |
|
CH2 |
|
CH2 |
|
CH3 |
CH3 |
|
CH |
|
CH3 |
(C4H10) |
||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
бутан |
2-метилпропан |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
CH3 |
H3C |
|
CH3 |
(C6H12) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
циклогексан |
|
|
метилциклопентан |
1,2-диметилциклобутан |
|
|||||||||||||
б) положением одинаковых функциональных групп или кратных связей при одном и том же углеродном скелете молекулы. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH2 |
|
CH2 |
|
|
|
OH |
CH3 |
|
CH |
|
CH3 |
(C3H8O) |
||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
пропанол-1 |
|
|
|
|
|
пропанол-2 |
|
|||||||||||||
CH3 |
|
CH2 |
|
CH |
|
|
|
CH2 |
CH3 |
|
CH |
|
|
CH |
|
CH3 |
(C4H8) |
|||||
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
бутен-1 |
|
|
|
|
|
|
|
бутен-2 |
|
|||||||||||
в) функциональными группами (межклассовая структурная изомерия). Например:
5
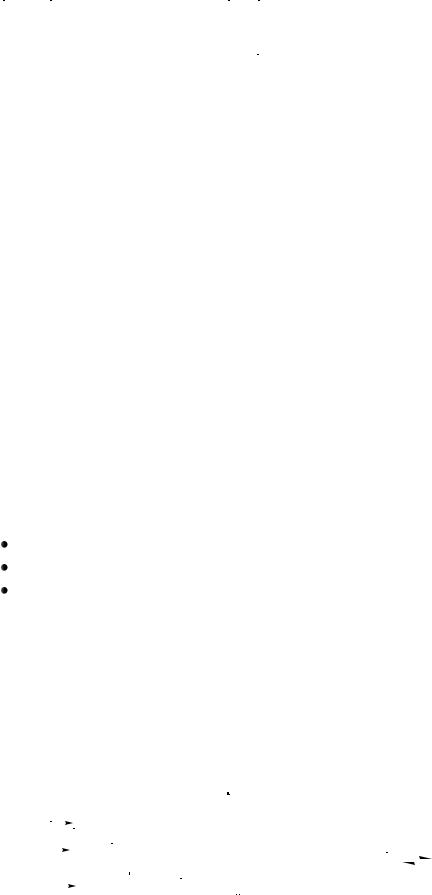
CH3 |
|
|
CH2 |
|
|
OH |
CH3 |
|
O |
|
|
CH3 |
(C2H6O) |
|||
|
|
|
|
|
||||||||||||
|
этанол |
|
|
диметиловый эфир |
|
|||||||||||
CH3 |
|
|
CH2 |
|
|
NO2 |
H2N |
|
CH2 |
|
COOH |
(C2H5NO2) |
||||
|
|
|
|
|
|
|||||||||||
|
нитроэтан |
аминоуксусная кислота |
|
|||||||||||||
Молекулы стереоизомеров имеют одинаковое химическое строение, но отличаются расположением атомов в пространстве. Например, цис-транс- изомеры, оптические изомеры и др.
1.3.ХИМИЧЕСКАЯ СВЯЗЬ
1.3.1.ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Объяснение реакционной способности органических соединений стало во многом возможным благодаря существующим представлениям об электронной структуре молекул и о природе химической связи.
Каждый атом, образуя химическую связь, принимает, отдаѐт или обобществляет валентные электроны таким образом, чтобы его внешняя электронная оболочка соответствовала конфигурации инертных газов. В зависимости от способа, которым достигается эта цель, различают несколько типов химических связей.
Основные типы химических связей:
1. Ионная (электровалентная) связь.
2.Ковалентная связь неполярная, полярная,
образованная по донорно-акцепторному механизму (координационная) и еѐ разновидность – семиполярная.
3.Водородная связь (внутри- и межмолекулярная).
Ионная (электровалентная) связь – связь, образованная за счѐт электростатического притяжения разноимѐнно заряженных ионов.
Ионная связь образуется между атомами, которые значительно отличаются по электроотрицательности (способности притягивать к себе электроны). Например:
Образование ионов натрия и хлора: |
|
Электростатическое притяжение |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
Nao |
|
|
|
|
|
|
|
|
|
Na+ |
|
|
|
|
|
|
ионов натрия и хлора |
||||||||||||
|
|
1e |
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
(ионная связь): |
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
Cl2o + |
2e |
|
|
|
|
|
|
|
|
|
|
2 |
2 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
2Cl |
|
|
+ |
|
|
|
|
|
+ |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na |
|
+ Cl |
|
|
|
|
Na Cl |
|||
|
2Nao + Clo |
|
|
|
|
|
|
2Na+ + 2Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ковалентная связь – связь, образованная за счѐт общей пары электронов. Это основной тип связи в органических соединениях.
6

Ковалентная неполярная связь – связь, при которой общая пара электронов расположена симметрично в поле ядер двух атомов. Такая связь образуется между атомами с одинаковой электроотрицательностью. Например:
H3C : CH3 |
или |
H3C |
|
CH3 |
|
ковалентная неполярная связь
Ковалентная полярная связь – связь, при которой общая пара электронов расположена несимметрично в поле ядер двух атомов и смещена в сторону более электроотрицательного атома. Такая связь образуется между атомами с различной электроотрицательностью. Например:
H3C : Cl |
или |
H3C |
|
|
Cl |
|
|
ковалентная полярная связь
Ковалентная связь, образованная по донорно-акцепторному механизму, – это связь, которая образуется за счѐт обобществления пары электронов, предоставляемой одним из атомов. Такая связь образуется обычно между атомами (или ионами), которые не имеют неспаренных электронов. Одна из частиц отдаѐт в общее пользование пару электронов (донор), другая принимает эту пару на свободную орбиталь (акцептор). Эту связь иногда называют просто донорно-акцепторной или координационной (поскольку при еѐ образовании происходит процесс координации неподелѐнной электронной пары). Например, по донорно-акцепторному механизму протекает образование иона аммония:
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|||||||
H |
|
N : + H+ |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
N |
|
H |
|
||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
||||
|
|
|
донор |
акцептор |
|
||||||||||
Образовавшаяся в ионе аммония по донорно-акцепторному механизму ковалентная связь ничем не отличается от трѐх остальных связей.
Частным случаем донорно-акцепторной связи является семиполярная связь. Она образуется за счѐт взаимодействия атомов, имеющих неподелѐнные электронные пары (доноров) с электронейтральными частицами, содержащими секстет электронов (акцепторами). В результате образования семиполярной связи атом-донор приобретает положительный заряд, а атом-акцептор – отрицательный. В итоге эти два атома оказываются связанными двояко: ковалентной связью и ионной. Поэтому семиполярную связь принято называть
полуковалентной-полуэлектровалентной или полуковалентной-
7

полуионной. Например, с помощью семиполярной связи образуется комплекс аммиака с трѐхфтористым бором:
|
|
H |
F |
|
|
|
|
|
H |
F |
|
|
H |
|
F |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
N+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
N : + B |
|
F |
|
H |
|
B |
|
|
F или |
H |
|
N |
|
B |
|
F |
|||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
F |
|
|
|
|
|
H |
F |
|
|
H |
|
F |
||||||||||||
|
|
|
|
донор |
акцептор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Семиполярная связь имеет место в нитрогруппе:
: |
|
|
|||
C6H5 |
|
N |
|
|
O |
|
|
||||
|
|||||
|
|
|
|||
нитрозобензол
: + O:
:
|
|
|
: |
|
|
|
|
|
|
C6H5 |
|
+:O: |
||
|
N |
: |
||
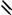 O
O
нитробензол
+ O
или C6H5 N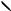 O
O
O или C6H5 N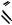 O
O
Водородная связь – связь, образованная за счѐт электростатическо-го притяжения между активными атомами водорода в молекуле и атомами с неподелѐнной парой электронов в этой же или в другой молекуле.
Активными называют атомы водорода, связанные в молекуле сильно полярной ковалентной связью (такие, с которых стянута электронная плотность). Графически водородную связь обозначают тремя точками. Различают
внутримолекулярные и межмолекулярные водородные связи.
Внутримолекулярные водородные связи:
|
|
|
|
|
F . .. H |
|
|
активный |
|
|
|
|
|
|
|
|
H |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
атом водорода |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C O |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|||
Межмолекулярные водородные связи: |
|
O H |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||
R |
|
C |
O .. . H |
|
O |
|
C |
|
R |
H |
|
O . .. H |
|
O .. . H |
|
O |
||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
O |
|
|
H . .. O |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
|
R |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Водородные связи гораздо менее прочные, чем ковалентные, так как энергия их образования на порядок ниже энергии образования ковалентных связей. Тем не менее наличие водородных связей оказывает существенное влияние на физические и химические свойства веществ: изменяются их температуры плавления и кипения, растворимость, вязкость, спектральные характеристики, а в случае внутримолекулярных водородных связей – и реакционная способность. Водородные связи определяют пространственную
8

структуру белков, полисахаридов, участвуют в образовании двойной спирали ДНК и т. д.
1.3.2. ОБРАЗОВАНИЕ ХИМИЧЕСКИХ СВЯЗЕЙ В СОЕДИНЕНИЯХ УГЛЕРОДА. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Существование большого числа органических соединений в значительной степени обусловлено способностью атома углерода образовывать четыре ковалентные связи в том числе гомоядерные, что приводит к возникновению углеродных цепей.
Чтобы иметь возможность принять участие в образовании четырѐх общих электронных пар, атом углерода должен располагать четырьмя неспаренными электронами. Однако в основном состоянии он имеет лишь два неспаренных электрона С (2s22pх12pу1). При сообщении ему энергии возбуждения один 2sэлектрон перемещается на 2p-подуровень. Таким образом в возбуждѐнном состоянии атом углерода имеет уже четыре неспаренных электрона С* (2s12pх12pу12pz1) и способен образовывать четыре связи.
Основное состояние |
Возбуждённое состояние |
атома углерода: |
атома углерода: |
2px 2py 2pz |
2px 2py 2pz |
2s |
2s |
C |
C* |
Неспаренные электроны в возбуждѐнном состоянии атома углерода находятся на четырѐх неравноценных орбиталях (одна – s, а три – p), поэтому уместным было бы предположить, что и ковалентные связи, образованные с их участием (например, в молекуле метана СН4), не должны быть эквивалентными. В действительности же, в молекуле метана все четыре ковалентные связи С–Н равноценны. Для объяснения этого факта в квантовомеханической теории химической связи введено математически обоснованное понятие гибридизации атомных орбиталей.
Орбиталь – это область пространства вокруг ядра, в которой вероятность нахождения электрона максимальна. Атомная орбиталь с симметрией шара называется s-орбиталью. Существует три одинаковых по энергии атомных орбитали с симметрией объѐмной восьмѐрки, отличающиеся друг от друга ориентацией в пространстве: рх, ру, рz. Каждая р-орбиталь имеет узловую область, в которой вероятность нахождения электрона равна нулю. Существует также пять d- и семь f-орбиталей более сложной формы.
Сущность гибридизации заключается в том, что из нескольких различных по форме и близких по энергии атомных орбиталей образуется такое же число одинаковых по форме и энергии гибридных орбиталей. Например, одна s- и три р-атомных орбитали гибридизуются с образованием четырѐх sp3-гибридных орбиталей. По форме гибридная орбиталь отличается как от s-, так и от р- орбиталей, представляя собой несимметричную объѐмную восьмѐрку. По сравнению с негибридизованными гибридные орбитали геометрически более
9
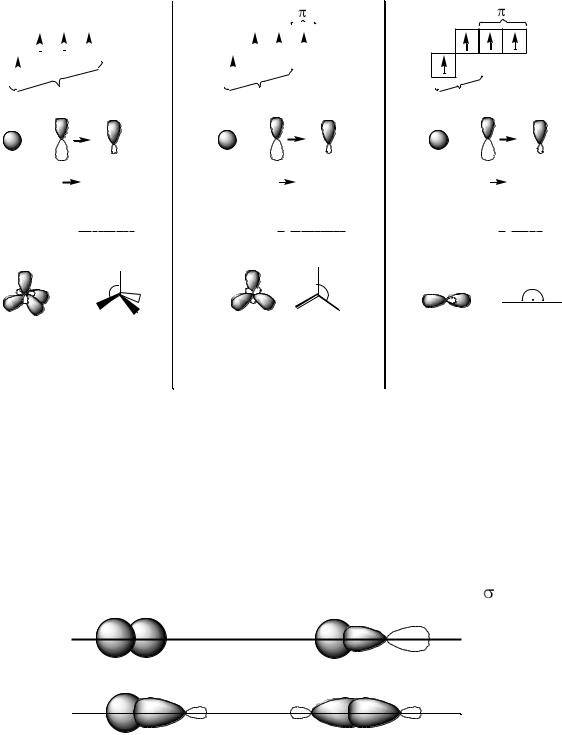
выгодны для образования связей, так как эффективнее перекрываются с орбиталями других атомов и, следовательно, образуют более прочные связи.
В атоме углерода, находящемся в возбуждѐнном состоянии, 2s и 2pорбитали гибридизуются (смешиваются и выравниваются по форме и энергии) тремя различными способами:
1) |
|
|
2) |
3) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sp3 |
|
sp2 |
|
|
sp |
|
|
1 |
+ 3 |
4 |
1 |
+ 2 |
3 |
1 |
+ 1 |
2 |
1s + 3p |
4sp3 |
1s + 2p |
3sp2 |
1s + 1p |
2sp |
|||
Гибридные орбитали |
Гибридные орбитали |
Гибридные орбитали |
||||||
расположены в пространстве |
расположены на плоскости |
расположены на линии |
||||||
|
под углом 109о28': |
|
под углом 120о: |
|
под углом 180о: |
|||
|
|
о |
|
|
о |
|
|
180о |
|
|
109 28' |
|
|
120 |
|
|
|
Первое валентное состояние |
Второе валентное состояние |
Третье валентное состояние |
||||||
|
атома углерода |
|
атома углерода |
|
атома углерода |
|||
реализуется при образовании |
реализуется при образовании |
реализуется при образовании |
||||||
|
одинарных связей. |
|
двойных связей. |
|
тройных связей. |
|||
|
|
|
|
|
||||
1.3.3.КОВАЛЕНТНЫЕ σ- И π-СВЯЗИ
Взависимости от способа перекрывания атомных орбиталей различают: σ-связи и π-связи.
σ-Связи – это связи, которые образуются за счѐт перекрывания гибридных (sp3, sp2, sp) и негибридизованных атомных орбиталей (s, p, d) вдоль линии, соединяющей центры взаимодействующих атомов.
Схема перекрывания атомных орбиталей при образовании -связи:
s - s |
s - p |
s - sp3 |
sp3- sp3 |
σ-Связь обладает большой прочностью, так как максимальная электронная плотность при σ-перекрывании сосредоточена в пространстве между ядрами атомов.
10

π-Связи – это связи, которые образуются за счѐт бокового перекрывания негибридизованных атомных орбиталей (p, d) над и под линией, соединяющей центры взаимодействующих атомов.
Схема перекрывания атомных орбиталей при образовании -связи:
-перекрывание
p - p
π-Связь является менее прочной, чем σ-связь, так как максимальная электронная плотность при π-перекрывании сосредоточена в двух областях – выше и ниже оси, соединяющей ядра атомов.
1.3.4. СПОСОБЫ РАЗРЫВА КОВАЛЕНТНЫХ СВЯЗЕЙ
Существует два способа разрыва ковалентных связей: гомолитический (радикальный) и гетеролитический (ионный).
Гомолитический разрыв (гомолиз) происходит так, что общая электронная пара разъединяется «симметрично», то есть каждая из образующихся при разрыве связи частиц несѐт один неспаренный электрон. Такие частицы называются радикалами:
A . . B
. B  A. + B.
A. + B.
Гомолитические (радикальные) реакции характерны для молекул с неполярными или малополярными ковалентными связями. Им способствуют высокая температура, ультрафиолетовый свет или свободные радикалы.
Гетеролитический разрыв (гетеролиз) происходит так, что общая электронная пара разъединяется «несимметрично», то есть одна из образующихся при разрыве связи частиц несѐт пару электронов, а другая, лишившись электрона, несѐт положительный заряд. Такие частицы называются
ионами: |
|
A .. B |
A + B+ |
Гетеролитические (ионные) реакции характерны для молекул с сильно полярными и легко поляризуемыми связями. Им способствуют полярные растворители, катализаторы, высокая температура.
Ионные реакции могут быть электрофильными (символ «Е») и нуклеофильными (символ «N») в зависимости от электронной природы
11
атакующего реагента. В электрофильных реакциях атакующим реагентом является электрофил (Е+), в нуклеофильных – нуклеофил (N– ).
Электрофильными (любящими электроны) называют реагенты, принимающие пару электронов при образовании химической связи.
К электрофильным реагентам относятся катионы (Н+, Меn+, NO2+, NO+ и др.), а также нейтральные молекулы, имеющие вакантную орбиталь или центры с пониженной электронной плотностью (SO3, AlCl3, R–Hal, R–COOH и др.)
Нуклеофильными (любящими ядро) называют реагенты, отдающие пару электронов при образовании химической связи.
К нуклеофильным реагентам относятся анионы (ОН–, СN–, Cl– и др.), а также нейтральные молекулы, имеющие неподелѐнные пары электронов или центры с повышенной электронной плотностью (NH3, H2O, R–OH, соединения с кратными связями и др.)
1.4.КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
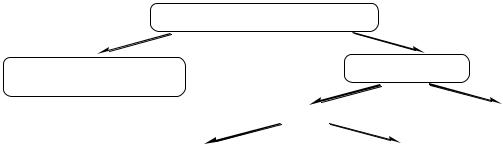
Взависимости от строения углеродной цепи органические соединения разделяют на соединения с открытой (незамкнутой) цепью и циклические. Последние в свою очередь делят на карбоциклические соединения (циклы состоят только из атомов углерода) и гетероциклические (в циклы, помимо углерода, входят и другие атомы). Карбоциклические соединения включают два ряда: алициклический и ароматический.
Органические соединения
Ациклические |
Циклические |
|
(алифатический, жирный ряд) |
|
|
Карбоциклические |
Гетероциклические |
|
Алициклические |
Ароматические |
|
Ациклические, алициклические и гетероциклические соединения могут быть насыщенными и ненасыщенными.
В пределах каждого из названных рядов органические вещества распределяются по классам. Соединения, молекулы которых состоят только из углерода и водорода, образуют класс углеводородов. При замещении в углеводородах одного или нескольких атомов водорода функциональными группами образуются другие классы органических соединений.
Функциональная группа – это структурный фрагмент молекулы, определяющий еѐ химические свойства.
По природе функциональной группы различают разнообразные классы органических соединений, основные из которых приведены в таблице 1.1.
12
