
03.Галогенопр
.pdf
Глава 3. ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
=============================================================
Галогенопроизводными углеводородов называют продукты замещения
вуглеводородах одного или нескольких атомов водорода атомами галогенов.
Взависимости от природы углеводородного радикала галогенпроизводные подразделяют на алифатические, алициклические и
ароматические. |
Среди алифатических |
галогенопроизводных |
различают |
||
насыщенные |
(галогеналканы) |
и |
ненасыщенные |
(галогеналкены, |
|
галогеналкины). Ароматические галогенопроизводные делят на соединения, в которых атом галогена непосредственно связан с ароматическим ядром (галогенарены) и вещества, содержащие атом галогена в боковой цепи (арилалкилгалогениды). В соответствии с природой атома галогена галогенопроизводные подразделяют на фтор-, хлор-, бром-, и иодпроизводные. По числу атомов галогена в молекуле различают моно-, ди-, три- и полигалогенопроизводные углеводородов.
3.1. НОМЕНКЛАТУРА
По заместительной номенклатуре ИЮПАК названия галогенопроизводных углеводородов составляют, прибавляя к названию атомов галогенов название родоначальной структуры. За родоначальную структуру в алифатических галогенопроизводных принимается главная углеродная цепь, в алициклических и ароматических - цикл:
|
|
|
|
|
|
|
|
Cl |
|
Br |
|||||
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
4 |
3 |
2 |
|
1 |
|
|
|
|
|
|
|
|
|||
CH3 |
|
CH2 |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
2-бромбутан |
|
хлорциклогексан |
бромбензол |
||||||||||
Если при родоначальной структуре имеется несколько заместителей (атомы галогенов, углеводородные радикалы и др.), то в названии перечисляют их в алфавитном порядке. Атомы углерода родоначальной структуры нумеруют в этом случае таким образом, чтобы заместитель, который обозначен в названии первым, получил возможно меньший номер, например:
1 |
2 |
|
3 |
4 |
|
5 |
|
|
|
|
|
5 |
|
|
4 |
|
3 |
2 |
|
1 |
||||||||||
CH3 |
|
|
CH |
|
CH2 |
|
|
CH |
|
CH3 |
|
|
|
CH3 |
|
|
CH |
|
CH2 |
|
|
CH |
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
Br |
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
CH3 |
|
||||||
|
2-бром-4-метилпентан |
|
|
|
|
|
|
|
|
|
|
|
|
2-метил-4-хлорпентан |
|
|||||||||||||||
|
|
|
|
|
|
1 |
|
2 |
|
|
3 |
4 |
|
|
5 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
CH |
|
CH2 |
|
CH3 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
3-бром-2-метилпентан
74

В галогеналкенах и галогеналкинах нумерацию атомов углерода главной цепи проводят так, чтобы возможно меньшие номера получили атомы углерода при кратной связи:
5 |
4 |
3 |
|
|
2 |
|
1 |
3 |
2 |
1 |
||||||||
|
CH2 |
|
CH2 |
|
CH |
|
CH |
|
|
CH2 |
CH2 |
|
C |
|
CH |
|||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
СН3 |
|
|
|
|
Cl |
|
|
|
|
|||||
|
|
|
5-бром-3-метилпентен-1 |
|
|
|
3-хлорпропин |
|||||||||||
В названиях галогенопроизводных, у которых все имеющиеся в молекуле атомы водорода замещены на галоген, используют префикс пер- :
CF3 |
|
CF3 |
CF2 |
|
|
CF2 |
|
|
|||||
|
|
|
||||
перфторэтан |
перфторэтилен |
|||||
Для некоторых галогенопроизводных используют тривиальные названия:
|
|
|
|
|
|
|
Cl |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3Cl |
CHCl3 |
CHBr3 |
CHI3 |
CH2 |
|
|
C |
|
CH |
|
CH2 |
|
|
|
|
|
|||||||||
хлористый метил |
хлороформ |
бромоформ |
иодоформ |
|
|
хлоропрен |
||||||
3.2. ИЗОМЕРИЯ
Для галогенопроизводных углеводородов характерна структурная, геометрическая и оптическая изомерия.
Структурная изомерия обусловлена разной структурой углеродного скелета молекулы и разным положением атомов галогенов в цепи. Так, хлорбутан С4Н9Cl существует в виде четырех структурных изомеров:
CH3 |
|
CH2 |
|
CH2 |
|
CH2 |
CH3 |
|
CH2 |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|||||||||
|
|
1-хлорбутан |
|
Cl |
2-хлорбутан Cl |
|||||||||
|
|
|
CH3 |
Cl |
|
|
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH |
|
CH2 |
CH3 |
|
C |
|
CH3 |
|||
|
|
|
|
|||||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
Cl |
|||
2-метил-1-хлорпропан |
2-метил-2-хлорпропан |
|||||||||||
Дигалогенопроизводные могут отличаться взаимным расположением атомов галогенов, например:
|
CH2 |
|
|
CH |
|
CH3 |
CH2 |
|
CH2 |
|
CH2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|||||
Cl |
|
Cl |
Cl |
|
Cl |
||||||
|
1,2-дихлорпропан |
1,3-дихлорпропан |
|||||||||
75

|
|
|
Cl |
|
|
|
|
|
Cl |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
3 |
|
C |
|
CH |
3 |
CH3 |
|
CH2 |
|
CH |
||
|
|
|
|
||||||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
Cl |
|||
|
|
|
Cl |
|
|
|
|
|
|||||
2,2-дихлорпропан |
|
1,1-дихлорпропан |
|||||||||||
Дигалогенопроизводные с атомами галогенов у одного и того же атома углерода называют геминальными (сокр. гем), у соседних атомов углерода -
вицинальными (сокр. виц).
Для галогеналкенов, имеющих разные заместители при атомах углерода, образующих двойную связь, наряду со структурной изомерией возможна геометрическая изомерия, например:
H |
|
H |
H |
|
Cl |
C |
|
C |
C |
|
C |
|
|
||||
|
|
||||
H3C |
|
Cl |
H3C |
|
H |
цис-1-хлоропрен |
транс-1-хлоропрен |
||||
Для галогеналканов, содержащих в своей структуре асимметрический атом углерода, характерна оптическая изомерия. Так, 2-хлорбутан существует в виде двух зеркальных изомеров (энантиомеров):
|
CH3 |
|
CH3 |
|||
H |
|
|
Cl |
Cl |
|
H |
|
|
|
||||
|
|
|
|
|
C2H5 |
|
|
C2H5 |
|
||||
D-2-хлорбутан |
L-2-хлорбутан |
|||||
3.3. ГАЛОГЕНАЛКАНЫ
Галогеналканы  это производные алканов, в которых один или несколько атомов водорода замещены атомами галогенов.
это производные алканов, в которых один или несколько атомов водорода замещены атомами галогенов.
3.3.1. СПОСОБЫ ПОЛУЧЕНИЯ ГАЛОГЕНАЛКАНОВ
Галогенирование алканов. Реакции протекают при УФ - облучении по свободнорадикальному механизму (см. раздел «Алканы»). Метод позволяет получить хлор- и бромалканы. Недостатком его является образование смеси моно-, ди- и полигалогеналканов:
76

CH4 |
Cl2 |
; h |
Cl2 |
; h |
|
||
|
|
CH3Cl |
|
|
CH2Cl2 |
и т. д. |
|
|
- HCl |
- HCl |
|||||
|
|
||||||
|
|
|
хлорметан |
|
|
дихлорметан |
|
Гидрогалогенирование алкенов (см. раздел «Алкены»).
|
|
|
|
|
|
|
|
|
Br |
|||
|
|
CH |
|
|
CH2 + HBr |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
CH |
|
CH3 |
|||
|
|
|
|
|
|
|||||||
|
|
пропен |
|
2-бромпропан |
||||||||
Этим методом можно получить моногалогенопроизводные алканов (фтор-, хлор-, бром- и иодалканы).
Гидрогалогенирование алкинов (см. раздел «Алкины»).
R |
|
C |
|
CH + HCl |
|
R |
|
C |
|
|
CH2 |
|
|
|
|||||||||
|
|
|
|
|
|
.Cl (A)
.
На I стадии реакции образуется галогеналкен (А). В его молекуле неподеленные пары электронов атома хлора находятся в сопряжении с - облаком двойной связи. По эффекту сопряжения хлор  донор электронной плотности, по индуктивному акцептор. По этой причине отсутствует четкая поляризация двойной связи в молекуле галогеналкена (А) и дальнейшее гидрогалогенирование идет в двух направлениях с образованием геминальных и вицинальных дигалогеналканов:
донор электронной плотности, по индуктивному акцептор. По этой причине отсутствует четкая поляризация двойной связи в молекуле галогеналкена (А) и дальнейшее гидрогалогенирование идет в двух направлениях с образованием геминальных и вицинальных дигалогеналканов:
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 R |
|
C |
|
CH2 + 2 HCl |
|
R |
|
C |
|
CH3 + R |
|
|
|
CH |
|
|
CH2 |
||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Cl |
|
|
|
Cl |
|
|
|
Cl |
|
Cl |
|||||||
Из спиртов. Для получения галогеналканов из спиртов в качестве галогенирующих реагентов используют галогеноводороды (НCl, HBr, HI), галогениды фосфора (PCl3, PCl5, PBr3, PBr5), хлористый тионил SOCl2 и хлористый сульфурил SO2Cl2 .
C2H5OH + HBr |
|
|
|
C2H5Br + H2O |
|
|
|||
|
|
|
||
этанол |
|
|
|
бромэтан |
Обычно галогеноводороды выделяют непосредственно в процессе реакции солей галогеноводородных кислот с концентрированной H2SO4:
C2H5OH + KBr + H2SO4 |
|
|
|
C2H5Br + KHSO 4 + H2O |
|
|
|||
|
|
|
77

C более высокими выходами галогеналканы образуются при взаимодействии спиртов с галогенидами фосфора (III) или фосфора (V), а также с тионилхлоридом SOCl2 и сульфурилхлоридом SO2Cl2:
C2H5OH + PCl5  C2H5Cl + HCl + POCl3
C2H5Cl + HCl + POCl3
3 C2H5OH + PCl3  3 C2H5Cl + H3PO3
3 C2H5Cl + H3PO3
C2H5OH |
+ SOCl2 |
|
|
|
C2H5Cl + HCl |
|
|
|
+ SO2 |
|
|
|
|||||||
|
|
|
|||||||
C2H5OH |
+ SO2Cl2 |
|
|
|
C2H5Cl + HCl |
|
|
|
+ SO3 |
|
|
|
|
|
|||||
|
|
|
|
|
|
Легче всего замещается галогеном гидроксил у третичного атома углерода.
Взаимодействие галогеналканов с солями галогеноводородных кислот
(реакция Финкельштейна ). При действии на хлорили бромалканы йодида натрия в среде ацетона происходит замещение атома хлора или брома на йод:
C2H5Br + NaI |
ацетон |
C2H5I + |
NaBr |
|
|
|
|||
|
|
|||
Реакцию используют для получения иодалканов из более доступных хлорили бромпроизводных.
Взаимодействие альдегидов и кетонов с пентагалогенидами фосфора
(PCl5, PBr5). В процессе реакции образуются геминальные дигалогеналканы:
|
|
|
|
|
|
|
|
O |
|
PCl5 |
t |
|
|
|
|
|
|
|
+ POCl3 |
|||
CH |
|
|
|
|
C |
H |
+ |
|
|
CH |
CHCl |
|
||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
2 |
|
||||
уксусный альдегид |
|
|
|
|
1,1-дихлорэтан |
|
||||||||||||||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
Br |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
CH3 + POBr3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CH3 |
|
|
|
C |
|
CH3 + |
PBr5 |
|
|
CH3 |
|
|
C |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
||||
|
|
ацетон |
|
|
|
|
|
2,2-дибромпропан |
||||||||||||||
Присоединение галогенов к алкенам (см. раздел «Алкены»). В
результате реакции образуются вицинальные дигалогеналканы:
CH3 |
|
CH |
|
CH2 + Br2 |
|
CH3 |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
Br |
|
Br |
||
|
|
|
|
|
|
1,2-дибромпропан |
||||||
Фторпроизводные алканов получают специальными методами.
1. Обменные реакции хлор-, бромили иодалканов со фторидами Hg, Ag, Co, Sb.
78
R |
|
|
Br + AgF |
|
|
|
|
R |
|
F |
+ AgBr |
|
|
|
|
|
|
|
|
||||||
R |
|
CHCl 2 + SbF3 |
|
|
R |
|
CHF2 |
+ SbFCl2 |
||||
|
|
|
|
|||||||||
2. Реакции кислородсодержащих органических соединений с четырехфтористой серой. Четырѐхфтористая сера является уникальным селективным фторирующим агентом для замены гидроксильной группы в кислых спиртах атомом фтора, а также карбонильного кислорода в альдегидах и кетонах двумя атомами фтора:
R |
|
|
OH |
+ |
SF4 |
|
|
|
R |
|
|
|
F + SOF2 + HF |
||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
R |
|
|
C |
H + |
SF4 |
|
|
|
R |
|
|
CHF2 |
SOF2 |
||||||||||
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
R |
|
|
C |
|
|
R' |
+ SF4 |
|
|
R |
|
|
CF2 |
|
R' |
+ SOF2 |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
Карбоксильная группа под действием четырѐхфтористой серы легко превращается во фторангидридную, а в более жѐстких условиях в среде безводного фтористого водорода – в трифторметильную группу.
O
R C OH + SF4
OH + SF4
|
|
|
O |
R |
|
C |
F |
|
|||
|
|
|
SF4
HF
+ SOF2 + HF
R CF3 + SOF2
3.3.2. ХИМИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНАЛКАНОВ
Галогеналканы – очень реакционноспособные вещества. Для них характерны реакции восстановления, взаимодействие с металлами, реакции отщепления и нуклеофильного замещения.
Восстановление галогеналканов. При восстановлении галогеналканов образуются алканы. В качестве восстановителей используют водород в присутствии катализаторов гидрирования или иодоводородную кислоту:
|
кат. |
+ HCl |
|
C2H5Cl + H2 |
|
C2H6 |
|
|
|||
t
C2H5Cl + 2 HI  C2H6 + HCl + I2
C2H6 + HCl + I2
Взаимодействие галогеналканов с металлами:
а) с металлическим натрием – реакция Вюрца (см. раздел «Алканы»):
2 R |
|
Br + 2 Na |
|
R |
|
R + 2 Na Br |
|
|
|
79
б) с металлическим магнием в среде безводного диэтилового эфира. При этом образуются магнийорганические соединения, известные под названием реактивов Гриньяра:
эфир безводн.
C2H5Br + Mg  C2H5MgBr
C2H5MgBr
этилмагнийбромид
Реактивы Гриньяра – весьма реакционноспособные вещества. Их активность обусловлена полярностью связи углерод – магний. Поскольку атом углерода имеет большую электроотрицательность, чем магний, связь C Mg поляризована таким образом, что на атоме углерода появляется частичный отрицательный заряд. Вследствие этого магнийорганические соединения являются сильными нуклеофильными реагентами и сильными основаниями:
CH3 CH2 MgBr
MgBr
Взаимодействие галогеналканов с алкоголятами и фенолятами (ре-
акция Вильямсона). Эти реакции протекают с образованием простых эфиров.
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
C2H5Br |
+ NaOC2H5 |
|
|
|
|
C2H5 |
|
|
|
|
C2H5 |
+ NaBr |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
этилат натрия |
|
|
|
диэтиловый эфир |
|
|||||||||||||||||||||||||
C |
H |
Br |
+ |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
+ NaBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
NaO |
|
|
|
|
|
C H |
5 |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
фенолят натрия |
|
|
|
фенилэтиловый эфир |
|
|||||||||||||||||||||||||
Реакция открыта в 1851 г., английским химиком А. У. Вильямсоном и до сих пор используется в качестве одного из лучших методов получения простых эфиров.
Взаимодействие галогеналканов с солями карбоновых кислот. Этим методом получают сложные эфиры:
|
+ CH3 |
|
|
O |
|
|
|
|
|
O |
+ NaBr |
||
C2H5Br |
|
C |
O Na |
|
CH3 |
|
|
C |
O |
|
C2H5 |
||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
ацетат натрия |
|
|
этилацетат |
|
||||||||
Взаимодействие галогеналканов с аммиаком, алкил- и ариламинами.
При взаимодействии галогеналканов с избытком аммиака образуется смесь первичных, вторичных и третичных аминов, а также соли четвертичных аммониевых оснований:
80

|
|
|
.. |
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
NH3 |
.. |
+ NH4Cl |
|||||||||||||||||||||
R |
|
|
|
Cl + NH3 |
|
|
|
|
R |
|
NH2 |
+ HCl |
|
|
|
|
|
|
R |
|
NH3 |
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
R |
|
NH2 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлорид алкиламмония |
|
первичные |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
амины |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
.. |
|
|
|
|
|
|
R .. |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
+ |
|
|
|
|
NH3 |
|
R .. |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
Cl |
|
|||||||||||||||||||||||||||||||||||||
|
|
|
Cl + R |
|
NH2 |
|
|
|
|
|
|
NH + HCl |
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
NH |
+ NH4Cl |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлорид диалкиламмония |
|
вторичные |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
амины |
|
||||
|
|
|
|
R .. |
|
|
|
|
R .. |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
NH3 |
|
R .. |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
R |
|
|
Cl + NH |
|
|
|
|
|
R |
|
N + HCl |
|
|
|
|
|
R |
|
|
NH |
|
Cl |
|
|
|
|
|
|
|
|
R |
|
|
N + NH4Cl |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
R |
|
|
|
|
R |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|||||||||||||
хлорид триалкиламмония |
третичные |
|
амины |
||
|
Взаимодействие галогеналканов с солями циановодородной кислоты.
Первичные и вторичные галогеналканы с солями щелочных металлов циановодородной кислоты (KCN, NaCN) с хорошими выходами образуют нитрилы карбоновых кислот:
C2H5Br + NaCN |
|
C2H5 |
|
C |
|
N + NaBr |
|
|
|||||
|
|
|
||||
|
|
|||||
|
|
нитрил пропановой кислоты |
||||
|
|
(пропанонитрил) |
||||
Взаимодействие галогеналканов с солями азотистой кислоты.
Первичные и вторичные галогеналканы с нитритом натрия образуют преимущественно нитроалканы:
C2H5Br + NaNO2 |
|
C2H5 |
|
NO2 + NaBr |
|
|
|||
|
|
нитроэтан |
||
Гидролиз галогеналканов. Реакцию гидролиза проводят при нагревании галогеналканов с водными растворами щелочей.
R |
|
Br + NaOH |
|
H2O |
|||
|
|
|
R |
|
OH + NaBr |
||
|
|
|
|
||||
Гидролиз галогеналканов |
реакция нуклеофильного (N) замещения (S), |
||||||
так как атакующей частицей в ней является нуклеофил анион гидроксила. Механизм замещения атомов галогена в галогеналканах существенно
зависит от строения радикалов, с которыми связан атом галогена.
Г и д р о л и з п е р в и ч н ы х г а л о г е н а л к а н о в
CH3Cl + NaOH |
H2O |
CH3OH + NaCl |
Экспериментально установлено, что скорость этой реакции зависит как от концентрации галогеналкана, так и от концентрации гидроксильных ионов, то есть описывается кинетическим уравнением второго порядка:
81

V = k [CH3Cl] . [OH - ]
Это значит, что в лимитирующей (самой медленной) стадии такой реакции участвуют и галогеналкан, и анион гидроксила, т. е. она бимолекулярная. Соответственно гидролиз первичных галогеналканов представляет собой реакцию бимолекулярного нуклеофильного замещения SN2. В этой реакции нуклеофил ОНˉ атакует электрофильный центр молекулы галогеналкана (атом углерода, связанный с галогеном) со стороны, противоположной связи С Hal (атака с тыла). При этом образуется неустойчивое переходное состояние (1) , в котором разрыв связи С Hal и образование связи С ОН происходит одновременно:
|
|
|
|
H |
|
|
|
|
|
H H |
|
|
|
|
|
|
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
OH |
+ H |
C |
|
Cl |
|
|
|
|
|
HO C Cl |
|
|
|
|
|
HO |
|
C + Cl |
|||||||
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
(1)
Если электрофильный центр в молекуле первичного галогеналкана является асимметрическим атомом углерода, то нуклеофильное замещение атома галогена сопровождается обращением конфигурации. Этот факт является подтверждением того, что гидролиз первичных галогеналканов протекает в одну стадию по механизму SN2 с образованием переходного состояния (1).
Г и д р о л и з т р е т и ч н ы х г а л о г е н а л к а н о в
|
|
|
CH3 |
H2O |
CH3 |
NaCl |
|||||||
|
|
|
|
OH + |
|||||||||
|
|
|
|
|
|
|
|
||||||
CH3 |
|
C |
|
Cl + NaOH |
|
CH3 |
|
C |
|
||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
|
CH3 |
|
||||||
Экспериментально установлено, что скорость этой реакции зависит только от концентрации галогеналкана, то есть описывается кинетическим уравнением первого порядка:
V = k . |
|
|
|
|
|
|
CH3 |
||||
|
|
|
|
|
|||||||
CH |
3 |
|
C |
|
|
|
Cl |
||||
|
|
|
|||||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
CH3 |
||||||
Это означает, что в лимитирующей стадии такой реакции принимают участие только молекулы галогеналкана, т. е. она мономолекулярная. Соответственно гидролиз третичных галогеналканов представляет собой реакцию мономолекулярного нуклеофильного замещения SN1, протекающую в две стадии:
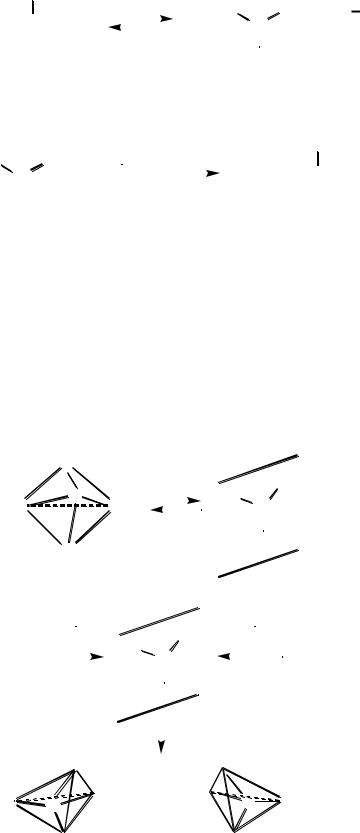
1. Диссоциация галогеналкана. Протекает медленно, поэтому является лимитирующей и определяет скорость всего процесса гидролиза.
82
|
|
|
CH3 |
|
медленно |
|
H3C |
|
|
CH3 + |
|
|
|||||||||||||
CH3 C |
|
Cl |
|
|
C |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
Cl |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||||||||||
2. Взаимодействие |
образовавшегося |
карбкатиона |
|
с нуклеофилом |
|||||||||||||||||||||
(быстро). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H3C C |
CH3 |
|
|
|
|
|
|
|
быстро |
|
|
|
|
|
CH3 |
|
|
||||||||
+ OH |
CH3 C OH |
||||||||||||||||||||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|||||||
Оптически активный третичный галогеналкан, в котором атом галогена связан с асимметрическим атомом углерода, после гидролиза теряет оптическую активность, т. к. превращается в рацемическую смесь спиртов (50% право- и 50% левовращающих изомеров). Это связано с тем, что образующийся в лимитирующей стадии реакции карбкатион имеет плоскостную конфигурацию (катионный центр находится в Sp2-гибридизации) и может быть атакован нуклеофильным реагентом с равной вероятностью с обеих сторон плоскости. А это приводит к образованию равных количеств двух стереоизомеров, т. е. к рацемизации:
1. |
R |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
C |
Cl |
|
|
|
|
R' |
+ |
R |
|
|
|
|||
|
|
|
|
|
|
|
|
||||||||
R' |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
+ Cl |
||||||||||
|
|
|
C |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R'' |
|
|
|
|
|
|
R'' |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
+ R |
|
|
|
|
|
|
OH |
|
R' |
|
|
OH |
|||||||
|
|
|
||||||||||
|
|
|
|
|
C |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R'' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
|
HO |
C |
R' |
+ |
R' |
C OH |
|
|
||||
|
R'' |
|
|
|
R'' |
Образование таких продуктов служит подтверждением того, что гидролиз третичных галогеналканов протекает в две стадии по механизму SN1.
83
