
06.Карб.кисл
.pdf
Глава 6. КАРБОНОВЫЕ КИСЛОТЫ
============================================================
Карбоновые кислоты – это производные углеводородов, содержащие карбоксильную группу – CОOН.
В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты подразделяют на алифатические, алициклические и ароматические. В соответствии с числом карбоксильных групп в молекуле различают монокарбоновые (содержащие одну группу
–CОOН), дикарбоновые (две), трикарбоновые (три) и поликарбоновые
(более трѐх групп – CОOН) кислоты.
============================================================
6.1.ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ
============================================================
Для оценки кислотности и основности органических соединений в современной органической химии используют, главным образом, две теории: протонную (протолитическую) теорию Бренстеда и электронную теорию Льюиса.
Согласно теории Бренстеда кислота – любое вещество, способное отдавать протон (донор Н+), а основание – любое вещество, способное
присоединять протон (акцептор Н+).
Кислотность и основность – относительные свойства вещества. Кислотный характер вещества может проявляться лишь в присутствии основания, основный – в присутствии кислоты. В целом кислотно-основный
процесс состоит в переносе протона от кислоты к основанию:
..
A H + B
кислота основание
Многие органические соединения могут одновременно обладать свойствами основания и кислоты. Они называются амфотерными.
Мерой силы кислоты А–Н является константа кислотности Ка, которая обычно определяется по отношению к стандартному основанию – воде:
A H + H2O 
 A + H3O+
A + H3O+
В разбавленном растворе Ка рассчитывается по формуле:
К |
|
А |
Н 3О |
а |
А |
Н |
|
|
|
Чем больше значение Ка, тем сильнее кислота. Однако значения Ка, как правило, очень малы [Ka(CH3COOH) = 1,79 10-5 при 25 оC], оперировать ими неудобно, поэтому пользуются величинами рКа, где рКа = – lgKa. Так, для СН3СООН рКа = 4,75. Чем меньше значение рКа, тем сильнее кислота.
Факторы, влияющие на силу кислот
1. Природа растворителя, в котором растворена кислота. Чем более полярный растворитель (вода, спирт, ацетон, диметилформамид,
143
диметилсульфоксид и т.д.), тем сильнее его способность сольватировать растворѐнные частицы, тем сильнее в нем проявляются кислые свойства вещества. В неполярных растворителях (бензол, гексан, пентан и т.д.) даже сильные кислоты не проявляют кислых свойств. Так, хлористый водород, растворѐнный в воде, – сильная кислота, в то время как хлористый водород, растворѐнный в безводном бензоле, – нейтральный. Уровень полярности растворителя определяется величиной его диэлектрической проницаемости (чем больше диэлектрическая проницаемость, тем больше полярность растворителя).
2.Прочность связи А–Н в молекуле кислоты. Чем труднее разрывается связь А – Н, тем меньше концентрация Н+, тем слабее кислота. И наоборот.
3.Электроотрицательность кислотного остатка. Чем сильнее смещена электронная плотность в молекуле кислоты к уходящему водороду, тем более затруднен его отрыв, тем слабее кислота и наоборот:
|
|
O |
|
|
O |
||||||||||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
O |
|
H |
CF3 |
|
C |
|
O |
|
H |
|||||
|
|
|
|
|
|
||||||||||||
отрыв протона затруднён |
отрыв протона облегчён |
||||||||||||||||
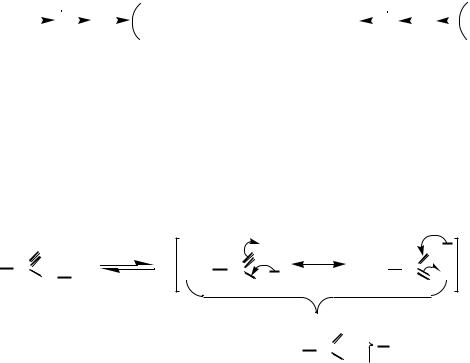
Трифторуксусная кислота сильнее уксусной, т. к. в уксусной кислоте отрыв протона затруднен донорным эффектом кислотного остатка, в трифторуксусной кислоте отрыв протона облегчен за счѐт стягивания электронной плотности с уходящего протона.
4. Более высокая стабильность образующегося аниона А– по сравнению с молекулой исходной кислоты А–Н. Чем устойчивее ион,
образующийся при отрыве от молекулы кислоты протона, тем легче оторвать протон, тем сильнее кислота.
|
O |
O |
O |
|
+ |
CH3 C |
.. |
CH3 C O |
CH3 C O |
+ H |
|
O H |
|
||||
|
.. |
|
|
|
|
CH3
..O 
...
C . O 
Бóльшая стабильность ацетат-иона в сравнении с молекулой уксусной кислоты является следствием эффективной делокализации отрицательного заряда по иону за счет эффекта сопряжения, что приводит к выигрышу энергии и облегчает отрыв протона. В свою очередь, если пытаться присоединить к такому аниону (с делокализованным отрицательным зарядом) положительный ион, надо затратить энергию на то, чтобы сконцентрировать отрицательный заряд на одном атоме кислорода.
Ниже приведены данные, позволяющие проследить зависимость силы кислоты от еѐ строения. Так, в ряду кислот: метановая – этановая – пропановая сила кислот уменьшается, поскольку возрастает электронодонорное влияние алкильных радикалов и электронная плотность смещается в сторону уходящего протона, затрудняя процесс его отрыва. В свою очередь в ряду:
144

пропановая – пропеновая – пропиновая сила кислот увеличивается, поскольку возрастает электроноакцепторное влияние ненасыщенных радикалов и электронная плотность стягивается с уходящего протона, облегчая процесс его отрыва:
|
КИСЛОТА |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рКа |
|
|
|
Метановая (муравьиная) |
H |
|
|
|
C |
|
|
|
|
|
O |
|
|
|
|
|
|
|
3,75 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Этановая (уксусная) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
4,76 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
CH3 |
|
C |
OH |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
Пропановая (пропионовая) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
4,87 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
CH3 |
|
|
CH2 |
|
|
C |
OH |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
Пропеновая (акриловая) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
4,25 |
|
|
|
CH2 |
|
|
|
|
|
|
|
CH |
|
|
C |
OH |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пропиновая (ацетиленкарбоновая) |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
O |
|
1,84 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
CH |
|
|
|
|
|
|
|
|
|
C |
|
|
OH |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
Сила моногалогенозамещѐнных уксусных кислот возрастает с ростом |
||||||||||||||||||||||||||||||
электроотрицательности галогена (от йода ко фтору): |
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Уксусная кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
4,76 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
CH3 |
|
|
C |
|
OH |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
Монойодуксусная кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
3,16 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|||||||
|
CH2I |
|
|
|
|
|
OH |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
Монобромуксусная кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
2,90 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
CH2Br C |
|
|
|
|
OH |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
Монохлоруксусная кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
2,85 |
|
|||
|
|
CH2Cl |
|
|
|
|
|
|
C |
|
|
OH |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
Монофторуксусная кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
2,57 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH2F |
|
|
|
|
C |
|
|
OH |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Интересные данные получены при сравнении силы акриловой (пропеновой), трихлоракриловой и трифторакриловой кислот. Оказалось, что наиболее сильной из них является трихлоракриловая:
Акриловая (пропеновая) кислота |
CH2 |
|
|
|
|
|
|
|
|
O |
4,25 |
||
|
|
CH |
|
|
|
C |
OH |
||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Трихлоракриловая кислота |
|
|
|
|
|
|
|
|
|
|
|
O |
1,21 |
CCl2 |
|
|
|
CCl |
|
|
|
C |
OH |
||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Трифторакриловая кислота |
|
|
|
|
|
|
|
|
|
|
|
O |
1,8 |
|
|
|
|
|
|
|
|
|
C |
|
|||
|
|
|
|
|
|
|
|
|
|
||||
|
CF2 |
|
|
|
CF |
|
OH |
|
|||||
|
145 |
|
|
|
|
|
|
|
|
|
|
|
|
Объясняется этот факт тем, что радикал трихлорвинил сильнее стягивает на себя электронную плотность, чем трифторвинил. Атомы хлора и атомы фтора обладают мощным отрицательным индуктивным эффектом и мощным положительным эффектом сопряжения. Однако радиус атома хлора больше, чем радиус атома фтора. Хлор в трихлоракриловой кислоте отстоит от двойной связи дальше, чем фтор в трифторакриловой, перекрывание р-орбиталей хлора с π-облаком двойной связи слабее, чем у фтора, поэтому суммарное действие индуктивного эффекта и эффекта сопряжения в трихлоракриловой кислоте в большей степени электроноакцепторное, чем в трифторакриловой, и протон отрывается легче:
Cl: |
Cl |
|
F: |
F |
|
C C |
|
O |
C C |
|
O |
Cl |
C |
O H |
F |
C |
O H |
|
|
|
|
суммарное действие на уходящий протон двух эффектов (-I и +М )
Дикарбоновые кислоты диссоциируют ступенчато, образуя анион (рКа1) и дианион (рКа2):
|
|
|
рКа1 |
|
|
|
|
|
рКа2 |
|
|
|
|
|
|
||||||||
HOOC |
|
COOH |
|
|
|
|
|
HOOC |
|
COO |
|
|
|
|
|
|
|
OOC |
|
COO |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
H+ |
|
|
|
|
|
H+ |
|
||||||||||||
|
|
|
|
|
|
анион |
|
|
|
|
|
|
дианион |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
По первой ступени диссоциации насыщенные дикарбоновые кислоты обладают более сильными кислотными свойствами, чем монокарбоновые кислоты с тем же числом атомов углерода. Это обусловлено взаимным влиянием карбоксильных групп (индуктивный эффект). Вторая карбоксильная группа, обладая электроноакцепторными свойствами, способствует делокализации заряда аниона и тем самым повышает его устойчивость. По мере удаления карбоксильных групп друг от друга их взаимное влияние ослабевает, вследствие чего кислотность по первой ступени снижается.
Отрыв протона от второй карбоксильной группы происходит значительно труднее из-за электронодонорного влияния группы – СОО–. Поэтому по второй ступени диссоциации кислотность дикарбоновых кислот значительно ниже, чем по первой:
Этановая (уксусная) |
|
|
|
|
CH3 |
|
|
C |
O |
|
|
|
|
рКа |
4,76 |
|||||||
кислота |
|
|
|
|
|
|
OH |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Этандиовая (щавелевая) |
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
рКа1 |
1,27 |
|||
кислота |
|
H |
|
O C |
|
|
C |
|
O |
|
H |
рКа2 |
4,27 |
|||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
Пропандиовая (малоновая) |
|
|
O |
|
C |
|
|
CH2 |
|
|
C |
O |
рКа1 |
2,86 |
||||||||
кислота |
H |
|
O |
|
|
|
|
|
O |
|
H |
рКа2 |
5,70 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
146 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
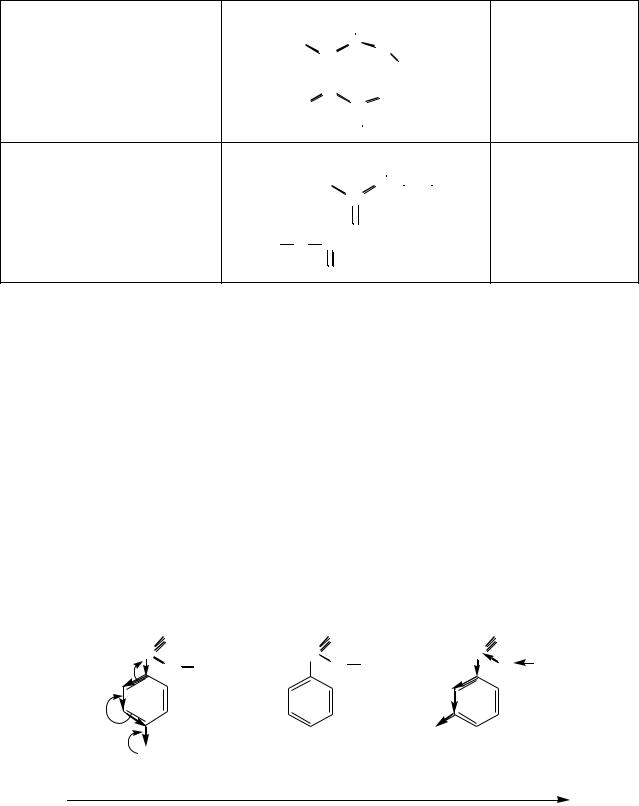
Ненасыщенные дикарбоновые кислоты проявляют более выраженные кислотные свойства по сравнению с насыщенными, поскольку взаимное влияние двух карбоксильных групп передаѐтся по сопряжѐнной системе π- связей сильнее. При этом малеиновая (цис-бутендиовая) кислота значительно сильнее фумаровой (транс-бутендиовой):
Малеиновая (цис-бутендиовая) кислота
Фумаровая (транс-бутендиовая) кислота
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
C |
C O |
|
|
|
|
||||||||
|
|
|
|
|
|
H |
||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
. |
|
|
|
|
||||
|
|
|
|
|
|
. |
|
|
|
|
|
|||
|
C |
|
|
. |
|
|
|
|
|
|||||
H |
C |
O |
|
|
H |
|||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
||||
|
|
|
|
|
|
|
|
O |
|
H |
||||
|
H |
C |
C |
|
|
|||||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H O C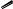 C
C H
H
O
рКа1 1,92 рКа2 6,23
рКа1 3,02 рКа2 4,32
Повышенная кислотность малеиновой кислоты по первой ступени и низкая кислотность по второй обусловлены наличием в еѐ молекуле внутримолекулярной водородной связи, которая, с одной стороны, повышает устойчивость аниона, а с другой – затрудняет отщепление протона от второй карбоксильной группы.
Сила ароматических карбоновых кислот в значительной степени зависит от характера и положения заместителей в бензольном кольце. Если заместитель находится в мета-положении по отношению к карбоксильной группе, то он действует на нее только за счѐт индуктивного эффекта. Эффект сопряжения отсутствует, т. к. цепь сопряжения между двумя заместителями разорвана. Если же заместитель находится в пара-положении по отношению к карбоксильной группе, то он действует на нее и за счѐт индуктивного, и за счѐт эффекта сопряжения. Так в ряду кислот: пара-фторбензойная – бензойная – мета-фторбензойная самой сильной является мета-фторбензойная кислота:
|
O |
O |
|
|
O |
C O H |
C O |
H |
C |
O H |
|
|
|
|
|
F |
|
:F |
|
|
|
|
|
рКа > |
4,2 |
рКа = 4,2 |
рКа < 4,2 |
||
сила кислот увеличивается
147
В мета-фторбензойной кислоте фтор стягивает электронную плотность по индуктивному эффекту, облегчая отрыв протона. В пара-фторбензойной кислоте фтор тоже стягивает электронную плотность по индуктивному эффекту, но сильнее возвращает еѐ по эффекту сопряжения, затрудняя отрыв протона.
Нитрогруппа обладает отрицательным индуктивным эффектом и отрицательным эффектом сопряжения. В мета-нитробензойной кислоте нитрогруппа стягивает электронную плотность по индуктивному эффекту, облегчая отрыв протона. В пара-нитробензойной кислоте нитрогруппа стягивает электронную плотность как по индуктивному эффекту, так и по эффекту сопряжения, ещѐ более облегчая отрыв протона. Таким образом, в сравнении с бензойной мета-нитробензойная кислота является более сильной, а пара-нитробензойная ещѐ более сильной кислотой:
O O O
C O H C
O H C O
O H C
H C O H
O H
 NO2
NO2
NO2
сила кислот увеличивается
В 1923г. американский ученый Дж. Н. Льюис предложил электронную теорию кислот и оснований, которая не только не противоречит теории Бренстеда, а является более общей.
Согласно теории Льюиса, кислота – это любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи, а основание – любая частица (атом, молекула, анион), способная отдавать пару электронов с образованием ковалентной связи.
Таким образом, основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг органических соединений. К кислотам (по Льюису) относят не только соединения, отщепляющие протон (протонные кислоты), но и другие соединения, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Например: BF3, AlCl3, FeCl3, SbCl3, ZnCl2, HgCl2 и др.
============================================================
6.2. НАСЫЩЕННЫЕ МОНОКАРБОНОВЫЕ КИСЛОТЫ
===========================================================
6.2.1. НОМЕНКЛАТУРА И ИЗОМЕРИЯ НАСЫЩЕННЫХ МОНОКАРБОНОВЫХ КИСЛОТ
Для карбоновых кислот очень широко используют тривиальные названия и названия, соответствующие заместительной номенклатуре ИЮПАК:
148

ФОРМУЛА КИСЛОТЫ |
ТРИВИАЛЬНАЯ |
ЗАМЕСТИТЕЛЬНАЯ |
||||||||||||
НОМЕНКЛАТУРА |
НОМЕНКЛАТУРА |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
O |
|
|
|
Муравьиная кислота |
Метановая кислота |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
H |
C |
OH |
|
|||||||||||
|
|
|
||||||||||||
|
|
|
|
|
|
O |
|
|
|
Уксусная кислота |
Этановая кислота |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH3 |
|
C |
OH |
|
||||||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
O |
|
Пропионовая кислота |
Пропановая кислота |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH3CH2 |
C |
OH |
|
|||||||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
Масляная кислота |
Бутановая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH3CH2CH2 C OH |
||||||||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
Валериановая кислота |
Пентановая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH3CH2CH2CH2 |
|
C |
OH |
|||||||||||
|
|
|
||||||||||||
По правилам заместительной номенклатуры ИЮПAK названия карбоновых кислот образуют от названия углеводородов с тем же числом атомов углерода (включая углерод карбоксильной группы), прибавляя –овая кислота. Нумерацию атомов углерода главной углеродной цепи начинают с атома углерода карбоксильной группы. Углеродный атом карбоксильной группы в карбоновых кислотах всегда получает номер один.
Остаток карбоновой кислоты, образующийся после отнятия водорода, от карбоксильной группы, называется ацилокси-группой, а остаток, образующийся после отнятия гидроксильной группы, называется ацильной группой:
|
|
O |
|
|
O |
||
R |
|
C O |
|
|
R |
|
C |
|
|
||||||
|
|
|
|
|
|
||
ацилоксигруппа |
ацильная группа |
||||||
Названия ацилокси-групп обычно образуют из тривиальных латинских названий кислот и суффикса -ат, или по заместительной номенклатуре от названия кислоты, заменяя -овая кислота на -оат. Названия ацильных групп образуют из тривиальных латинских названий кислот и суффикса -ил или по заместительной номенклатуре от названия кислоты, заменяя -овая кислота на -оил:
АЦИЛОКСИ-ГРУППА |
|
АЦИЛЬНАЯ ГРУППА |
|||||||||||||||||||||||
H |
|
C |
O |
|
|
|
|
|
O |
||||||||||||||||
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
C |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
формиат (метаноат) |
|
формил (метаноил) |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|||||||||||||
CH3 |
|
C O |
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|||||||||||||||||||||||
ацетат (этаноат) |
|
ацетил (этаноил) |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
||||||
CH3CH2 |
|
C O |
|
|
|
|
|
CH3CH2 |
|
C |
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
||||||||||||||||||||||
пропионат (пропаноат) |
|
пропионил (пропаноил) |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
||
CH3CH2CH2 |
|
C O |
|
|
|
CH3CH2CH2 |
C |
||||||||||||||||||
|
|
||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||
бутират (бутаноат) |
|
бутирил (бутаноил) |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
149 |
|
|
|
|
|
|
|
|

Для насыщенных карбоновых кислот характерна структурная изомерия, обусловленная различной структурой углеводородного радикала, связанного с карбоксильной группой. Первые три представителя гомологического ряда изомеров не имеют. Четвѐртый гомолог существует в виде двух структурных изомеров:
4 |
3 |
|
2 |
1 |
3 |
|
2 |
|
1 |
||
CH3 |
|
CH2 |
|
CH2 |
COOH |
CH3 |
|
|
CH |
|
COOH |
|
|
|
|
|
|||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
CH3 |
|
||
|
бутановая кислота |
2-метилпропановая кислота |
|||||||||
6.2.2. СПОСОБЫ ПОЛУЧЕНИЯ НАСЫЩЕННЫХ МОНОКАРБОНОВЫХ КИСЛОТ
Окисление первичных спиртов и альдегидов. Первичные спирты окисляются до карбоновых кислот через стадию образования альдегидов (см. раздел «Альдегиды и кетоны»):
CH3 |
|
CH2 |
|
OH |
[ O ] |
CH3 |
|
C |
O |
[ O ] |
CH3 |
|
C |
O |
|
|
|
|
H |
|
|
OH |
|||||||
|
|
- H2O |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
этанол |
|
|
этаналь |
|
|
этановая кислота |
||||||
Гидролиз геминальных тригалогеналканов. Реакция протекает в кислой или щелочной среде. В качестве промежуточного соединения образуется геминальный триол, который отщепляет молекулу воды и превращается в карбоновую кислоту:
Cl
CH3 CH2 C Cl
Cl
3 H2O |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH3 |
|
CH2 |
C |
|
OH |
|
|
CH3 |
|
CH2 |
C |
|||||
|
|
|
|
|
|
|
|
|
OH |
|||||||||
- 3 HCl |
|
|
- H2O |
|
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
OH |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1,1,1-трихлорпропан |
пропантриол-1,1,1 |
пропановая кислота |
Гидролиз нитрилов. При нагревании с водными растворами кислот и щелочей нитрилы подвергаются гидролизу с образованием карбоновых кислот:
|
|
|
|
|
|
|
|
|
HCl |
|
CH3 |
|
|
|
C |
O |
|
+ NH4Cl |
||||||
|
|
|
|
|
|
|
|
2H2O |
|
|
|
|
|
OH |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
C |
|
|
N |
|
|
|
|
этановая кислота |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
нитрил |
|
|
|
|
|
NaOH |
|
CH3 |
|
|
|
C |
|
+ NH4OH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|||||||||||
этановой кислоты |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
O Na |
||||||||||||||||||
(ацетонитрил) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
ацетат натрия |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
CH3 |
|
C |
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- NaCl |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
этановая кислота
Через магнийорганические соединения. При действии магнийорганических соединений (реактивов Гриньяра) на оксид углерода (IV) образуются смешанные магниевые соли карбоновых и галогеноводородных кислот, из которых в кислой среде выделяют соответствующие карбоновые кислоты:
150
|
|
|
|
CH3 |
|
Br |
+ Mg |
|
|
|
CH3 |
|
Mg |
|
Br |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
бромметан |
|
|
|
|
|
метилмагнийбромид |
|
|
|
||||||||
CH3 |
|
Mg |
|
Br + CO2 |
|
CH3 |
|
COOMgBr |
|
|
|
HCl |
CH3 |
|
C |
O |
|||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
- MgBrCl |
|
OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
смешанная магниевая соль |
этановая кислота |
||||||||||||
|
|
|
|
|
|
|
этановой и бромоводородной кислот |
|
|
|
|
||||||||||
В промышленности насыщенные карбоновые кислоты получают следующими методами:
Окисление алканов. При окислении алканов кислородом воздуха при высокой температуре в присутствии катализаторов образуется смесь карбоновых кислот. Реакция сопровождается разрывом углерод-углеродных связей (см. раздел «Алканы»).
Из алкенов.
Гидрокарбоксилирование. При взаимодействии с оксидом углерода (ІІ) и водой в присутствии кислотного катализатора при температуре 300 - 400 оС и давлении 200-500 атм. алкены образуют карбоновые кислоты как нормального, так и изостроения:
CH2 = CH2 + CO + H2O |
|
H |
+ |
|
CH3 |
|
CH2 |
|
|
|
O |
|
|
||||||||||
|
|
|
|
C |
|
|
|
|
|||||||||||||||
|
|
|
|
|
OH |
||||||||||||||||||
|
t ; p |
|
|
|
|||||||||||||||||||
|
этен |
|
|
|
|
|
|
пропановая кислота |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
2 CH3 |
|
CH = CH2 |
+ 2 CO + |
2 H2O |
|
|
H+ |
|
|
|
|
|
|||||||||||
|
|
t ; p |
|
|
O |
||||||||||||||||||
|
|
|
пропен |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
CH3 |
|
CH2 |
|
CH2 |
|
C |
OH |
+ |
|
|
CH3 |
|
CH |
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
бутановая кислота |
|
|
|
|
|
|
|
2-метилпропановая кислота |
|||||||||||
Оксосинтез и последующее окисление. При присоединении к алкенам оксида углерода (ІІ) и водорода при температуре 100 - 200 оС, давлении 100 - 200 атм в присутствии кобальтового или никелевого катализаторов получают линейные и разветвлѐнные альдегиды, которые окисляют в соответствующие кислоты:
CH2 = CH2 + CO + H2 |
|
|
кат. |
CH3 |
|
CH2 |
C |
O [O] |
|
|
CH3 |
|
|
|
CH2 |
C |
O |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
t ; p |
|
H |
|
|
|
|
|
|
OH |
|||||||||||||||||||||||||
|
этен |
|
|
|
|
|
|
|
|
пропаналь |
|
|
|
|
|
|
|
|
|
пропановая кислота |
||||||||||||||||
2 CH3 |
|
CH = CH2 |
+ |
|
|
2 CO + |
2 H2 |
|
кат. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
t ; p |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
пропен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
CH3 |
|
|
CH2 |
|
|
CH2 |
C |
H |
+ |
|
CH3 |
|
CH |
|
|
|
CH3 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
бутаналь |
|
|
|
|
2-метилпропаналь |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
[O] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[O] |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОH |
|
|
|
|
||||||||||
|
|
|
|
CH3 |
|
|
CH2 |
|
|
CH2 |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
ОH |
|
|
|
CH |
3 |
|
CH |
|
|
|
CH |
3 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
бутановая кислота |
|
|
|
|
|
|
|
2-метилпропановая кислота |
|
||||||||||||||||||||||
151
6.2.3. ХИМИЧЕСКИЕ СВОЙСТВА НАСЫЩЕННЫХ МОНОКАРБОНОВЫХ КИСЛОТ
Химические свойства карбоновых кислот определяются в основном наличием в их молекуле карбоксильной группы.
Образование солей. При взаимодействии со щелочами карбоновые кислоты превращаются в соли:
CH3 |
|
C |
O |
+ NaOH |
|
CH3 |
|
C |
O |
|
+ H2O |
||
|
OH |
|
|
|
|
|
+ |
||||||
|
|
|
|
|
|
||||||||
|
|
O Na |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||
этановая кислота |
|
|
ацетат натрия |
|
|
||||||||
Соли образуются также при действии на карбоновые кислоты активных металлов, основных оксидов, гидрокарбонатов и карбонатов щелочных металлов.
Свойства солей карбоновых кислот уже рассматривались ранее:
Щелочное плавление солей карбоновых кислот с образованием алканов
(см. раздел «Алканы»):
|
|
|
|
O |
+ |
|
t |
|||
|
|
|
|
|
|
|
|
|
|
|
CH3 CH2 C ONa |
NaOH |
|
CH3 CH3 + Na2CO3 |
|||||||
|
|
|||||||||
пропионат натрия |
|
|
|
этан |
||||||
Электролиз водных растворов солей карбоновых кислот с образованием алканов (см. раздел «Алканы»):
|
|
|
|
|
|
электролиз |
|
|
|
|
|
|
|
|
|
|
|
+ 2NaOH + H2 |
|
|
|||
2CH3COONa + 2H2O |
|
|
|
CH3 |
|
CH3 |
+ 2 CO2 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|||||||||||||||||||
ацетат натрия |
|
|
|
|
|
|
|
этан |
|
|
|
|
|
|
|
||||||||
Пиролиз |
|
кальциевых |
или бариевых солей карбоновых кислот с |
||||||||||||||||||||
образованием альдегидов и кетонов (см. раздел «Альдегиды и кетоны»): |
|||||||||||||||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
||
CH3 |
|
|
C |
O |
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
Ва |
300 C |
CH3 |
|
C |
|
|
CH3 |
+ Ва CO3 |
||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
|
|
|
|
|
пропанон |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
ацетат барияO |
|
|
|
|
(диметилкетон, ацетон) |
|
|
|
|
||||||||||||||
Взаимодействие солей карбоновых кислот с галогеналканами с
образованием сложных эфиров (см. раздел «Галогеналканы»):
|
|
|
O |
+ C2H5Br |
|
|
|
|
O |
+ NaBr |
||
CH3 |
|
C |
O Na |
|
CH3 |
|
C |
O |
|
C2H5 |
||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||
ацетат натрия |
бромэтан |
|
этилацетат |
|
||||||||
Образование галогенангидридов кислот. При взаимодействии карбоновых кислот с галогенидами фосфора (III) или фосфора (V), а также с тионилхлоридом SOCl2 и сульфурилхлоридом SO2Cl2 в мягких условиях образуются галогенангидриды карбоновых кислот:
152
