
02.Углеводороды
.pdf
Выводы:
1.Индуктивный эффект проявляется лишь при наличии в молекуле атомов с различной электроотрицательностью.
2.Индуктивный эффект распространяется только через -связи.
3.Индуктивный эффект затухает в цепи через 3 – 4 -связи.
=============================================================
2.2. АЛКЕНЫ
=============================================================
Алкены – это углеводороды алифатического ряда, в молекулах которых содержится одна двойная связь.
Их еще называют этиленовыми углеводородами или олефинами.
2.2.1. ГОМОЛОГИЧЕСКИЙ РЯД, НОМЕНКЛАТУРА, ИЗОМЕРИЯ АЛКЕНОВ
Алкены имеют общую формулу СnH2n. Они образуют гомологический ряд, родоначальником которого является этилен (таблица 2.2).
Таблица 2.2
Первые члены гомологического ряда алкенов
Молекулярная |
|
|
Структурная |
Название |
|||
формула |
|
|
|
формула |
|||
|
|
|
|
||||
|
|
|
|
||||
С2Н4 |
СH2 |
= CH2 |
Этен (этилен) |
||||
С3Н6 |
CH3 |
– CH = CH2 |
Пропен (пропилен) |
||||
С4Н8 |
CH3 |
– CH2 – CH = CH2 |
Бутен –1 |
||||
|
CH3 |
– CH = CH – CH3 |
Бутен –2 |
||||
|
CH3 |
|
C |
|
CH2 |
2–Метилпропен |
|
|
|
||||||
|
|
|
|||||
|
|
||||||
|
|
|
|
|
|||
|
|
|
CH3 |
|
|||
Согласно правилам заместительной номенклатуры ИЮПАК названия алкенов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ен с указанием положения двойной связи в цепи углеродных атомов. Например: этен, пропен, бутен-1 и т.д. (см. табл. 2.2).
Правила построения названий алкенов по заместительной номенклатуре:
1.Выбирают самую длинную углеродную цепь, включающую двойную связь (главная углеродная цепь).
2.Углеродные атомы главной цепи нумеруют с того конца цепи, к которому ближе расположена двойная связь.
3.Составляют название алкена, перечисляя вначале, как и в алканах, в алфавитном порядке углеводородные заместители с указанием их положения в главной цепи, затем называют углеводород, которому соответствует главная
28

углеродная цепь и, наконец, после суффикса -ен через дефис ставят цифру, указывающую положение двойной связи (номер первого из двух углеродных атомов, образующих двойную связь). Например:
2 |
|
|
|
3 |
4 |
|
5 |
1 |
2 |
|
3 |
|
4 |
CH3 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
CH3 |
|
CH2 |
|
C |
|
|
|
CH2 |
|
|
CH |
|
CH3 |
CH3 |
|
CH |
|
|
|
CH |
|
C |
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
1CH2 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
5CH2 |
||||||||||||
|
|
|
|
|
|
4,4-диметилгексен-2 |
|
CH3 |
||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
4-метил-2-этилпентен-1 |
|
|
|
|
|
|
|
|||||||||||||||||||
Названия одновалентных углеводородных радикалов, образованных из алкенов, получают добавлением к названиям алкенов суффикса -ил, например:
|
|
|
3 |
2 |
1 |
3 |
2 |
|
1 |
|||||||
CH2 |
|
CH |
|
CH3 |
|
CH |
|
CH |
|
CH2 |
|
|
|
CH |
|
CH2 |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|||||||||||||
этенил |
|
|
пропен-1-ил |
|
пропен-2-ил |
|
||||||||||
Некоторые радикалы имеют также тривиальные названия, например:
CH2 |
|
CH |
|
CH2 |
|
|
CH |
|
CH2 |
|
|
|
|||||||
|
|
|
|
|
|||||
|
|
|
|
||||||
винил |
|
|
|
|
аллил |
||||
Для алкенов характерна структурная и геометрическая изомерия. Структурная изомерия алкенов может быть обусловлена разной
последовательностью связывания атомов углерода в молекуле (изомерия цепи) как в бутене-1 и 2-метилпропене, или разным положением двойной связи при одном и том же углеродном скелете (изомерия положения двойной связи) как в бутене-1 и бутене-2.
Кроме того, в ряду алкенов имеет место геометрическая, или так называемая цис–транс–изомерия, что обусловлено различным расположением атомов или групп в пространстве относительно двойной связи. Например, бутен-2 может существовать в виде двух пространственных изомеров:
CH3 |
|
CH3 |
CH3 |
|
H |
|
C |
|
|
C |
C |
|
C |
|
|
|
||||
|
|
|
||||
H |
|
H |
H |
|
CH3 |
|
цис-бутен-2 |
транс-бутен-2 |
|||||
2.2.2.СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ
Внебольших количествах алкены встречаются в некоторых месторождениях нефти и природного газа, откуда могут быть выделены в чистом виде. Как отмечалось ранее, алкены образуются также при крекинге высших алканов. Синтетические методы получения алкенов основаны как правило на реакциях элиминирования (отщепления).
Дегидратация предельных спиртов. При нагревании с сильными минеральными кислотами предельные спирты отщепляют молекулу воды и образуют соответствующие алкены:
|
CH2 |
|
|
CH2 |
H2SO4 |
CH2 |
|
|
CH2 |
+ |
H2O |
|
|
|
|
|
|
||||||
|
|
|
t |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
OH |
|
|
этен |
|
|
||||
|
этанол |
|
(этилен) |
|
|
||||||
29

Легче отщепляют воду вторичные и особенно третичные спирты. При этом, если атом углерода, несущий гидроксил, связан с неравноценными между собой углеродными атомами, отщепление воды происходит преимущественно таким образом, что вместе с гидроксилом уходит водород от соседнего менее гидрогенизированного атома углерода. Эта закономерность, установленная в
1875 г. русским химиком-органиком А. М. Зайцевым, получила название
правила Зайцева.
|
|
|
|
|
|
CH3 |
|
H2SO4 |
|
|
|
|
|
|
CH3 |
1 |
||||
1 |
2 |
3 |
|
|
|
4 |
4 |
|
3 |
2 |
|
|
||||||||
CH3 |
|
|
CH |
|
C |
|
|
CH3 |
|
CH3 |
|
|
CH |
|
|
C |
|
|
CH3 + H2O |
|
|
|
|
|
|
t |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
3-метилбутанол-2 |
|
|
|
|
2-метилбутен-2 |
||||||||||||||
М е х а н и з м отщепления молекулы воды от спиртов:
|
|
|
|
|
|
|
|
|
|
|
H+ + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
H2SO4 |
|
|
|
|
|
|
|
HSO |
4 |
|
|
CH3 |
|
CH3 |
|
CH3 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
CH3 |
.. |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH |
|
OH |
|
|
|
+ |
|
|
|
CH |
|
O |
|
H |
CH + HSO3O |
CH |
|
OSO H |
|
CH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
.. |
+ H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
- H2SO4 |
|
|
||||||
|
CH2 |
|
|
|
|
|
|
|
|
CH2 H |
|
CH2 |
CH2 |
CH |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
CH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH3 |
CH3 |
|
CH3 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
оксониевый катион |
карбкатион |
|
|
|
|
|
|
|
|
||||||||||||||||
Дегидрогалогенирование моногалогеналканов. При нагревании моногалогеналканов со спиртовым раствором гидроксида натрия или калия отщепляется галогеноводород и образуются алкены:
CH |
|
|
CH |
|
|
CH |
|
NaOH |
CH |
|
|
CH |
|
|
CH |
|
+ NaBr + H O |
||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
3 |
|
|
|
|
|
|
|
2 |
спирт |
|
3 |
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
H |
Br |
|
|
|
|
пропен |
|
|
|
|||||||
1-бромпропан |
|
|
|
|
|
|
(пропилен) |
|
|
|
|||||||||
Как и в случае со спиртами, порядок отщепления галогеноводорода от галогеналканов определяется правилом Зайцева, т. е. вместе с галогеном уходит атом водорода, находящийся при соседнем менее гидрогенизированном атоме углерода:
1 |
2 |
3 |
|
CH3 |
4 |
NaOH |
4 |
3 |
|
2 |
1 |
+ NaBr + H2O |
|||||||||||
|
|
||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||
CH3 |
|
CH |
|
C |
|
|
CH3 |
|
|
CH3 |
|
CH |
|
|
|
C |
|
CH3 |
|||||
|
|
|
|
C2H5OH |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Br |
|
H |
|
|
|
|
|
|
|
|
|
CH3 |
|
||||||||
2-бром-3-метилбутан |
|
|
|
|
2-метилбутен-2 |
|
|||||||||||||||||
30

Дегалогенирование дигалогеналканов. Вицинальные дигалогеналканы (с
атомами галогена у соседних атомов углерода) при действии Zn или Mg в водно-спиртовом растворе отщепляют два атома галогена, образуя алкены:
|
|
CH |
|
CH |
|
CH3 + Zn |
C2H5OH |
|
|
|
|
|
CH3 + ZnBr 2 |
|||||
CH3 |
|
|
|
|
|
CH3 |
|
CH |
|
|
CH |
|
||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
||
|
|
Br |
|
Br |
|
|
|
|
|
|
|
|
|
|
||||
|
2,3-дибромбутан |
|
|
|
|
бутен-2 |
|
|
||||||||||
Дегидрирование алканов (промышленный метод получения алкенов). При температуре 300–500 0С в присутствии катализаторов (оксид хрома (III), мелкораздробленный никель и др.) алканы отщепляют водород, образуя алкены:
CH3 |
|
CH2 |
|
CH3 |
Ni |
CH2 |
|
CH |
|
CH3 + H2 |
|
|
|
|
|
||||||
|
|
|
|
|||||||
|
пропан |
|
|
|
пропен |
|||||
Селективное гидрирование алкинов. В присутствии катализаторов с пониженной активностью (железо, частично дезактивированные Pd или Pt) алкины селективно (избирательно) присоединяют водород с образованием алкенов:
HC |
|
|
C |
|
CH3 |
H2 |
H2C |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
||||||
|
|
Pd / PbCO3 |
|
|
||||||||
|
|
|
|
|
||||||||
|
|
пропин |
|
|
|
|
|
|||||
|
|
|
|
|
|
пропен |
||||||
2.2.3. ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Реакционная способность алкенов определяется главным образом наличием в их молекуле двойной углерод-углеродной связи. Двойная связь представляет собой сочетание ковалентных σ-связи и π-связи, из которых π- связь менее прочная, чем σ-связь. Алкены довольно легко вступают в реакции присоединения (с разрывом -связи). Характерны для них также реакции окисления, восстановления и полимеризации.
2.2.3.1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Галогенирование алкенов. Алкены довольно легко присоединяют по двойной связи молекулы хлора и брома, труднее – молекулы иода. При этом образуются дигалогенопроизводные алканов, содержащие атомы галогена у соседних атомов углерода (вицинальные дигалогеналканы):
CH2 |
|
CH2 + Br2 |
|
CH2Br |
|
CH2Br |
|
|
|
||||
этен |
|
1,2-дибромэтан |
||||
В зависимости от условий проведения эта реакция может протекать по радикальному механизму (с гомолитическим разрывом связи в молекуле галогена) или по ионному механизму (с гетеролитическим разрывом связи в молекуле галогена).
31

Радикальный механизм (реакция идет при УФ – облучении):
1 |
Br |
|
Br |
|
|
h |
2 Br . |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
. |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
2 |
CH |
. . |
CH |
|
+ Br . |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
CH |
Br |
|
|
|
CH |
|
||||||||
2 |
|
2 |
|
|
|
|
|
|
2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
CH2Br + Br . |
|
3 |
CH2Br |
|
CH2 + Br2 |
|
CH2Br |
|
|
||||||||||||
|
|
|
|
||||||||||||||||
Ионный механизм (реакция идет в полярном растворителе):
1 |
|
|
|
|
|
|
|
|
|
|
|
|
полярный р-ль |
|
|
+ |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
CH2 |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
CH2 |
|
|
CH2 + |
Br |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Br |
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
-комплекс |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
2 |
CH2 |
|
|
|
|
CH2 |
+ |
|
Br |
|
|
CH2 |
|
|
|
CH2 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
Br |
|
|
||||||
Гидрогалогенирование алкенов. Алкены присоединяют по двойной связи галогеноводороды, образуя галогеналканы:
CH2 |
|
|
CH2 + HBr |
|
CH3 |
|
CH2 |
|
Br |
|
|
|
|
|
|||||
|
|
|
|
||||||
этен |
|
|
бромэтан |
||||||
Закономерность присоединения галогеноводородов и воды по двойной связи алкенов была установлена в 1869 году русским химиком В. В. Марковниковым. Согласно правилу Марковникова при присоединении к несимметричным алкенам галогеноводородов или воды, водород направляется к наиболее гидрогенизированному атому углерода, стоящему у двойной связи.
Такая направленность присоединения определяется поляризацией молекулы несимметричного алкена. Вследствие электронодонорных эффектов алкильных групп электронная плотность двойной связи смещена к более гидрогенизированному ненасыщенному атому углерода. Это определяет место присоединения протона:
|
|
+ |
- |
+ |
|
- |
|
|
|
Br |
||||
|
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
CH |
|
CH2 + |
H |
|
Br |
|
CH3 |
|
CH |
|
CH3 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||
|
|
пропен |
|
|
|
|
|
2-бромпропан |
||||||
В случае, если вместо электронодонорных алкильных групп в ненасыщенных соединениях имеют место электроноакцепторные группы, присоединение галогеноводородов или воды по двойной связи происходит против правила Марковникова:
CF3 |
- |
|
+ |
+ |
- |
|
|
|
|
|
CH2Br |
|||
|
CH |
|
|
CH2 |
+ H |
|
Br |
|
CF3 |
|
CH2 |
|
||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||
|
|
|||||||||||||
32

Гидратация алкенов. В присутствии минеральных кислот (серной, азотной, хлорной и др.) алкены присоединяют по двойной связи воду. Реакция подчиняется правилу Марковникова и приводит к образованию спиртов:
|
|
CH3 |
H + |
|
|
CH3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
CH3 |
|
C |
|
CH2 + H2O |
|
CH3 |
|
C |
|
CH3 |
||||
|
|
|||||||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||
2-метилпропен |
|
|
|
OH 2-метилпропанол-2 |
||||||||||
Гипогалогенирование алкенов. Алкены присоединяют по двойной связи гипогалогенные кислоты (HOCl, HOBr, HOI) с образованием галогенгидринов:
|
|
|
|
|
|
|
|
|
|
OH |
|
Cl |
||
|
|
|
|
|
|
|
Ni |
|
|
|
|
|||
CH3 |
|
CH |
|
|
|
CH2 + HOCl |
|
CH3 |
|
CH |
|
CH2 |
||
|
|
|
|
|
|
|
||||||||
|
|
|||||||||||||
|
пропен |
|
1-хлопропанол-2 (пропиленхлоргидрин) |
|||||||||||
Присоединение происходит по электрофильному механизму в соответствии с правилом Марковникова, т. е. положительно заряженный ион галогена направляется к более гидрогенизированному атому углерода при двойной связи.
2.2.3.2.РЕАКЦИИ ВОССТАНОВЛЕНИЯ И ОКИСЛЕНИЯ
Восстановление алкенов (гидрирование). В присутствии катализаторов
(тонокоизмельченные Pt, Pd или Ni) алкены присоединяют по двойной связи водород, образуя алканы:
|
|
|
|
|
|
|
Ni |
|
|
|
|
|
CH3 |
|
CH |
|
|
|
CH2 + H2 |
|
CH3 |
|
CH2 |
|
CH3 |
|
|
|
|
|
|
|
||||||
|
|
|||||||||||
|
пропен |
|
|
|
пропан |
|||||||
Окисляются алкены довольно легко. Направление окисления зависит от используемого окислителя и условий проведения реакции.
Окисление перманганатом калия.
1. Разбавленный раствор KMnO4 в нейтральной или слабощелочной среде окисляет алкены до двухатомных спиртов (гликолей). При этом обесцвечивается раствор KMnO4 и выпадает коричневый осадок оксида марганца (IV):
3 CH2 |
|
|
CH2 + 2KMnO4 + 4H2O |
|
3 |
CH2 |
|
CH2 + 2MnO2 + 2KOH |
|
|
|
|
|||||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|||
этен |
|
OH |
|
OH |
|||||
(этилен) |
|
этиленгликоль |
|||||||
Эта реакция открыта в 1888 году русским химиком Е.Е. Вагнером. Ее широко используют в анализе для обнаружения двойной углерод-углеродной связи.
33
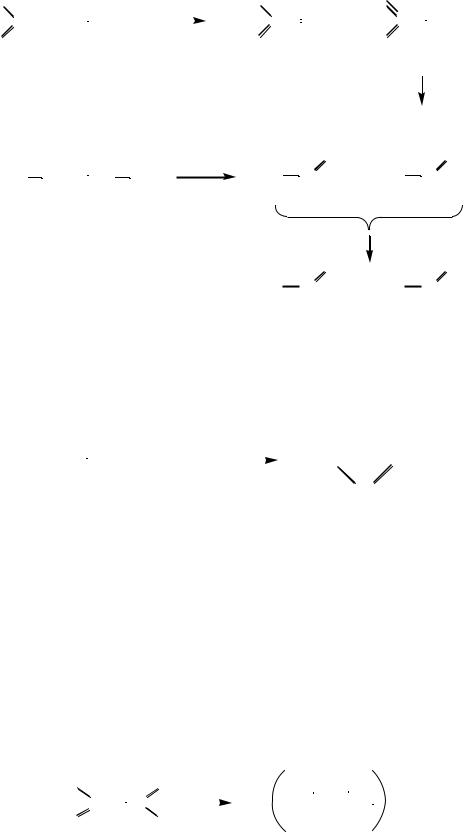
2. Концентрированный раствор KMnO4 окисляет алкены с разрывом двойной связи. В зависимости от структуры алкена в качестве продуктов окисления образуются альдегиды и кетоны, причем альдегиды окисляются дальше до карбоновых кислот:
CH |
3 |
|
|
|
|
KMnO4 |
CH |
3 |
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
C |
|
CH |
|
CH3 |
|
|
|
C |
|
O + |
C |
|
CH3 |
|
|
|
|
|
|
|
|
|||||||
CH3 |
|
|
CH3 |
H |
||||||||||
|
2-метилбутен-2 |
|
|
|
ацетон |
этаналь |
||||||||
[ O ]
CH3COOH
уксусная кислота
KMnO4
R CH  CH R'
CH R'
O O R C H + R' C
H + R' C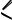 H
H
альдегиды
[ O ]
O O R C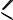 OH + R' C
OH + R' C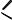 OH
OH
карбоновые кислоты
Окисление алкенов кислородом воздуха. Кислород воздуха в присутствии серебряного катализатора при нагревании окисляет алкены до эпоксидов. Эта реакция применяется в промышленности для получения этиленоксида (оксирана):
|
|
|
CH2 + O2 |
Ag , 300 |
0C |
2 CH2 |
|
CH2 |
|
2 CH2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
O |
|
|
этилен |
|
|
этиленоксид |
||||||
2.2.3.3. РЕАКЦИИ ПОЛИМЕРИЗАЦИИ
Полимеризацией называют процесс соединения друг с другом молекул низкомолекулярных веществ (мономеров) с образованием высокомолекулярных соединений (полимеров).
Полимер, состоящий из одинаковых мономеров, называется гомополимером, а полимер, в состав которого входят два и более разных мономера – сополимером. Реакция получения сополимеров называется
реакцией сополимеризации.
Полимеризация алкенов представляет собой последовательное соединение молекул алкена друг с другом вследствие разрыва двойной связи:
n . C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
C |
|
C |
|
n |
|||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мономер |
|
|
|
|
полимер |
||||||||
34

Число повторяющихся мономерных звеньев n называется степенью полимеризации. Изменяя n, из одного и того же мономера можно получать высокомолекулярные соединения (ВМС) с разными свойствами.
Мономерные звенья могут соединяться в цепь упорядоченно (по типу «голова к хвосту» или «голова к голове») или неупорядоченно:
" голова " " хвост "
Мономер: |
|
|
CH2 |
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Полимеры: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
CH2 |
|
|
CH |
|
|
CH2 |
|
|
CH |
|
CH2 |
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
" голова к хвосту " |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
CH2 |
|
|
CH |
|
|
CH |
CH2 |
|
CH2 |
|
|
CH |
CH |
CH2 |
|
" голова к голове " |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
R |
|
|
|
|
|
|
|
|||||||||||||||
|
|
CH2 |
|
|
CH |
|
CH |
CH2 |
|
CH |
|
CH2 |
|
CH2 |
|
CH |
|
неупорядоченно |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
||||||||||||||
Образующиеся при этом ВМС обладают одинаковым химическим составом, но существенно различаются по свойствам. В большинстве случаев при полимеризации присоединение звеньев идет по типу " голова к хвосту ".
Наличие в каждом звене макромолекулы асимметрического углеродного атома приводит к возможности образования двух стереорегулярных (изотактического и синдиотактического) и одного нерегулярного (атактического) изомеров.
H H H H H H
Стереорегулярный изотактический изомер: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
C |
|
|
|
C |
|
|
|
|
C |
|
|
|
C |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
R |
|
|
|
|
R |
|
|
R |
|
|
|
R |
|
|
R |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
H R H R H R |
|
|
|
|
|
||||||||||||||||||||||||||||||
Стереорегулярный синдиотактический изомер: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
C |
|
|
C |
|
|
|
C |
|
|
C |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
H |
|
|
|
|
R |
|
|
H |
|
|
|
R |
|
|
H |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
H R R H R H H |
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Атактический изомер: |
|
|
|
|
C |
|
|
|
|
C |
|
|
|
|
C |
|
|
C |
|
|
|
C |
|
|
C |
|
C |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
H |
|
|
|
|
H |
|
|
R |
|
|
|
H |
|
|
R |
|
R |
|
||||||||||||
Каждый из этих изомеров обладает определенным набором свойств. Так, изотактическим полимерам по сравнению с атактическими свойственны бóльшая прочность и более высокие температуры плавления.
35

Процесс полимеризации осуществляется в присутствии катализаторов (инициаторов) и включает три основные стадии: зарождение цепи (инициирование); рост цепи; обрыв цепи.
В зависимости от структуры исходного мономера, природы инициатора и условий реакции (температура, давление) полимеризация алкенов может происходить по радикальному или ионному (катионному) механизму. Особым типом полимеризации является полимеризация в присутствии металлоорганических соединений, получившая название „координационная полимеризация”. Она протекает в присутствии комплексных металлоорганических катализаторов (катализаторы Циглерра-Натта), позволяющих получать стереорегулярные полимеры и проводить полимеризацию при относительно низких давлении и температуре. Этот метод широко используется в промышленности для производства полиэтилена и полипропилена низкого давления.
2.2.3.4. АЛЛИЛЬНОЕ ЗАМЕЩЕНИЕ
Атомы водорода, находящиеся при атоме углерода в α-положении к двойной связи (аллильное положение), называются аллильными. При действии хлора на алкены, содержащие аллильные атомы водорода, в условиях, благоприятных для образования свободных радикалов (температура, УФоблучение и др.) происходит не присоединение галогена по месту разрыва двойной связи, а свободнорадикальное замещение галогеном аллильного атома водорода. Так, при температуре 500 – 600 °С пропен реагирует с хлором, образуя аллилхлорид:
500 - 600 |
0C |
|
|
|||||||||||||
H2C |
|
CH |
|
CH3 + Cl2 |
|
|
H2C |
|
|
|
CH |
|
CH2 |
|
|
Cl + HCl |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
||||||||||||
|
пропен |
|
|
|
|
|
аллилхлорид |
|
|
|||||||
Аллильное галогенирование включает стадию образования аллильного |
||||||||||||||||
радикала. В результате сопряжения неспаренного электрона |
с -электронами |
|||||||||||||||
двойной связи аллильные радикалы являются более усойчивыми, чем обычные
алкильные: |
. |
|
|
. |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||||
|
H2C |
|
CH |
|
CH2 |
|
CH2 |
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
||||||||
Поэтому замещение атома водорода на галоген в аллильном положении алкенов происходит легче, чем в алканах.
=============================================================
2.3. АЛКИНЫ
=============================================================
Алкины – это углеводороды алифатического ряда, содержащие одну тройную связь. Общая формула алкинов СnH2n-2.
Простейшим представителем этого ряда соединений является ацетилен С2H2, поэтому алкины называют еще ацетиленовыми углеводородами.
36

2.3.1. НОМЕНКЛАТУРА И ИЗОМЕРИЯ АЛКИНОВ
По заместительной номенклатуре ИЮПАК названия алкинов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ин с указанием положения тройной связи в цепи углеродных атомов. Нумерацию главной углеродной цепи начинают с того конца, к которому ближе расположена тройная связь.
|
|
|
|
|
|
|
|
5 |
4 |
CH3 |
3 |
2 |
|
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||
HC |
|
CH |
CH3 |
|
C |
|
CН |
CH3 |
|
CH |
|
C |
|
C |
|
CH3 |
|
|
|
|
|
|
|
|
|||||||||||
этин |
|
пропин |
|
|
4-метилпентин-2 |
|
|||||||||||
Для первого представителя гомологического ряда алкинов сохранилось тривиальное название ацетилен. Наряду с номенклатурой ИЮПАК для алкинов часто применяют рациональную номенклатуру. При этом ацетиленовые углеводороды рассматривают как производные ацетилена, в котором атомы водорода замещены на углеводородные радикалы:
CH3 |
|
C |
|
CН |
CH3 |
|
CH2 |
|
C |
|
|
|
|
|
CН |
CH3 |
|
C |
|
C |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
||||||||||||||||||
метилацетилен |
|
|
этилацетилен |
диметилацетилен |
||||||||||||||||||
Названия углеводородных радикалов алкинов образуют путем добавления к названию ацетиленового углеводорода суффикса -ил:
|
|
|
3 |
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|||
HC |
|
C |
|
CH3 |
|
C |
|
C |
|
HC |
|
|
|
C |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
этинил |
|
пропин-1-ил |
|
пропин-2-ил (пропаргил) |
||||||||||||||
Для алкинов характерна структурная изомерия, которая обусловлена различной структурой углеродной цепи (изомерия цепи) как в пентине-1 и 3- метилбутине-1, или разным положением тройной связи при одном и том же углеродном скелете (изомерия положения тройной связи) как в пентине-1 и пентине-2:
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
CH3 |
|
CH |
|
C |
|
CН |
CH3 |
|
CH2 |
|
CH2 |
|
C |
|
CН |
CH3 |
|
C |
|
|
C |
|
CH2 |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
3-метилбутин-1 |
|
|
|
пентин - 1 |
|
|
|
пентин-2 |
||||||||||||||||
2.3.2. СПОСОБЫ ПОЛУЧЕНИЯ АЛКИНОВ
Получение ацетилена из метана. При нагревании метана до 1500 °С
образуется ацетилен:
|
15000C |
2 CH4 |
HC CH + 3 H2 |
Получение ацетилена из карбида кальция. Этим способом получают основное количество ацетилена, используемого для сварочных работ.
37
