
02.Углеводороды
.pdf
CaC2 + 2 H2O |
|
HC |
|
|
CH + Ca(OH) 2 |
|
|||||
|
|
|
|||
|
Дегидрогалогенирование дигалогеналканов. Геминальные дигалоген-
алканы (атомы галогена расположены у одного и того же атома углерода) и вицинальные дигалогеналканы (атомы галогена расположены у двух соседних атомов углерода) в присутствии спиртового раствора гидроксида натрия или калия при нагревании отщепляют две молекулы галогеноводорода с образованием алкинов:
|
|
H |
Br |
|
|
|
|
|
|
|
|
|
||||
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
CH |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
Br |
|
|
|
|
|
|
|
|
|
||||
1,1-дибромпропан |
|
2 NaOH, t |
|
|
|
|
|
|||||||||
|
|
CH3 |
|
|
C |
|
|
CH + 2 NaBr + 2 H2O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Br |
|
Br |
|
C2H5OH |
пропин |
|||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3 CH CH2
1,2-дибромпропан
Алкилирование ацетилена. Алкилированием называют введение алкильной группы в молекулу органического соединения. Таким способом из ацетилена можно получить его гомологи. С этой целью вначале на ацетилен действуют амидом натрия в жидком аммиаке или алкилмагнийгалогенидами в эфире. При этом получают ацетиленид натрия или этинилмагнийгалогенид соответственно. Затем их вводят в реакцию с галогеналканом:
HC  CH
CH
HC  CH
CH
|
+ NaNH2 |
|
|
|
|
|
|
+ C2H5 Br |
|
|
|
|
|
|
|
|
||||||
|
|
|
HC |
|
|
|
CNa |
|
|
|
|
HC |
|
|
C |
|
|
|
C2H5 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
- NH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
- NaBr |
|
|
|
|
|
|
|
|
|||||
|
|
|
ацетиленид натрия |
|
|
|
|
|
|
бутин-1 |
|
|||||||||||
+ CH3MgI |
|
|
|
|
|
|
|
|
+ CH3I |
|
|
|
|
|
|
|
|
|||||
|
|
|
HC |
|
|
|
|
CMgI |
|
|
|
|
HC |
|
C |
|
|
|
|
CH3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
- CH |
|
|
|
|
|
|
|
|
- MgI2 |
|
|
|
|
|
|
|
|
||||
4 |
|
этинилмагнийиодид |
|
|
|
|
|
|
пропин |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
2.3.3. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
Реакционная способность алкинов определяется главным образом наличием в их молекуле тройной углерод-углеродной связи. Тройная связь представляет собой сочетание одной σ-связи и двух π-связей, расположенных во взаимно перпендикулярных плоскостях. Для алкинов, как и для алкенов, характерны реакции электрофильного присоединения за счет разрыва -связей. Эти реакции протекают, как правило, в две стадии. Однако алкины по сравнению с алкенами несколько менее активны в реакциях электрофильного присоединения. Причиной этого является большая электроотрицательность Sp- гибридизованных атомов углерода по сравнению с углеродами в Sp2-
38

гибридизации. Кроме того, благодаря высокой электроотрицательности атома углерода в Sp-гибридизации алкины с концевой тройной связью R C C H обладают слабой СН-кислотностью и способны замещать атом водорода на металлы и другие группы. Наконец, подобно алкенам, алкины вступают также в реакции окисления, восстановления и полимеризации.
2.3.3.1. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Галогенирование. Алкины довольно легко присоединяют по месту тройной связи хлор или бром. В реакцию может вступать одна или две молекулы галогена. В результате присоединения одной молекулы галогена образуется преимущественно транс-дигалогеналкен. Присоединение второй молекулы галогена с образованием тетрагалогеналкана идет труднее:
|
|
|
|
|
|
|
CH3 |
Br |
Br2 |
|
|
Br |
Br |
||||||||
|
|
|
|
|
|
Br2 |
CH3 |
|
|
|
|
|
|||||||||
CH3 |
|
C |
|
|
CН |
C |
|
|
|
C |
|
|
|
C |
|
|
CH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
Br |
H |
|
|
|
Br |
Br |
||||||||
|
|
|
|
|
|
|
транс-1,2-дибромпропен |
|
1,1,2,2-тетрабромпропан |
||||||||||||
Гидрогалогенирование. Алкины могут присоединять одну или две молекулы галогеноводорода (HCl, HBr). Присоединение идет по правилу Марковникова:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|||
CH3 |
|
C |
|
|
CН |
HBr |
|
|
|
|
|
HBr |
|
||||||
|
|
|
|
CH3 |
|
C |
|
CH2 |
|
CH3 |
|
C |
|
CH3 |
|||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
Br |
|
|
|
Br |
||||||
|
|
|
|
|
|
|
2-бромпропен |
|
2,2-дибромпропан |
||||||||||
Гидратация (реакция Кучерова). В присутствии солей ртути (II) (в
качестве катализатора) алкины присоединяют воду. Присоединение происходит в соответствии с правилом Марковникова. При этом из ацетилена образуется уксусный альдегид, другие алкины превращаются в кетоны:
HC  CH + HOH
CH + HOH
CH3 C CН + HOH
CН + HOH
HgSO4 |
|
|
|
CH2 |
|
|
|
CH |
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
уксусный |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
виниловый спирт |
|
альдегид |
|
|
|
|
|
|||||||||||||||||||
|
HgSO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
||
|
|
|
|
CH3 |
|
|
|
C |
|
CH2 |
|
|
|
|
|
|
C |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
.OH |
|
|
|
|
|
|
|
|
||||||||||||||
ацетон
Присоединение спиртов. Спирты присоединяются к ацетилену и его производным в присутствии алкоголятов. Это типичная реакция нуклеофильного присоединения.
39

C2H5O- Na+
HC  CH + C2H5OH
CH + C2H5OH
М е х а н и з м:
+
RONa 
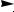 RO + Na
RO + Na
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
CH + RO |
|
HC |
|
CH |
|
OR |
||||
|
|
|
|
|
|||||||||
|
|
||||||||||||
CH2  CH OC2H5
CH OC2H5
винилэтиловый эфир
..
R OH
..
CH2 CH OR + RO
CH OR + RO
Присоединения цианистоводородной кислоты. Цианистоводородная кислота присоединяется к ацетилену и его производным в присутствии солей меди (I):
HC |
|
|
|
CH + HC |
|
|
|
N |
Cu2(CN)2 |
H2C |
|
CH |
|
C |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
нитрил акриловой кислоты (акрилонитрил)
2.3.3.2.РЕАКЦИИ ЗАМЕЩЕНИЯ
Реакции замещения характерны для ацетилена и алкинов с концевой тройной связью R C C H .
Образование ацетиленидов. Ацетилен и другие алкины с концевой тройной связью вступают в реакцию с некоторыми основаниями. При этом водород у атома углерода с тройной связью замещается на металл, в результате чего образуются соли, называемые ацетиленидами:
HC |
|
|
|
CH + |
Ag(NH3)2OH |
|
|
|
H |
|
C |
|
|
C Ag |
+ 2 NH3 + H2O |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ацетиленид серебра |
|
|||||||||||||
R |
|
|
C |
|
|
|
|
CН + |
Cu(NH3)2OH |
|
|
|
R |
|
|
C |
|
|
C Cu |
+ 2 NH3 + H2O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
замещенный ацетиленид меди |
||||||||||||||
R |
|
|
|
C |
|
|
|
|
CН + NaNH2 |
|
|
|
|
|
R |
|
|
|
C |
|
|
|
CNa |
+ NH3 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
замещенный ацетиленид натрия |
||||||||||||||
Ацетилениды меди и серебра в сухом виде взрываются от удара. Аналогично протекает реакция с магнийорганическими соединениями
(реактивами Гриньяра):
R |
|
C |
|
|
CН + C2H5 |
|
MgI |
|
R |
|
C |
|
|
|
C |
|
MgI + C2H6 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
При действии хлороводородной кислоты ацетилениды разлагаются с выделением исходного алкина. Эту реакцию применяют для выделения алкинов в чистом виде из смесей с другими углеводородами:
R |
|
C |
|
C Na + HCl |
|
R |
|
C |
|
|
|
C |
|
H + NaCl |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
40

Замещение водорода галогеном. Ацетилен и его гомологи с концевой тройной связью при действии гипогалогенитов замещают атомы водорода при углероде с тройной связью на атомы галогенов:
HC  CH
CH
+ NaClO |
+ NaClO |
|
HC |
|
CCl |
|
ClC |
|
|
CCl |
|
|
|
|
|||||
|
|
|
|
|||||
- NaOH |
- NaOH |
|||||||
|
хлорэтин |
|
дихлорэтин |
|||||
Взаимодействие с альдегидами и кетонами. Алкины с концевой тройной связью реагируют с альдегидами и кетонами в присутствии солей меди (I) с образованием алкинолов или алкиндиолов:
|
|
|
|
|
|
|
|
|
|
|
O |
OH |
|
|
|
|
|
|
O |
|
OH |
|
|
OH |
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
CH3 |
|
C |
CH3 |
|
C |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
HC |
|
|
CH |
|
|
|
|
|
|
|
CH3 |
|
CH |
|
C |
|
|
|
|
|
|
CН |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
C |
|
|
|
|
|
C |
|
CH |
|
CH3 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бутин-3-ол-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гексин-3-диол-2,5 |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
OH |
|
|
|
|
O |
|
|
|
|
OH |
|
|
OH |
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
CH |
|
|
C |
|
CH |
|
CH3 |
|
C |
|
|
CH3 |
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
HC |
|
|
CH |
|
|
|
|
|
|
|
CH3 |
|
|
|
C |
|
|
C |
|
|
CН |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
C |
|
|
C |
|
|
|
C |
|
|
C |
|
|
CH3 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2-метилбутин-3-ол-2 |
|
|
|
|
|
|
|
|
|
|
2,5-диметилгексин-3-диол-2,5 |
||||||||||||||||||||||||||||||||||||||||||
2.3.3.3. РЕАКЦИИ ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ
Окисление алкинов. Алкины, подобно алкенам, легко окисляются. При окислении перманганатом калия в щелочной среде или озоном происходит расщепление молекулы алкина по тройной связи и образуются карбоновые кислоты:
|
|
|
|
|
|
|
|
|
KMnO ; OH - |
|
|
|
|
|
|
|
|
|
CH3 |
|
CH2 |
|
C |
|
C |
|
CH3 |
4 |
|
CH3 |
|
CH2 |
|
COOH + CH3 |
|
COOH |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|||||||||||||||
|
|
пентин-2 |
|
|
пропановая кислота |
уксусная кислота |
||||||||||||
Алкины с концевой тройной связью при окислении в этих условиях образуют карбоновую кислоту и оксид углерода (IV):
|
|
|
|
|
|
|
|
|
KMnO ; OH - |
|
|
|
|
|
|
CH3 |
|
CH2 |
|
C |
|
|
|
CH |
4 |
|
CH3 |
|
CH2 |
|
COOH + CO2 |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
||||||||||
|
|
бутин-1 |
|
|
|
|
пропановая кислота |
||||||||
Под действием перманганата калия в нейтральной среде алкины окисляются до α-дикетонов:
|
|
|
|
|
|
|
|
|
KMnO4 |
|
|
O |
|
O |
|
|
|||||
R |
|
C |
|
|
|
C |
|
R' |
R |
|
|
|
|
|
|
|
|
|
R' |
||
|
|
|
|
|
|
|
|
C |
|
C |
|
||||||||||
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
H2O |
|
|
|
|||||||||||||
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
дикетон |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
41

Восстановление алкинов. В присутствии катализаторов Pd, Pt или Ni алкины восстанавливаются с образованием алканов. Присоединение водорода осуществляется ступенчато:
CH3 |
|
C |
|
CH |
H2 |
CH3 |
|
CH |
|
CH2 |
H2 |
CH3 |
|
CH2 |
|
CH3 |
|
|
кат. |
|
|
кат. |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
пропин |
|
|
|
пропен |
|
|
|
пропан |
|||||||
Образующийся в качестве промежуточного продукта алкен не удается выделить вследствие его быстрого превращения в алкан. Однако при использовании в качестве катализатора палладия, частично дезактивированного солями свинца, процесс восстановления останавливается на стадии образования алкена, причем водород присоединяется в цис-положение:
|
|
|
|
|
|
|
|
H2 |
H |
|
|
|
H |
|
CH3 |
|
C |
|
|
C |
|
CH3 |
|
C |
|
|
C |
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
Pd / PbCO |
|
|
|
|
||||||
3 |
CH3 |
|
CH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
бутин-2 |
|
цис-бутен-2 |
||||||||||
При восстановлении алкинов с помощью натрия в жидком аммиаке водород также присоединяется селективно, но с образованием транс-алкена:
|
|
|
|
|
|
|
H2 |
H |
|
CH3 |
||
CH3 |
|
C |
|
C |
|
CH3 |
|
|
C |
|
|
C |
|
|
|
Na / NH3 |
|
||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
CH3 |
|
H |
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
бутин-2 |
|
|
|
транс-бутен-2 |
||||||
2.3.3.4. ДИМЕРИЗАЦИЯ, ТРИМЕРИЗАЦИЯ И ТЕТРАМЕРИЗАЦИЯ АЛКИНОВ
В присутствии хлорида меди (I) и хлорида аммония ацетилен димеризуется с образованием винилацетилена, промежуточного продукта при производстве синтетических каучуков:
HC  CH + HC
CH + HC  CH кат.
CH кат. HC
HC  C CH CH2
C CH CH2
винилацетилен
При нагревании в присутствии активированного угля (Н.Д. Зелинский) алкины подвергаются циклотримеризации с образованием бензола и его гомологов:
3 HC  CH
CH
t |
|
|
|
|
|
; |
3 CH3 |
|
C |
|
CH |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||
|
||||||||||||
C |
|
|
||||||||||
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||
CH3
t
C
H3C CH3
ацетилен |
бензол |
пропин |
1,3,5-триметилбензол |
Ацетилен при нагревании в присутствии цианида никеля подвергается циклотетрамеризации с образованием циклооктатетраена:
42
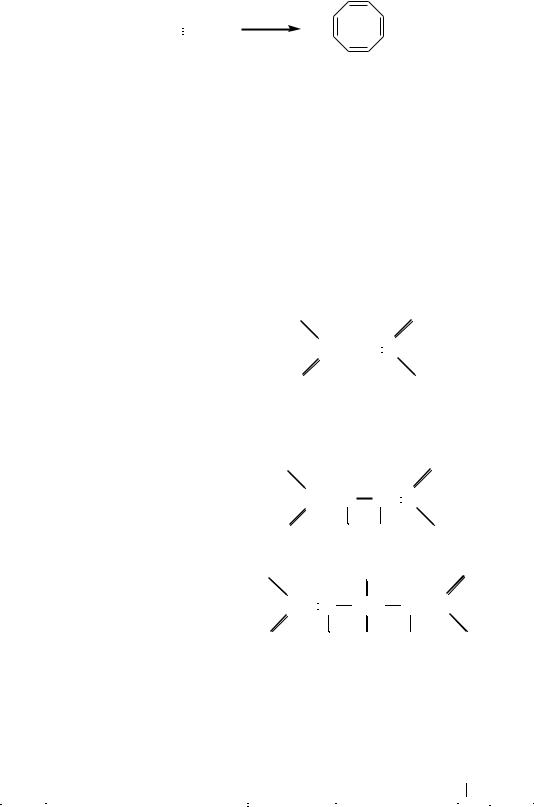
4 HC  CH
CH
Ni (CN)2
циклооктатетраен
=============================================================
2.4. АЛКАДИЕНЫ
=============================================================
Алкадиены – это углеводороды алифатического ряда, содержащие две двойные связи. Общая формула алкадиенов СnH2n-2.
По взаимному расположению двойных связей в молекуле различают три основных типа алкадиенов:
1. С к у м у л и р о в а н н ы м и двойными связями (двойные связи расположены у одного атома углерода):
C  C
C  C
C
Эти соединения еще называют алленами, по тривиальному названию простейшего представителя этого ряда – аллена CH2 = C = CH2.
2. С с о п р я ж е н н ы м и двойными связями (двойные связи разделены одной простой связью):
C  C C
C C C
C
3. С и з о л и р о в а н н ы м и двойными связями (двойные связи разделены двумя или более простыми связями):
C  C ( C)n C
C ( C)n C  C
C
Названия алкадиенов по заместительной номенклатуре ИЮПАК образуют аналогично алкенам. Наличие двух двойных связей обозначают суффиксом -диен с указанием положения каждой из них в главной углеродной цепи. Кроме того, для некоторых алкадиенов используют тривиальные и рациональные названия:
5 |
4 |
3 |
|
|
2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
3 |
4 |
|||||||||||
CH3 |
|
CH |
|
CH |
|
|
CH |
|
CH2 CH2 |
|
|
CH |
|
CH |
|
|
|
CH2 |
CH2 |
|
C |
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
пентадиен-1,3 |
|
|
бутадиен-1,3 (замест.), |
2-метилбутадиен-1,3 (замест.), |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
дивинил (рациональное) |
изопрен (тривиальное) |
||||||||||||||||
Алкадиены с кумулированными и изолированными двойными связями по химическим свойствам во многом напоминают алкены. Они легко вступают в многочисленные реакции присоединения, только в них принимает участие не одна, а две двойные связи. Алкадиены с сопряженными двойными связями
43
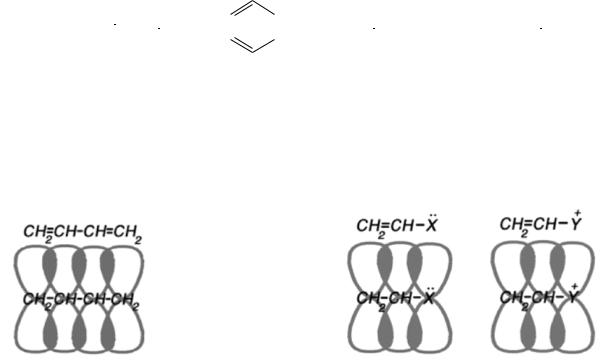
проявляют своеобразные химические свойства. Причиной этого является эффект сопряжения (мезомерный эффект), имеющий место в таких соединениях.
2.4.1. МЕЗОМЕРНЫЙ ЭФФЕКТ (ЭФФЕКТ СОПРЯЖЕНИЯ)
Мезомерным эффектом называется перераспределение электронной плотности по цепи сопряжения.
Цепью сопряжения называется система, которая состоит из чередующихся простых и кратных связей (напр.: бутадиен-1,3 ; бензол и др.) или же в которой рядом с углеродным атомом, образующим кратную связь, находится атом с неподеленной парой р-электронов (напр. хлористый винил) или атом, имеющий вакантную р-орбиталь (напр. аллильный катион).
CH2 |
|
CH |
|
CH |
|
CH2 |
|
|
|
.. |
+ |
|||||||||||||
|
|
|
|
|
|
CH2 |
|
|
CH |
|
Cl |
CH2 |
|
|
|
|
|
CH |
|
CH2 |
||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
бутадиен-1,3 |
бензол |
хлористый винил |
аллильный катион |
|||||||||||||||||||
В сопряженных системах имеет место дополнительное перекрывание π- и р- орбиталей, которое называют сопряжением. Различают π-π – сопряжение (перекрывание двух π-орбиталей) и р-π – сопряжение (перекрывание р- орбитали с π-орбиталью). Сопряжение возможно лишь в случае параллельности осей симметрии взаимодействующих орбиталей, то есть когда все атомы сопряженной системы лежат в одной плоскости.
- - сопряжение |
р- - сопряжение |
( - - взаимодействие) – |
(р- - взаимодействие) – |
перекрывание -орбиталей |
перекрывание р-орбитали заместителя с |
сопряженных двойных связей |
-орбиталью двойной связи |
В результате сопряжения образуется единая -электронная система и происходит перераспределение (делокализация) -электронной плотности. Сопряжение является для молекулы энергетически выгодным процессом. Оно сопровождается уменьшением энергии системы и приводит к повышению термодинамической устойчивости молекулы.
Молекулы соединений, имеющих цепь сопряжения, находятся в таком состоянии, которое не соответствует ни одной из классических формул. Такие молекулы надо изображать не одной, а двумя или более структурными
44
формулами, называемыми резонансными (предельными, граничными). Причем реальное состояние не соответствует ни одной из этих формул, а является промежуточным или мезомерным. То есть реальная молекула рассматривается как гибрид несуществующих резонансных структур. Взаимосвязь граничных структур изображают двухсторонней стрелкой ( ). Например, делокализацию электронной плотности в молекуле бензола можно изобразить так:
резонансные (мезомерные) структуры (мезомеры) |
реально существующая |
бензола |
молекула бензола |
Мезомеры – структуры, имеющие одинаковый состав, одинаковое строение, но различное распределение электронной плотности.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
CH2 |
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
CH2 |
|
|
|
|
|
CH |
|
|
|
|
|
|
CH |
|
|
|
|
CH2 |
|
CH2 |
|
|
|
CH |
|
|
|
CH |
|
|
|
CH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH2 |
|
|
|
|
|
CH |
|
|
|
|
|
|
CH |
|
|
|
|
|
CH2 |
|
реально существующая |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
молекула дивинила |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH2 |
|
|
|
|
|
CH |
|
|
|
|
|
|
CH |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
мезомеры дивинила
Однако изображение органических соединений, содержащих цепь сопряжения, с помощью нескольких мезомерных структур затрудняет написание химических реакций. Поэтому был принят второй способ изображения распределения электронной плотности в сопряжѐнной системе молекулы. А именно: соединение изображают одной структурной формулой, в которой изогнутой стрелкой указывают направление смещения р- и π- электронов:
|
|
|
+ |
O |
|
|
.. . |
||||
CH |
|
|
N |
|
CH |
|
|
CH |
|
F . |
|
|
|
|
|
|
|||||||
|
3 |
|
O |
|
2 |
.. |
|||||
|
|
|
|
|
|
|
|
|
|
||
нитрометан |
фтористый винил |
||||||||||
Структуры, в которых имеет место цепь сопряжения, обладают повышенной устойчивостью. Так, например, в молекуле фтористого винила эффект сопряжения приводит к дополнительному связыванию атома фтора с углеродом. Поэтому гидролиз фтористого винила происходит в значительно
45

более жестких условиях, чем гидролиз фтористого этила, в молекуле которого нет цепи сопряжения:
|
|
|
|
|
|
|
|
|
|
|
|
|
.. . |
KOH, 50 oC |
|
CH |
2 |
|
|
|
CH |
|
|
|
|
F . |
|
|
|||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
.. |
H2O |
|
||
фтористый винил |
|
||||||||||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
.. . |
KOH, 50 oC |
|
CH |
3 |
|
|
|
|
CH |
|
|
|
|
|
F . |
|
CH CH OH + KF |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
2 .. |
H2O |
3 2 |
|||||||
фтористый этил |
|
|
|||||||||||||
|
|
|
|||||||||||||
Различают положительный (+М) и отрицательный ( М) мезомерный эффект заместителя.
Положительный мезомерный эффект (+М) проявляют заместители,
подающие электронную плотность в цепь сопряжения, т.е. электронодонорные заместители.
.. |
|
CH2 CH X |
X проявляет положительный эффект сопряжения +М. |
+М эффектом обладают атомы, содержащие неподеленные пары электронов или отрицательный заряд, а также атомные группы, имеющие на первом атоме неподеленные электронные пары или отрицательный заряд:
|
|
.. |
CH3 .. |
.. |
.. |
|
.. |
.. . .. . .. . |
||||||||||||||||
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
O ; |
|
N |
; |
|
NHCH ; |
|
NH ; |
|
OCH |
; |
|
OH ; |
|
F. |
; |
|
Cl. |
; |
.. |
. |
||||
|
|
|
|
|
3 |
2 |
.. |
3 |
.. |
.. |
|
.. |
|
|
||||||||||
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Отрицательный мезомерный эффект (–М) проявляют заместители,
оттягивающие на себя электронную плотность цепи сопряжения, т. е. электроноакцепторные заместители.
CH2 |
|
|
CH |
|
Y |
Y проявляет отрицательный эффект сопряжения -М . |
|
|
|
||||
|
|
М - эффектом обладают атомные группы, в которых первый атом несет положительный заряд или связан кратной связью с более электроотрицательным атомом, чем он сам:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
+ |
|
+ |
O |
|
|
|
|
|
|
|
; |
|
O |
; |
|
O |
; |
|
O |
||||||||
OR2 |
; |
|
NR3 |
; |
|
N |
|
|
; |
|
C |
|
N ; |
C |
|
O |
|
C |
|
C |
|
C |
|||||||
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
OR' |
|
|
|
OH |
|
|
|
NH2 |
||
2.4.2. СПОСОБЫ ПОЛУЧЕНИЯ АЛКАДИЕНОВ С СОПРЯЖЕННЫМИ ДВОЙНЫМИ СВЯЗЯМИ
Наибольшее практическое значение среди алкадиенов с сопряженными двойными связями имеют: бутадиен-1,3 (дивинил); 2-метилбутадиен-1,3 (изопрен) и 2-хлорбутадиен-1,3 (хлоропрен).
2.4.2.1. ПОЛУЧЕНИЕ БУТАДИЕНА-1,3 (ДИВИНИЛА)
Каталитическое дегидрирование бутан-бутеновой фракции нефти.
Реакция протекает в присутствии смешанного алюмохромового катализатора
Cr2O3 / Al2O3:
46
CH3 |
|
|
CH2 |
|
|
CH2 |
|
|
CH3 |
|
650 |
0 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
бутан |
|
|
|
|
|
C, кат. |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
2 CH2 |
|
CH |
|
CH |
|
CH2 |
||||||
CH2 |
|
CH |
|
CH2 |
|
CH3 |
|
- 3 H2 |
||||||||||||||
|
|
|
|
|
|
|
|
бутадиен-1,3 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
бутен-1
Из этилового спирта (метод С.В. Лебедева). Этанол пропускают при
400–500 0С над катализатором MgO / ZnO и получают бутадиен с высоким выходом:
|
MgO / ZnO |
||||||||
2 C2H5OH |
|
CH2 |
|
CH |
|
CH |
|
|
CH2 + 2 H2O + H2 |
|
|
|
|
||||||
|
|
|
|
|
|||||
|
400 - 5000C |
||||||||
Процесс включает несколько стадий:
а) дегидрирование этанола с образованием этаналя:
|
|
|
|
|
|
|
|
|
|
CH3CH2OH |
|
|
|
|
|
кат. |
|
|
CH3 |
|
|
|
C |
O |
+ |
|
|
|
H2 |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
б) альдольная конденсация этаналя: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H |
|
C |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
C |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мезомерно стабилизированный анион |
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
C |
H |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
CH3 |
|
|
|
C |
|
|
+ CH2 |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH |
|
|
|
|
CH2 |
|
|
|
C |
|
|
|
|
|||||||||||||||||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ HOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
|
|
CH2 |
|
|
C |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||||||||||||
3-гидроксибутаналь (альдоль)
в) восстановление альдоля:
|
|
|
OH |
|
|
|
O |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
CH |
|
CH |
|
|
C |
|
+ H |
|
3 |
|
|
2 |
|
|||||||
|
|
|
|
|
|
|
H |
2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
3-гидроксибутаналь
г) дегидратация бутандиола-1,3:
|
|
OH |
|
OH |
|
||||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH |
|
CH2 |
|
CH2 |
|
||
|
|
|
- 2 H2O |
||||||
|
|
|
|
|
|
|
|
|
|
бутандиол-1,3
|
|
OH |
|
|
|
OH |
||
|
|
|
|
|
|
|
|
|
CH3 |
|
CH |
|
CH2 |
|
CH2 |
||
|
|
|
||||||
бутандиол-1,3
CH2  CH CH
CH CH  CH2
CH2
бутадиен-1,3
47
