
- •Вопрос № 1.Белки. Разнообразие. Функции.
- •Вопрос № 2. Методы биохимии. Электрофорез.
- •Вопорос № 3. Хроматография.
- •Аффинная хроматография, или хроматография по сродству
- •Вопрос № 4. Методы количественного определения белка в растворе.
- •Вопрос № 5. Форма белков. Молекулярная масса.
- •Вопрос № 6. Аминокислоты. Пептиды.
- •Вопрос № 7. Первичная структура.
- •Вопрос № 8. Вторичная структура.
- •Вопрос № 9. Третичная структура белка.
- •Вопрос № 10. Четвертичная структура.
- •Вопрос № 11. Физико-химические свойства белков.
- •Вопрос № 12. Денатурация
- •Вопрос № 13. Коллоидные свойства растворов белков. Осаждение
- •Вопрос № 14. Классификация белков.
- •Вопрос № 15. Простые и сложные белки. Простетическая группа.
- •Вопрос № 16. Белки и лиганды. Активный центр белка.
- •Вопрос № 17. Связывание белка и лиганда.
- •Вопрос № 18. Доменная организация белков.
- •Вопрос № 19. Функциональное значение четвертичной структуры белка. Оперативность. Преимущества олигомеров над мономерами.
- •Преимущества белков с четвертичной структурой
- •Вопрос № 20
- •Вопрос № 21
- •Вопрос № 22
- •Каталитическая специфичность
- •Вопрос № 23
- •Вопрос № 24
- •Вопрос № 25
- •Вопрос № 26
- •Вопрос № 27
- •Неконкурентное ингибирование
- •I связывается с е также не в каталитическом центре, однако не со свободным е, а с комплексом еs, т.Е. Центр, связывающий I, становится доступным для I только после того, как свяжется s.
- •Вопрос № 29
- •Вопрос № 30
- •Особенности строения и функционирования аллостерических ферментов:
- •Вопрос № 31
- •Циклический гуанозинмонофосфат и Циклический аденозинмонофосфат – циклические формы нуклеотидов (производные гтф и атф.
- •Вопрос № 32
- •Вопрос № 33
- •Вопрос № 35
- •Вопрос № 36
- •Вопрос № 37
- •Классы ферментов
- •Вопрос № 38
- •Вопрос № 39
- •Вопрос № 40
- •Вопрос № 41
- •Вопрос № 42
- •Вопрос № 43
- •Вопрос № 44
- •Вопрос № 45
- •Единицы активности
- •Вопрос № 46
Вопрос № 6. Аминокислоты. Пептиды.
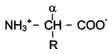
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатсякарбоксильные и аминные группы.
В составе белков – только альфа-аминокислоты виде L-изомеров. В составе белков в организме человека встречают только 20 альфа-аминокислот. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O). Это так называемые 21-я и 22-я аминокислоты.
Пролин – иминоксилота, молекула имеет циклическую форму
.

19 из 20 аминокислот содержат в альфа-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного альфа-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к альфа-углеродному атому.
По химическому строению аминокислоты можно разделить на алифатические (Гли, Ала, Вал), ароматические (Фен, Тир) и гетероциклические (Три, Гис), иминокислоты (Про). В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (Асп, Глу), амино (Лиз), серу (Цис, Мет), амидная (Асн, Глн), гидроксильная (Сер, Тре) , гуанидиновую (Арг).
Все 20 аминокислот в белках организма человека можно сгруппировать по способности их радикалов растворяться в воде. Радикалы можно выстроить в непрерывный ряд, начинающийся полностью гидрофобными и заканчивающийся сильно гидрофильными. Неполярные радикалы - гидрофобные (Фен, Три, Ала, Вал, Про, Мет), полярные незаряженные (Сер, Тре, Тир, Асн, Глн, Цис), полярные положительные (Лиз, Арг, Гис) и отрицательные (Асп, Глу).
В зависимости от того, могут ли аминокислоты синтезироваться в организме или должны поступать в составе пищи, различают:
заменимые;
незаменимые – только с пищей (лейцин, изолейцин, валин, лизин, гистидин, метионин, фенилаланин, треонин, триптофан). В детском возрасте также незаменимой является аминокислота аргинин.
Для человека Арг, Тир − полузаменимые, а для курицы − незаменимые.
Альфа-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между альфа-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды.

Пептиды — семейство веществ, молекулы которых построены из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Пептиды, содержащие более 10 аминокислот, называют "полипептиды", а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин "белок" часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Мономеры аминокислот, входящих в состав белков, называют "аминокислотные остатки". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную ?-карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название "пептидный остов". Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Эта связь образуется в результате выделения молекул воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь — пептидной связью. Она образуется только между альфа-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой. Это прочная ковалентная связь. Все атомы пептидной группировки лежат в одной плоскости. Связь C-N частично одинарная, частично двойная. Способность к образованию водородных связей.
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы.
Связь между альфа-углеродным атомом и альфа-аминогруппой или альфа-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. альфа-углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве
