
- •Передмова
- •I семестр
- •Повторення основних питань курсу хімії основної школи (4 год)
- •Урок 1
- •Урок 2
- •Урок 3
- •Тема уроку. Теорія електролітичної дисоціації. Йонні реакції
- •Урок 4
- •Тема 1. Неметалічні елементи та їхні сполуки (18 год)
- •Урок 5
- •Тема уроку. Місце неметалічних елементів у періодичній системі, особливості будови атомів. Фізичні властивості неметалів. Поширення в природі
- •Урок 6
- •Тема уроку. Алотропія. Значення озонового шару для життя організмів на Землі
- •Урок 7
- •Урок 8
- •Тема уроку. Сполуки неметалічних елементів з Гідрогеном. Гідроген хлорид. Хлоридна кислота
- •Урок 9
- •Тема уроку. Амоніак: властивості, використання. Солі амонію. Якісна реакція на йон амонію
- •Урок 10
- •Тема уроку. Одержання амоніаку в лабораторії. Загальна схема одержання амоніаку в промисловості
- •Урок 11
- •Тема уроку. Оксиди неметалічних елементів. Кислотний характер оксидів і гідратів оксидів. Кислотні дощі
- •Урок 12
- •Урок 13
- •Тема уроку. Сульфатна кислота. Фізичні й хімічні властивості
- •Урок 14
- •Урок 15
- •Тема уроку. Узагальнення й систематизація знань про неметали, їх оксиди, гідрати. Розв’язання задач
- •Урок 16
- •Тема уроку. Контрольна робота № 1 з теми «Неметали та їхні сполуки»
- •ІІ семестр
- •Тема 1. Неметалічні елементи та їхні сполуки (продовження)
- •Урок 17
- •Урок 18
- •Урок 19
- •Тема уроку. Карбонатна кислота. Карбонати й гідрогенкарбонати. Якісна реакція на карбонат-іон
- •Урок 20
- •Тема уроку. Силікатна кислота й силікати. Поняття про будівельні матеріали: скло, цемент, бетон
- •Урок 21
- •Тема уроку. Використання неметалів та їхніх сполук. Кругообіг неметалічних елементів у природі. Парниковий ефект
- •Урок 22
- •Тема уроку. Контрольна робота з теми «Неметали та їхні сполуки»
- •Тема 2. Металічні елементи та їхні сполуки (13 годин)
- •Урок 23
- •Тема уроку. Положення елементів-металів у періодичній системі, особливості будови атомів. Металічний зв’язок. Фізичні властивості металів
- •Урок 24
- •Урок 25
- •Тема уроку. Металічні елементи в природі. Загальні способи одержання металів. Виробництво чавуну та сталі
- •Урок 26
- •Урок 27
- •Урок 28
- •Урок 29
- •Тема уроку. Кальцій. Кальцій оксид і гідроксид. Солі Кальцію. Поняття про твердість води. Використання найважливіших сполук Кальцію
- •Урок 30
- •Урок 31
- •Урок 32
- •Урок 33
- •Урок 34
- •Література
138 |
Усі уроки хімії. 10 клас. Стандарт і академічний рівень |
|
|
Метал
Група 1: Са. Група 2: К. Група 3: Zn. Група 4: Na. Група 5: Mg. Група 6: Al.
Групи виконують завдання та здають на перевірку вчителю.
V. Підбиття підсумків уроку, оцінювання роботи учнів
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання. Групи обмінюються схемами-завданнями для виконання вдома.
Урок 25
Тема уроку. Металічні елементи в природі. Загальні способи одержання металів. Виробництво чавуну та сталі
Цілі уроку: ознайомити учнів з поширенням металів у природі, основними способами одержання металів, реакціями, покладеними в основу одержання металів; ознайомити з основними принципами доменноговиробництва;показативзаємозв’язок між властивостями металів, їх поширенням у природі та способами їх одержання.
Тип уроку: засвоєння нових знань.
Форми роботи: лабораторна робота, самостійна робота учнів, демонстраційний експеримент.
Обладнання: періодичнатаблицяхімічнихелементівД.І.Менделєєва, ряд активності металів.
Демонстрація 6. Показ залізорудних родовищ на географічній карті України.
Демонстрація 7. Таблиці й макети доменного виробництва. Демонстрація 8. Модель кисневого конвертера.
Лабораторнийдослід3.Ознайомлення зі зразками металевих руд.
Хід уроку
І. Організація класу
II семестр. Тема 2. Металічні елементи та їхні сполуки |
139 |
|
|
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
1. Самостійна робота
Варіант І
1.Допишіть рівняння окисно-відновних реакцій, укажіть окисник і відновник:
Li +O2 →
Al+Cl2 →
Mg +N2 →
2.Запишіть у повній та скороченій йонній формах рівняння можливих хімічних реакцій:
K +H2O →
Cu +FeCl2 →
Mg +HCl →
Li +H2SO4 →
3.Обчисліть об’єм водню (н. у.), що виділиться в процесі взаємодії 20 г кальцію та 70 г розчину хлоридної кислоти з масовою част-
кою HCl 20 %.
Варіант ІІ
1.Допишіть рівняння окисно-відновних реакцій, укажіть окисник і відновник:
Ca +Cl2 →
Al+C →
Na +S →
2.Запишіть у повній та скороченій йонній формах рівняння можливих хімічних реакцій:
Zn +MgCl2 →
Fe +HgCl2 →
Ba +HBr →
Cu +H2O →
3.Обчисліть об’єм водню (н. у.), що виділиться в процесі взаємодії 2,7 г алюмінію з 50 г розчину хлоридної кислоти з масовою часткою HCl 15 %.
2. Поширення металів у природі
Метали відрізняються активністю, що спричиняє й відмінності в їх поширенні в природі. У повітрі метали містяться в сполуках у вигляді часточок пилу, у воді — у розчинених у ній солях.
140 |
Усі уроки хімії. 10 клас. Стандарт і академічний рівень |
|
|
Найпоширеніший у земній корі метал — алюміній (5,5 %), далі йдуть: залізо (4 %), кальцій (3 %), магній (2 %). (Розглядаємо діаграму поширення хімічних елементів у природі.)
Найактивніші метали в природі існують у складі солей, метали середньої сили — у формі сульфідів та оксидів.
Благородні метали трапляються в природі й у вільному стані (самородки, «пісок»).
Лабораторний дослід 3. Ознайомлення зі зразками металевих руд Розглядаємо колекцію природних мінералів, записуємо форму-
ли й назви руд деяких металів.
Заслуховуємо повідомлення учнів про поширення металів у природі, робимо на дошці записи про природні сполуки металів із зазначенням їхніх назв.
Демонстрація 6. Показ залізорудних родовищ на географічній карті України
IІІ. Вивчення нового матеріалу
1. Загальні способи одержання металів
Оскільки більшість металів у природі міститься у вигляді сполук, то будь-який спосіб одержання металів полягає у відновленні цих металів.
1)Найактивніші (K, Ca, Mg, Na) відновлюють електролізом. Електроліз — це окисно-відновна реакція під дією постійного
електричного струму.
Електроліз розплаву можна описати такою схемою: 2NaCl = 2Na +Cl2
На катоді: Na+ +e− = Na0 — відновлення катіонів. На аноді: Cl− −e− = Cl0 — окиснення аніонів.
2)Менш активні метали відновлюють з оксидів або сульфідів (після попереднього випалу) одним зі способів:
а) коксом за високих температур:
SnO2 +C = CO2 +Sn
б) карбон(ІІ) оксидом:
Fe2O3 +3CO = 3CO2 +2Fe
в) воднем:
Fe2O3 +3H2 = 2Fe +3H2O
г) іншим, більш активним металом, наприклад алюмінієм (алюмінотермія):
3MnO2 +4Al = 2Al2O3 +3MnO
II семестр. Тема 2. Металічні елементи та їхні сполуки |
141 |
|
|
д) силіцієм (силікотермія):
2Al2O3 +3Si = 4Al+3SiO2
2. Виробництво чавуну та сталі Демонстрація 7. Схема й макет доменного виробництва
Розглядаємо основні закономірності виробництва чавуну в доменній печі.
Згоряння коксу, утворення карбон(II) оксиду: C +O2 = CO2
C +CO2 = CO
С — основний відновник у доменній печі. Відновлення заліза, виробництво чавуну:
Fe2O3 → Fe3O4 → FeO → Fe 3Fe2O3 +CO = 2Fe3O4 +CO2 Fe3O4 +CO = 3FeO +CO2
FeO +CO = Fe +CO2
Одночасно відновлюються силіцій, манган, фосфор і сірка. Вуглець і відновлені речовини розчиняються в залізі.
Видалення домішок.
Домішки видаляються з допомогою флюсів: CaCO3 = CaO +CO2
CaO +SiO2 = CaSiO3
шлак
Демонстрація 5. Ознайомлення зі зразками чавуну та сталі
Поняття про чорну металургію
|
Чавун |
|
|
|
|
Ливарний |
|
Переробний |
|
|
|
10 % від загальної маси |
|
90 % від загальної маси |
|
|
|
Для виготовлення залізних кон- |
|
Для виробництва сталі |
струкцій, машин, плит, ґрат |
|
|
|
|
|
Демонстрація 8. Модель кисневого конвертера Розглядаємо модель конвертера, пояснюємо хімічні процеси,
що відбуваються під час виплавки сталі. Окиснення домішок киснем.
Домішки: C, Si, S, Mn, P.
Реакції:
2C +O2 = 2CO↑
Si +O2 = SiO2
142 |
Усі уроки хімії. 10 клас. Стандарт і академічний рівень |
|
|
S +O2 = SO2↑ 2Mn +O2 = 2MnO
4P +5O2 = 2P2O5
Одночасно окиснюється й залізо: 2Fe +O2 = 2FeO
Окиснення домішок ферум(II) оксидом
C +2FeO = 2Fe +CO2
Si +2FeO = 2Fe +SiO2
Mn + FeO = Fe + MnO 2P +5FeO =5Fe +P2O5
Видалення шлаків
Силіцій(IV) оксид і фосфор(V) оксид видаляють шляхом додавання флюсів:
CaCO3 = CaO +CO2↑
CaO +SiO2 = CaSiO3
3CaO +P2O5 = Ca3 (PO4 )2
MnO +SiO2 = MnSiO3
Утворені в результаті цих реакцій речовини видаляються у вигляді шлаків.
Легування — це додавання до сплавів речовин (хрому, нікелю, кобальту, ванадію, вольфраму), що сприяють утворенню сплавів з потрібними складом, структурою, властивостями. У результаті легування утворюються леговані сталі.
Способи виробництва сталі
Киснево-конвертерний |
|
Електротермічний |
|
Мартенівський |
|
|
|
|
|
1. Необхідна темпера- |
1. |
Температура 2 000 °С |
1. |
Окиснення домі- |
тура — 1 700 °С — |
|
досягається дуговим |
|
шок поверхневе. |
досягається за |
|
методом. |
2. |
Температура |
рахунок окиснення |
2. |
Як сировину викорис- |
|
1 700 °С досягаєть- |
домішок. |
|
товують металобрухт. |
|
ся за рахунок спа- |
2. Економічний |
3. |
Використовують для |
|
лювання палива. |
|
|
одержання сталей, |
3. |
Одержують сталь |
|
|
легованих тугоплав- |
|
різних марок |
|
|
кими металами |
|
|
|
|
|
|
|
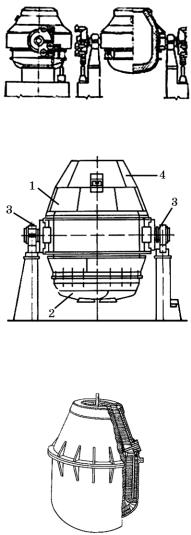
Демонстрація 8. Модель кисневого конвертера Розглядаємо модель кисневого конвертера, розповідаємо про
його роботу.
II семестр. Тема 2. Металічні елементи та їхні сполуки |
143 |
|
|
Рис. 1
Рис. 2. Кисневий конвертер:
1 — корпус; 2 — днище; 3 — опорні підшипники; 4 — шолом
Рис. 3
IV. Узагальнення, підбиття підсумків
yy Основні способи одержання металів ґрунтуються на відновленні металів з їх природних сполук.
yy Виробництво заліза, чавуну та сталі — чорна металургія, решти металів та їхніх сплавів — кольорова металургія.
