
- •Араминирование амино- и гидроксисоединений
- •Ацилирование
- •Ацилирование аминов
- •Ацилирование гидроксисоединений
- •Окисление
- •Получение альдегидов из толуола и его производных
- •Получение бензойной кислоты и ее аналогов
- •Окисление ядра ароматических углеводородов
- •Конденсация в присутствии хлорида алюминия
- •Получение бензантрона
- •Перегруппировки
Получение бензойной кислоты и ее аналогов
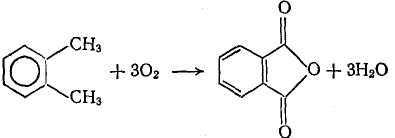
При окислении толуола и его производных хромовой кислотой, азотной кислотой, перманганатом калия и другими сильными окислителями образуются соответствующие карбоновые кислоты.
Окисление хромпиком в серной кислоте применяется в производстве о- и n-нитробензойных кислот:

Установлено, что чем ниже температура реакции, тем выше должна быть концентрация серной кислоты.
Бихроматы применяются в качестве окислителей не только в среде серной кислоты, но и в нейтральных растворах. Так, окисление толуола водным раствором бихромата при давлении 20 МПа и 305-315°С приводит к получению соли бензойной кислоты:
С6Н5СН3 + Na2Cr207 → C6H5COONa + Cr2O3 + NaOH + Н2О
2NaOH + Na2Cr2О7 → 2Na2CrO4 + Н2О
C6H5CH3 + 2Na2CrО4 → C6H5COONa + Cr2O3 + 3NaOH
Поскольку хроматы реагируют значительно медленнее, чем бихроматы, к реакционной массе целесообразно добавлять некоторое количество кислоты (например, бензойной), чтобы нейтрализовать образующуюся щелочь.
В этих же условиях окисляются до соответствующих карбоновых кислот производные толуола.
Весьма удобным (но относительно дорогим и дефицитным) окислителем является перманганат калия. Окисление обычно ведут постепенным добавлением твердого перманганата к водному раствору или суспензии окисляемого вещества. В тех случаях, когда выделяющаяся щелочь может повредить продукту (например, способствовать омылению ацильного производного), к реакционной массе добавляют сульфат магния. Таким образом, получают 4-нитро-2-ацетаминобензойную кислоту, 4-хлор-2-ацетаминобензойную кислоту и некоторые другие промежуточные продукты:

Окисление метильной группы до карбоксильной кислородом воздуха требует применения катализаторов. Окисление толуола до бензойной кислоты кислородом воздуха протекает при 140 °С и 0,3-0,4 МПа в присутствии нафтената кобальта.
Для разделения образующейся смеси продуктов реакционную массу обрабатывают раствором соды. Бензойная кислота в виде бензоата натрия переходит в водный слой и затем может быть выделена из него подкислением.
Органический слой содержит не вступивший в реакцию толуол, а также образовавшиеся в качестве побочных продуктов дифенил, бензиловый эфир бензойной кислоты и бензальдегид. Органический слой разделяют на составные части дистилляцией. Толуол и бензальдегид возвращают на окисление.
Бензойную кислоту можно получить также окислением смеси бензилхлорида и бензилидендихлорида хлорной известью.
Практическое применение получил метод производства бензойной кислоты каталитическим декарбоксилированием фталевого ангидрида:
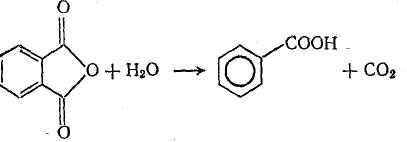
Процесс проходит при пропускании смеси паров фталевого ангидрида и воды через катализатор при 400°С. Продукт реакции улавливается водой. Выход бензойной кислоты, получаемый по этому методу, около 85% от теоретического.
Окисление ядра ароматических углеводородов
Большое значение имеют продукты, получаемые окислением ароматических углеводородов. Во многих случаях окисление это протекает в паровой фазе в присутствии катализатора. Важнейшими продуктами, получаемыми окислением ароматических углеводородов, являются малеиновый и фталевый ангидриды и антрахинон.
Малеиновый ангидрид широко используется не только как промежуточный продукт в синтезе органических красителей, но и в промышленности пластических масс и в лакокрасочной. Его получают окислением бензола воздухом в паровой фазе. Реакция протекает при высокой температуре в присутствии катализатора:
![]()
Побочные реакции:
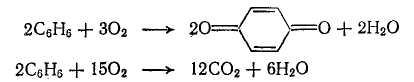
Катализатором может служить оксид ванадия (V), однако большой выход малеинового ангидрида достигается на сложных катализаторах (смеси окислов или солей ванадия, молибдена и некоторых других металлов, нанесенных на пемзу или силикагель). Выход малеинового ангидрида при окислении бензола около 60%.
Кроме того, малеиновый ангидрид образуется в качестве побочного продукта при окислении нафталина до фталевого ангидрида. Производство фталевого ангидрида окислением нафталина воздухом в присутствии ванадиевого катализатора является одним из наиболее крупнотоннажных производств анилинокрасочной промышленности. Большая часть производимого анилинокрасочной промышленностью фталевого ангидрида потребляется промышленностью высокомолекулярных соединений, где он используется в качестве пластификатора, а также для получения глифталевых смол.
Производство фталевого ангидрида складывается из следующих основных стадий : а) приготовление нафталино-воздушной смеси; б) окисление нафталина в контактном аппарате (контактирование); в) улавливание продуктов реакции; г) очистка хвостовых газов.
Приготовление нафталино-воздушной смеси. Процесс осуществляется в испарителях. Соотношение нафталина и воздуха в зависимости от режима окисления может колебаться в пределах от 1 : 19 до 1 : 15. Испарители поверхностно-пленочного типа и ленточные или спиральные.
Полученная нафталиновоздушная смесь дополнительно подогревается контактными газами в кожухотрубчатом теплообменнике до 270-290 °С, а затем поступает в контактный аппарат (конвертор).
Окисление нафталина. Процесс может проводиться в стационарном слое катализатора и в псевдоожиженном слое. Реактор для окисления нафталина в стационарном слое представляет собой кожухотрубчатый теплообменник, в трубном пространстве которого находится катализатор V2O5, а в межтрубном циркулирует расплав солей. Температура в реакторе поддерживается на уровне 410-430°С. Поскольку тепловой эффект процесса очень велик, реактор охлаждают расплавом солей.
Основным продуктом, получающимся при окислении нафталина, является фталевый ангидрид. В качестве побочных продуктов образуются нафтохиноны, малеиновый ангидрид и углекислый газ:

Процесс можно осуществлять также в псевдоожиженном (кипящем) слое. Катализатором при этом служит сульфат ванадия, нанесенный на силикагель, температура реакции 370-385 С. Реактор для проведения процесса в псевдоожиженном слое представляет собой большой цилиндрический аппарат с коническим днищем и расширенной верхней частью.
Преимущества ведения процесса в кипящем слое заключаются в большой поверхности контакта между фазами, большой скорости массо- и теплообмена и относительной легкости регулирования температуры. Реакторы для окисления нафталина в кипящем слое катализатора могут иметь очень большую производительность.
Конвертор, обеспечивающий производительность 1000 кг/ч (по нафталину) имеет высоту 7,3 м и диаметр 3,2 м.
В связи с относительной дефицитностью нафталина как сырья и доступностью о-ксилола (из нефти) многие страны начали получать фталевый ангидрид из о-ксилола.
Получение антрахинона, как и окисление нафталина, проводят в паровой фазе с использованием в качестве катализатора окислов ванадия и молибдена. Кроме того, антрацен окисляется в паровой фазе воздухом в присутствии ванадата железа, нанесенного на пемзу. Процесс ведут при 320-390 °С. Выход антрахинона достигает 96-97% от массы антрацена.

Другим приемом окисления антрацена до антрахинона является применение бихромата натрия в среде серной кислоты:

Для проведения процесса тщательно измельченный антрацен смешивают при ≈ 100°С с небольшим количеством раствора бихромата натрия. К полученной суспензии добавляют 50% серную кислоту, и остальное количество бихромата.
Для очистки антрахинона от примесей технический продукт обрабатывают концентрированной серной кислотой при 105-110 °С; при этом примеси сульфируются и затем переводятся в раствор. Антрахинон в этих условиях не сульфируется.
При получении антрахинона окислением антрацена бихроматом отходом производства является сульфат хрома, который может быть выделен и в дальнейшем использован на кожевенных заводах для дубления кожи или на текстильных фабриках в качестве протравы.
В связи с развитием техники и выпуском промышленных озонаторов все большее и большее значение в качестве окислителя начинает приобретать озон. Озон применяют не только в непосредственном производстве целевого продукта, но и для переработки промышленных стоков. Одним из серьезных препятствий к широкому применению озона является его токсичность и трудность улавливания его из отходящих газов. Токсичность озона повышается при наличии в воздухе окислов азота. Вместе они действуют в 20 раз сильнее, чем порознь. ПДК для озона 0,0001 г/м3.
РЕАКЦИИ КОНДЕНСАЦИИ
Реакции, которые приводят к усложнению углеродного скелета молекулы или к образованию гетероцикла, называют реакция ми конденсации.
Реакции конденсации могут приводить к образованию новых циклов или линейно построенных соединений.
Реакции алкилирования и ацилирования углеводородов можно рассматривать как реакции конденсации.
КОНДЕНСАЦИЯ С АЛЬДЕГИДАМИ
Наиболее широко из альдегидов применяются в реакциях конденсации формальдегид. Его обычно используют в виде 40%-го раствора, который называется формалином.
Конденсирующими средствами в этом случае обычно служат минеральные и органические кислоты. Роль кислоты заключается в том, что она превращает формальдегид в реакционноспособный гидроксиметилкатион:
СН2О + Н3О+ → +СН2ОН + Н2О
RH + +CH2OH → RCH2OH + H+
RH + RCH2OH → RCH2R + H2O
При получении дифенилметана из бензола и формалина в качестве конденсирующего средства применяют серную кислоту.
При конденсации хлорбензола с хлоралем в присутствии концентрированной серной кислоты образуется 4,4'-дихлордифенил-трихлорметилметан, который под названием ДДТ широко использовался в качестве инсектицида:

Большое практическое значение имеет получение замещенных дифенилметана из формальдегида и ароматических аминов:

Конденсация формальдегида с фенолом приводит к получению фенолоформальдегидных смол:

