
- •Араминирование амино- и гидроксисоединений
- •Ацилирование
- •Ацилирование аминов
- •Ацилирование гидроксисоединений
- •Окисление
- •Получение альдегидов из толуола и его производных
- •Получение бензойной кислоты и ее аналогов
- •Окисление ядра ароматических углеводородов
- •Конденсация в присутствии хлорида алюминия
- •Получение бензантрона
- •Перегруппировки
Ацилирование гидроксисоединений
Ацилирование ароматических гидроксисоединений проводят значительно реже, чем ацилирование аминов.
В качестве ацилирующих агентов применяют те же вещества, что и при ацилировании аминов. Поскольку реакция с гидроксисоединениями идет менее энергично, для связывания выделяющейся воды или хлористого водорода необходимо применять соответствующие реагенты. Если ацилирование проводят кислотой, для связывания выделяющейся воды применяют хлорид фосфора (III) РС13 или оксихлорид (хлорокись) фосфора POCl3. Возможно, что в присутствии этих реагентов реакция протекает через стадию образования хлорангидрида кислоты.
Обычно для ацилирования гидроксисоединений используют ангидриды и хлорангидриды кислот. При ацилировании хлорангидридами кислот для связывания выделяющегося хлористого водорода к реакционной массе добавляют едкий натр, соду или поташ. Так, фенол в бензольном растворе в присутствии избытка поташа образует с бензоилхлоридом фенилбензойный эфир:
С6Н5ОН + С6Н5СОС1 → C6H5COOC6H5 + HC1
Ацилирование фенолов уксусным ангидридом можно проводить в щелочном водном растворе при ≈ 0°С, так как уксусный ангидрид на холоду реагирует с гидроксисоединениями со значительно большей скоростью, чем с водой.
Ацилирование гидроксисоединений серной кислотой, т. е. синтез кислых эфиров серной кислоты, имеет большое значение в производстве индигозолей и кубозолей.
Окисление
К реакциям окисления в производстве промежуточных продуктов относят такие превращения органических соединений, которые связаны либо с введением в них кислорода с образованием новых кислородсодержащих заместителей, либо с отщеплением от них атомов водорода. Дать единую схему для всех реакций окисления невозможно, так как результат реакции в каждом отдельном случае зависит от природы реагентов и условий ведения процесса.
Окислителями обычно служат кислород и богатые кислородом соединения, которые в условиях реакции способны отдавать его другому соединению, а также соединения элементов с переменной валентностью. Наиболее дешевым и распространенным окислителем является воздух. В большинстве случаев окисление воздухом используется при ведении процесса в присутствии катализатора. Часто в качестве окислителей применяют гипохлорит натрия NaCIO, бихромат калия К2Сг2О7 (хромпик), оксид марганца(IV) МпО2 (пиролюзит), пермащанат калия KMnО4, пероксид водорода Н2О2, а также разбавленную азотную кислоту и некоторые нитросоединения.
Для направленного проведения процесса окисления необходимо правильно выбрать окислитель, учитывая при этом его специфические свойства и условия реакции. Во многих случаях окисление ведут в присутствии катализаторов, действие которых также специфично.
Как правило, процессы окисления предпочитают проводить либо в жидкой (водной среде), либо в газовой фазе. Органические растворители как среда для окисления применяются редко.
Получение альдегидов из толуола и его производных
Получение альдегидов ароматического ряда окислением толуола и его производных является важным методом синтеза ряда промежуточных продуктов.
Ароматические альдегиды применяют для синтеза триарилметановых красителей. Наибольшее значение среди ароматических альдегидов имеют бензальдегид, о-нитробензальдегид, о-сульфобензальдегид, о- и n-хлорбензальдегид, м-гидроксибензальдегид и др.
Для окисления метильной группы до альдегидной применяют оксид марганца (IV). Процесс ведут в серной кислоте. В случаях, когда оксид марганца(IV) берут в избытке, используют разбавленную серную кислоту, если оксид марганца (IV) взят в стехио-метрическом соотношении, применяют избыток концентрированной серной кислоты:
C6H5CH3 + 2MnO2 + 2H2SO4 → C6H5CHO + 2MnSO4 + ЗН2О
Если процесс вести при температуре не выше 40°С, то в результате реакции образуется альдегид. Если же температуру реакции поднять до 60—70 °С, то основным продуктом будет бензойная кислота.
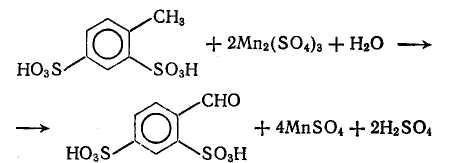
В качестве окислителей можно использовать соли марганца (III). Так, при окислении толуол-2,4-дисульфокислоты с помощью Mn2(SO4)3 в концентрированной серной кислоте при 60-120 °С получают соответствующий альдегид:
Бензальдегид и его производные можно получить из бензилхлорида и его замещенных окислением бихроматом в щелочной среде:
ЗС6Н5СН2С1 + К2Сг2О7 + NaOH → ЗС6Н5СНО + Сг2О3 + 2Н2О + 3NaCl
При окислении толуола воздухом в жидкой фазе образуется смесь продуктов, главным из которых является бензойная кислота. Бензальдегид образуется при этом в относительно небольших количествах.
Окисление толуола воздухом до бензальдегида может быть осуществлено в газовой фазе. Смесь паров толуола и воздуха пропускают над катализатором (смесь окислов урана, молибдена и меди) при 475-500°С. Выход бензальдегида достигает 85—90%.
