
- •Араминирование амино- и гидроксисоединений
- •Ацилирование
- •Ацилирование аминов
- •Ацилирование гидроксисоединений
- •Окисление
- •Получение альдегидов из толуола и его производных
- •Получение бензойной кислоты и ее аналогов
- •Окисление ядра ароматических углеводородов
- •Конденсация в присутствии хлорида алюминия
- •Получение бензантрона
- •Перегруппировки
Конденсация в присутствии хлорида алюминия
Реакция Фриделя — Крафтса является реакцией электрофильного замещения, где электрофильный реагент образуется по схеме:
RCl + AlCl3 ↔ R+ + A1C14-
RCOC1 + A1Cl3 ↔ RCO+ + A1C14-
При проведении реакции с хлоридом алюминия в качестве среды применяют избыток одного из жидких реагентов. В некоторых случаях реакцию проводят в инертном растворителе, например, в нитробензоле. Порядок смешения реагентов может быть различным в зависимости от проводимой реакции.
Большое значение имеет правильный выбор температуры реакции. Реакцию начинают при невысокой температуре и поддерживают ее путем охлаждения реакционной массы. К концу процесса температуру реакционной массы поднимают.
Наибольшее практическое значение имеют синтезы о-бензоилбензойных кислот из фталевого ангидрида и ароматических углеводородов в присутствии хлорида алюминия:

Для проведения этой реакции берут 2-2,5 моль хлорида алюминия на 1 моль фталевого ангидрида.
Так же, как бензол, с фталевым ангидридом могут взаимодействовать хлорбензол, толуол, нафталин и т. д. о-Бензоилбензойная кислота и ее замещенные служат исходными продуктами для синтеза антрахинона и его производных. Процесс можно разделить на четыре основные стадии: а) конденсация фталевого ангидрида с бензолом; б) разложение алюминиевого комплекса о-бензоилбензойной кислоты; в) замыкание антрахинонового кольца; г) выделение антрахинона.
Реакция образования алюминиевого комплекса о-бензоилбензойной кислоты заканчивается в течение 1—2 ч:

При разбавлении реакционной массы происходит разложение алюминиевого комплекса с выделением большого количества тепла, за счет которого отгоняется часть бензола с водой:
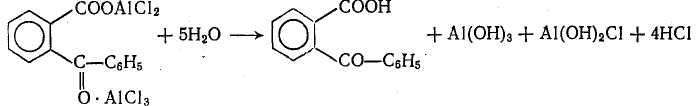
Реакция замыкания цикла (дегидратация о-бензоилбензойной кислоты) проводится в среде концентрированной серной кислоты при 100-105 °С:
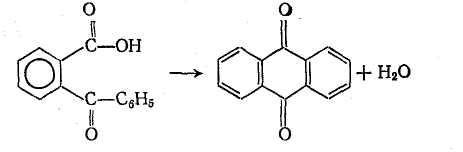
Процесс проводят при добавлении сухой бензоилбензойной кислоты к моногидрату. Конец реакции определяют путем анализа отбираемых проб на содержание бензоилбензойной кислоты.
Антрахинон выделяют при разбавлении реакционной массы водой. Суспензию фильтруют и промывают на фильтре горячей водой.
Получение бензантрона
Бензантрон получают конденсацией антрахинона с глицерином в среде серной кислоты в присутствии восстановителей (цинковая пыль, порошкообразный чугун и др.).
Как и замыкание антрахинонового цикла, образование бензантрона идет с отнятием воды. Вероятный механизм реакции заключается в следующем. Антрахинон восстанавливается цинковой пылью до антрона или таутомерного ему антранола:

Глицерин при повышенной температуре в присутствии серной кислоты теряет воду, превращаясь в акролеин:
![]()
Далее акролеин реагирует с антроном:

В промышленности бензантрон получают в одну стадию с применением в качестве восстановителя порошка железа или цинковой пыли. Конденсацию ведут, добавляя к раствору антрахинона в 87-92% серной кислоте суспензию порошка железа или цинковой пыли в глицерине. Реакция экзотермична, и для поддержания температуры на уровне 125-140 °С требуется охлаждение реактора.
По окончании конденсации реакционную массу разбавляют водой. Остатки железного порошка или цинковой пыли растворяются в разбавленной серной кислоте, а бензантрон выпадает в осадок. Его отфильтровывают на нутч-фильтре. Для очистки от смолистых примесей бензантрон нагревают с раствором едкого натра, снова фильтруют и промывают горячей водой. Выход технического бензантрона составляет ≈ 90% от теоретического. При необходимости более полной очистки бензантрона технический бензантрон сублимируют.
Реакции конденсации часто используются не только в синтезе промежуточных продуктов, но и в синтезе самих красителей особенно кубовых.
