
Физика / 5._______ __________
.pdf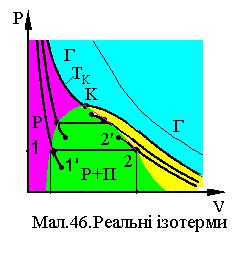
В.М.Клименко. Термодинаміка реальних середовищ |
119 |
|
|
Реальні середовища
§ 96. Реальні гази
Між молекулами будь-якого газу в реальному середовищі існують сили міжмолекулярного тяжіння й відштовхування. Вони мають електромагнітну та квантову природу. Сили тяжіння виникають на відстанях
r ≈10−9 м, а їх величина ~ r−7 . Сили
відштовхування ~ r−n , де n≥9. Гази, в яких
враховуються сили міжмолекулярної взаємодії та їх власний об'єм, називаються реальними.
Реальний газ має ізотерми представлені на діаграмі Мал.46, які суттєво відрізняються від ізотерм ідеального газу. По-перше, на відміну від ідеального, реальний газ простим зменшенням об'єму переходить у рідину, тобто один агрегатний стан переходить в інший. По-друге, реальні ізотерми мають розриви, які виглядають на діаграмах у
вигляді поличок сталого тиску і, при збільшенні температури, їх величина зменшується, а при деякій температурі TK , яка називається критичною,
поличка переходить у точку K. На Мал.46 огинаюча кінців поличок має вигляд купола. Під куполом речовина існує у вигляді рідини і насиченого пару над нею. Під ізотермою TK , ліворуч купола , речовина існує у вигляді
рідини, а праворуч, у вигляді пару. Над ізотермою TK речовина існує у
газоподібному стані, а його ізотерми співпадають з ізотермами ідеального газу. Під паром розуміють газ, який має температуру менше критичної й простим зменшенням об'єму може повністю конденсуватися у рідину. Насичений пар це пар, який знаходиться у динамічній рівновазі з рідиною, тобто з рідини випаровується стільки частинок скільки їх конденсується в рідину. Як видно з діаграми, на відміну від простого пару, насичений пар може неперервно переходити в рідину при зменшенні об'єму, залишаючись при сталому тискові.
Загалом, при підвищенні температури газу до критичної, зникають відмінності між рідиною та газом, стають рівними нулю питома теплота пароутворення λ і коефіцієнт поверхневого натягу σ. Коло критичної температури спостерігається критична опалесценція сильне розсіювання світла речовиною внаслідок великої оптичної неоднорідності, викликаної значними флуктуаціями концентрації частинок та збільшенням стислості речовини.
В.М.Клименко. Термодинаміка реальних середовищ |
120 |
|
|
При високій чистоті речовини спостерігаються стани 1 1' та 2 2'. Крива 1 1' відповідає перегрітій рідині, яка при відсутності центрів випаровування не може закипіти, а крива 2 2' відповідає переохолодженому парові, який, за відсутністю центрів конденсації, не може переходити в рідину. Центри випаровування та конденсації можуть створюватися шляхом іонізації частинок речовини елементарними частинками і тому рідина та газ у станх 1 1' та 2 2' успішно застосовується в приладах, які реєструють елементарні частинки.
§ 97. Рівняння Ван - дер – Ваальса
Створено декілька моделей реального газу, які представлені рівняннями, наприклад, Ван - дер - Ваальса, Бертло, Майєра, Вукаловича й Новікова і т. п. Нижче ми зупинимося на моделі Ван-дер-Ваальса.
Рівняння Ван - дер - Ваальса одержано введенням у рівняння Капейрона-Менделеєва поправок на додатковий внутрішній тиск, викликаний взаємодією частинок, та на власний об'єм частинок. Для моля
реального газу рівняння Ван-дер-Ваальса має вигляд: |
|
|
|
|
||||
(P + |
a |
)(V |
− b) = RT , |
(1) |
|
|
|
|
V2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
де |
V − об'єм моля |
газу, |
a |
|
− |
додатковий |
|
|
V |
|
|||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
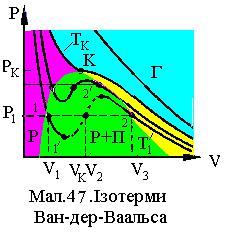
внутрішній тиск, b поправка на власний об'єм частинок, яка враховує дію сил відштовхування. Ізотерми Ван-дер-Ваальса представлені на Мал.47.
Рівняння Ван - дер - Ваальса (1) при сталому тискові є рівнянням третього ступеня відносно об'єму V і має три дійсних корені V1,V2 ,V3 , які, при збільшенні температури
зближуються і, при критичній температурі, встановляться рівними. Огинаюча крайніх коренів ізотерм Ван-дер-Ваальса утворює купол подібний куполові реальних ізотерм. Ділянка ізотерми 1 1' відповідає перегрітій рідині, а 2 2' переохолодженому парові. Відрізки, що з'єднують стани 1 та 2 відповідають поличкам реальних ізотерм. Таким чином проста модель реального газу Ван-дер-Ваальса є достатнім наближенням експериментальним даним, окрім ділянки ізотерм 1' 2', які у реальних ізотермах відсутні.
Величини а і b рівняння Ван-дер-Ваальса зв'язані з параметрами критичного стану моля газу pk, V k, Tk. Відповідні співвідношення випливають із того, що в критичній точці (рk ,Vk) рівняння Ван - дер -
В.М.Клименко. Термодинаміка реальних середовищ |
121 |
|
|
Ваальса
(P + |
a |
)(V |
−b) = RT |
(2) |
|
V2 |
|||||
k |
|
k |
|
||
|
|
|
|
|
має три рівних корені відносно V k і це рівняння може бути представлено у вигляді
|
|
P (V −V |
|
)3 |
= 0 . |
|
|
(3) |
|||||||
|
|
|
k |
k |
|
|
|
|
|
|
|
|
|
||
Запишемо (2-3) почленно відносно V. |
|
|
|
|
|
||||||||||
|
|
|
RTk |
|
|
|
|
a |
|
|
|
ab |
|
|
|
V3 |
− b + |
V2 |
+ |
|
V − |
= 0 , |
(4) |
||||||||
P |
P |
P |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
k |
|
|
|
|
k |
|
|
k |
|
|
||
V3 −3V |
2 V |
+3V V2 |
|
−V3 |
= 0. |
(5) |
|||||||||
|
|
|
k |
|
|
|
|
k |
|
k |
|
|
|||
Прирівнюючи в (4-5) коефіцієнти при відповідних степенях V, одержимо чотири рівняння
3V |
= b + |
RTk |
, |
3V2 |
= |
a |
, |
ab |
= V3 . |
(6) |
|
|
|
||||||||
k |
|
Pk |
k |
|
Pk |
|
k |
|
||
|
|
|
|
Pk |
|
|||||
Рівняння (6) можна розв'язати відносно a та b або Tk, Vk, Pk. В результаті маємо:
|
b = |
1 V |
|
, a = |
9RTk V k |
, |
|
(7) |
||||
|
|
|
||||||||||
|
|
3 |
k |
|
a |
8 |
|
8a |
|
|
||
V |
=3b , p |
|
= |
, T = |
|
. |
(8) |
|||||
|
27b2 |
|
|
|||||||||
k |
|
|
k |
|
|
k |
27Rb |
|
||||
Крім того, сталу b у (7) можна записати через ефективний діаметр d, що визначає власний об'єм моля частинок, а саме
b = |
1 |
NA 2πd3 |
, |
|
|
(9) |
||||||
|
|
|||||||||||
|
3 |
|
|
|
|
|
|
|
||||
де NA − число Авогадро, d − |
|
діаметр частинки газу. |
||||||||||
Існування додаткового тиску pд |
= |
|
a |
|
створює додаткову потенціальну |
|||||||
|
V2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||
енергію Uд рівну роботі по збільшенню об'єму газу до такої величини, коли |
||||||||||||
зникнуть сили міжмолекулярної взаємодії |
|
|
||||||||||
|
a |
|
|
|
|
a |
|
|
||||
δA = |
|
|
dV = d − |
|
|
|
|
|
(10) |
|||
V2 |
V |
|||||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
і після інтегрування одержимо |
a |
|
|
|
Uд = − |
. |
(11) |
||
|
||||
|
V |
|
||
Таким чином з урахуванням (11) внутрішня енергія моля реального газу становить

В.М.Клименко. Термодинаміка реальних середовищ |
122 |
|
|
U= |
1 |
iRT- |
a |
. |
(12) |
2 |
|
||||
|
|
V |
|
||
|
|
|
|
|
|
§ 98. Рідини
1. Рідина речовина, яка заповнює наданий їй об'єм і не має пружної форми. Рідини мають сильну міжмолекулярну взаємодію і внаслідок цього малу стислюваність. При загальній ізотропії, рідини мають ближній порядок упорядковане розташування молекул у сферах малих об'ємів, радіус яких має порядок радіусу міжмолекулярної взаємодії.
Частинки рідини на протязі часу τ, який називається часом релаксації, знаходяться "осідло" у малому об'ємі і, взаємодіючи з оточенням, здійснюють теплові коливання коло положення рівноваги, що нагадує теплові коливання частинок кристалу. Перехід частинок із цього "осідлого"
стану на відстані ~ 10−10 м відбувається миттєво у вигляді стрибків із подоланням потенціального бар'єра, що утворюється за рахунок сил тяжіння між частинками. Час релаксації зменшується при збільшенні температури рідини. При температурах близьких до критичної, рідини розглядаються як
реальні гази.
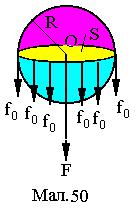
2. В середині рідини в кожний момент часу рівнодійна сил, що діють на частинку дорівнює 0 (див. Мал.48). У приповерхневому шарі рідини r, який розділяє дві фази середовища (рідина й газ) на частинку діє рівнодійна F сил тяжіння оточення, яка не дорівнює 0. Для виходу частинки за приповерхневий шар потрібно виконати роботу проти цієї сили. Ця робота йде на створення потенціальної енергії E
частинок приповерхневого шару. Енергія пропорційна числу частинок в
шарі, а тому і величині поверхні рідини dS |
|
dE = σdS, |
(1) |
де σ− коефіцієнт поверхневого натягу рідини. |
|
3. Молекули, що знаходяться на |
поверхні рідини, також мають |
міжмолекулярну взаємодію, яка характеризується силою поверхневого
натягу на контурі dl |
|
dF = σ'dl. |
(2) |
Якщо під дією цієї сили елементарний контур dl переміщується на dx, то при
цьому виконується елементарна робота |
|
δA = dFdx = σ'dldx = σ'dS, |
(3) |
де dS приріст поверхні рідини. Таким чином виникає додаткова потенціальна енергія поверхневого натягу
dE = δA, dE = σ'dS = σdS , |
(4) |
|
і звідси |
|
|
σ'= σ. |
(5) |
|
В.М.Клименко. Термодинаміка реальних середовищ |
123 |
|
|
4. Змочуванням називається явище взаємодії рідини з твердим тілом і газом на границі розділу трьох фаз, коли вільна поверхня рідини коло твердої поверхні скривлюється. Така скривлена поверхня рідини називається меніском і характеризується краєвим кутом ϑ між змоченою поверхнею твердого тіла й меніском рідини в точках їх пересічення. Мірою змочування є величина cosϑ, що визначається з рівняння рівноваги елементарного одиничного (dl=1) контуру на границі розділу фаз
Fрг cos ϑ = Fрт −Fгт , |
(6) |
або |
|
σрг cosϑ = σрт −σгт , |
(7) |
де σik − коефіцієнти поверхневого натягу на трьох поверхнях розділу фаз. Наведена на малюнку поверхня рідини має місце лише при
| σрт −σгт |≤ σрг . |
(8) |
Якщо |
|
σгт > σрт +σрг , |
(9) |
то спостерігається явище повного змочування рідина розтікається по всій поверхні твердого тіла. Сила σтг перевищує дві інші і краєвий кут ϑ = 0 . Якщо сила
σрт > σрг −σгт , |
(10) |
то спостерігається явище повного незмочування, ϑ = π.
4. Скривлення приповерхневого шару рідини призводить до появи
додаткового тиску на рідину, який визначається рівнянням Лапласа
pσ = 2σH , |
|
(11) |
||||||
де |
|
|
|
|
|
|
||
|
1 |
1 |
|
1 |
|
|||
H = |
|
+ |
|
(12) |
||||
|
|
|
||||||
2 |
|
R1 |
|
R 2 |
|
|
||
|
|
|
|
|||||
середня кривизна поверхні, R1 i |
R 2 − головні радіуси кривизни поверхні, |
||||||||
що визначаються радіусами кривизни ліній нормального |
перетину |
двох |
|||||||
взаємно перпендикулярних площин із поверхнею. |
Наприклад, |
для |
|||||||
циліндричної |
поверхні |
R1 = R, R 2 → ∞ |
і pσ = |
σ |
; a |
для |
|||
|
|||||||||
сфери R1 = R 2 |
= R і |
|
|
|
|
R |
|
||
2σ |
|
|
|
|
|
|
|||
|
|
pσ = |
. |
(13) |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
R |
|
|
|
|
|
|
Іншим шляхом вираз (13) можна одержати з таких |
|||||||||
міркувань. Розглянемо уявну рідину у формі сфери радіуса |
|||||||||
R. Проведемо |
через |
центр |
сфери |
січну |
площину |
||||
(див.Мал.50). В результаті одержимо дві півкулі з площею |
|||||||||
основ S = πR 2 |
та зовнішнім контуром контакту довжиною |
||||||||
В.М.Клименко. Термодинаміка реальних середовищ |
124 |
|
|
L = 2πR . Півкулі взаємодіють між собою лише вздовж контура |
з силою |
||||||
F = σL = 2πσR , перпендикулярною |
до S. Ця |
сила створює на |
поверхню |
||||
розділу S тиск |
|
|
|
|
|
||
p = |
F |
= |
2πσR |
= |
2σ |
, |
|
|
πR 2 |
R |
|
||||
|
S |
|
|
|
|||
що й треба було довести.
§99. Капілярні явища
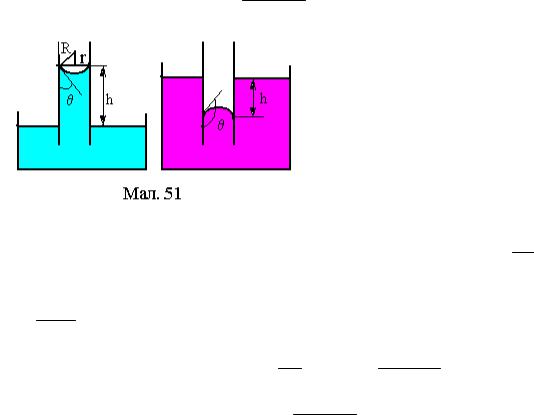
Увузьких циліндричних судинах (капілярах) радіуса r рівень рідини, що змочує (не змочує) поверхню судини вище (нижче) ніж в широкій судині, сполученій з капіляром, на величину
h = 2σcosϑ, rρg
|
(1) |
|
|
|
де |
ρ− |
густина |
рідини, |
g − |
прискорення |
сили |
тяжіння, |
ϑ− |
|
краєвий кут змочування (див.Мал.51).
Вираз (1) можна одержати з рівності сили поверхневого натягу та сили тиску рідини в капілярі так. Тиск стовпа рідини висотою h дорівнює
P = ρgh . Він врівноважується
додатковим тиском під скривленою повержнею рідини pσ = 2Rσ . Радіус R
можна виразити через кут змочування ϑ та радіус капіляра r (див.Мал.51) так
R = cosr ϑ. Рівність тисків Р та pσ дає
P = pσ hρg = 2Rσ hρg = 2σcosr ϑ
h = 2σcosϑ, rρg
що й треба було довести.
§ 100. Теплові процеси в рідині
Кипіння процес інтенсивного випаровування рідини з усього об'єму рідини всередину, утворюваних при цьому, пузирів. При кипінні тиск насичених парів в пузирі дорівнює зовнішньому тиску. Температура, при якій вирівнюються вказані тиски, називається температурою кипіння.
Об'ємне розширення рідини при нагріванні визначається рівнянням

В.М.Клименко. Термодинаміка реальних середовищ |
125 |
|
|
V(T) = V0 (1+α∆T), |
∆T = T - T0 , T0 = 273.15K , |
де V0 − об'єм рідини при T0 , α− |
коефіцієнт об'ємного розширення рідини, |
∆T − приріст температури. |
|
Випаровування процес пароутворення з вільної поверхні рідини. Насичений пар пар, що знаходиться в динамічній рівновазі з рідиною.
Для випаровування маси m рідини потрібна теплота q = λm ,
де λ − коефіцієнт пароутворення. При конденсації маси m пару виділяється
теплота
q = λm .
Атмосферний тиск сума парціальних тисків усіх газів, що створюють атмосферу. Тиск, який створює водяна пара pB − парціальний
тиск водяної пари або пружність пари. Абсолютна вологість атмосфери чисельно дорівнює масі парів води, що міститься в одиниці об'єму повітря
ρ = mV = RTPµ ,
де µ = 0.018 кг/моль молярна маса води.
Точка роси температура при якій водяні пари, що містяться в повітрі, становляться насиченими і починається їх конденсація.
Відносна вологість відношення парціального тиску (пружності) PB водяної пари, яка міститься в повітрі при даній температурі, до тиску PBH (пружності) насиченої пари при тій же температурі заданої в процентах
η = Pв 100% або η = ρ 100%,
Pвн ρн
де ρ і ρн − абсолютні вологості повітря при даній температурі і при точці роси.
§ 101. Тверде тіло
Тверде тіло тіло, яке має сталі форму й об'єм. Тверді тіла поділяються на кристалічні та аморфні.
Кристали тверді тіла, що мають у всьому об’ємі правильне періодичне розташування частинок (дальній порядок, кристалічна решітка). Монокристали кристали, що мають форму правильних багатогранників. Фізичні властивості кристалів (механічні, теплові, електричні, оптичні)
залежать від напрямку (є анізотропними). Полікристали мають дрібнозернисту структуру, створену великим числом хаотично розташованих монокристаликів. Більшість твердих тіл в природі є полікристалами. Їх фізичні властивості не залежать від напрямку і вони є ізотропними.
В.М.Клименко. Термодинаміка реальних середовищ |
126 |
|
|
Аморфні тіла не мають кристалічної решітки, вони ізотропні, являють собою переохолоджену рідину. Типовим прикладом аморфного тіла є скло.
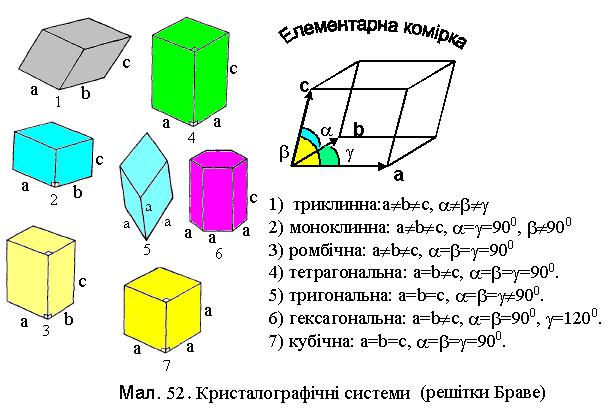
Кристалічна решітка може мати різні симетрії. Симетрія властивість решітки співпадати із самою собою при деяких просторових переміщеннях чи поворотах. Операції повороту навколо осі на кути 2π/nі, віддзеркалення від площини, трансляції (переміщення вздовж певного напрямку) та їх комбінації, що суміщають кристал сам із собою називаються операціями симетрії, а осі поворотів, напрямки трансляцій, площини та точки
віддзеркалення |
і |
їх |
комбінації називаються |
елементами |
симетрії. |
|||
r |
r r |
α β γ |
|
|
|
|
|
|
a b c |
|
|
|
|
|
|
||
|
|
Основу кристалічної структури створює елементарна комірка, |
||||||
повторення якої |
в |
трьох напрямках простору створює даний кристал |
||||||
(див.Мал.52). Така |
комірка являє собою паралелепіпед, побудований на |
|||||||
|
|
r |
r |
r |
із відповідними кутами |
α кут між векторами |
||
трьох векторах a, b, |
c |
|||||||
r |
r |
|
|
|
r |
r |
r |
r |
b, |
c , β кут між векторами a, |
c , γ кут між між векторами a, |
b . Вектори |
|||||
r |
r |
r |
|
|
|
|
|
|
a, |
b, |
c називаються періодами решітки. Кристалічна комірка, яка містить |
||||||
мінімальне число атомів, що характеризують хімічний склад кристалу, називається примітивною. Симетрія елементарної комірки задає симетрію кристалів і розподіл їх по групам і класам.
За Є. С. Федоровим в природі можливі 230 комбінацій елементів симетрії, які називають просторовими групами. Просторові групи
розподіляються на 32 класи. За формою елементарної комірки всі
В.М.Клименко. Термодинаміка реальних середовищ |
127 |
|
|
кристали розподіляються на сім кристалографічних систем (сингоній).
Сингонії за типами розподіляються на системи, представлені на Мал.52.
§ 102. Фізичні типи кристалів
В залежності від природи частинок у вузлах кристалічної гратки і характеру взаємодії між частинками розрізнюють чотири типи кристалів: іонні, атомні,
металічні й молекулярні.
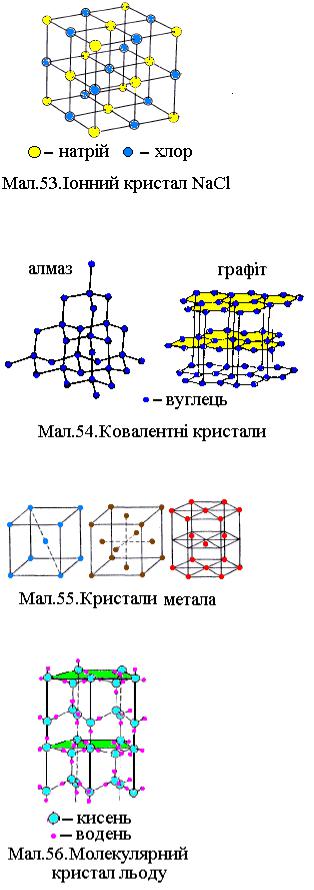
1.Іонні кристали (NaCl, KCl та інші).
Увузлах решітки розміщені йони різних
знаків заряду. Сили взаємодії електростатичні (кулонівські) сили тяжіння між різнойменно зарядженими іонами. Такий зв'язок називається гетерополярним. Примітивна решітка іонного кристала кухонної
солі представлена на Мал.53
2.Атомні кристали (алмаз, графіт, ZnS і т. п. ). У вузлах решітки розміщені нейтральні атоми. Зв'язок між атомами має квантову природу і називається гомеополярним (або ковалентним). Зв'язок здійснюється
парами валентних електронів взаємодіючих атомів, що визначає направленність їх взаємодії. Певна симетрія
3. Металічні кристали. У вузлах решітки розміщені додатні йони металів, між якими хаотично рухаються вільні валентні електрони, що відокремились від атомів при утворенні іонів. Ці електрони утримують додатні йони у вузлах. Сили зв'язку
визначаються взаємодією іонів з газом вільних електронів та квантовими обмінними силами перекриття внутрішніх електронних атомних орбіталей. Більшість металів має примітивні решітки одного з трьох типів, представлених на Мал.55: об'ємноцентровану, гранецентровану та повну гексагональну.
4. Молекулярні кристали (H2, N2, O2, CO2, H2O і т. п. ). У вузлах решітки розміщені певним чином орієнтовані молекули. Сили зв'язку між молекулами в кристалі називаються ван-дер-

В.М.Клименко. Термодинаміка реальних середовищ |
128 |
|
|
ваальсовими і вони мають ту ж природу, що і сили тяжіння між молекулами реального газу.
§ 103. Теплове розширення та теплоємність кристалів
Тверді тіла при нагріванні розширюються: лінійні розміри L
змінюються за рівнянням
L = L0 (1+α∆T), ∆T = T - T0 , T0 = 273.15K ,
де α ~ 10−6 ÷10−5 , K−1 − |
температурний |
коефіцієнт лінійного |
розширення, L0 початкова довжина при |
T = T0 , ∆T − приріст |
|
температури. Відповідно змінюється й об'єм твердого тіла
L = L0 (1+β∆T) ,
де β = 3α− температурний коефіцієнт об'ємного розширення, V0 об'єм при
T = T0 .
Тверде хімічно просте кристалічне тіло з класичної точки зору являє собою одну молекулу з N атомами, яка має 3N - 6 ≈ 3N коливальних ступенів свободи. На них приходиться теплова енергія коливального руху U = 3NkT. У зв'язку з малістю коефіцієнта теплового розширення можна вважати, що
теплоємності при сталому об'ємі і сталому тискові рівні між собою і тоді для високих температур (для більшості твердих тіл кімнатна температура є вже досить високою)
C = dUdT = 3NkT .
Для моля речовини кристалу N = NA і
Cµ = 3R ≈ 25 Дж/(моль K).
Такий результат збігається з експериментально встановленим правилом Дюлонга - Пті для високих температур кристала. Теплоємність твердих тіл,
які не є хімічно простими, дорівнює сумі атомних теплоемкостей елементів, що складають речовину. Наприклад, молярна теплоємність кухонної солі дорівнює Cµ = 2 3R ≈ 50 Дж/(моль K) . Нижче в таблиці
наведені експериментальні значення молярних теплоємностей деяких твердих тіл.
Таблиця. Теплоємність деяких твердих тіл
Речовина |
С, Дж/(моль-К) |
|
|
теорія |
дослід |
Алюміній А1 |
25 |
25,5 |
Алмаз С |
25 |
5,9 |
Берилій Be |
25 |
15,6 |
Бор В |
25 |
13,5 |
Залізо Fe |
25 |
26,8 |
Срібло Ag |
25 |
25,6 |
