
- •Теория Электролитической диссоциации
- •Сильные и слабые электролиты
- •1. Теория растворов слабых электролитов.
- •2. Теория растворов сильных электролитов.
- •Кислоты и основания
- •1. Теория Аррениуса.
- •2. Теория Бренстеда и Лоури.
- •3. Теория Льюиса.
- •Эталоны решения задач
- •В зависимости от условий ион hco3– может как отдавать протоны:
- •Таким образом, в первом случае ион hco3 является кислотой, во втором основанием, т. Е. Является амфолитом.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Шкала значений pH
- •Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
- •Кислотно-основное равновесие биологических жидкостей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Усиление и подавление гидролиза
- •Значения рН растворов гидролизующихся солей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
- •Элементы количественного анализа
- •Объемный (титриметрический) метод анализа
- •Расчеты в объемных методах анализа Закон эквивалентов
- •Методы кислотно-основного титрования
- •Титранты и их стандартизация
- •Фиксирование точки эквивалентности
- •Механизм действия индикаторов
- •Точка перехода и интервал перехода окраски индикатора
- •Правила выбора индикатора
- •1. Титрование сильной кислоты сильным основанием.
- •3. Титрование слабого основания сильной кислотой.
- •Степень окисления. Окисление и восстановление
- •Окислители и восстановители
- •Последовательность подбора коэффициентов в уравнениях окислительно-восстановительных реакций (метод электронно-ионного баланса)
- •Оксидиметрия
- •Перманганатометрия
- •Иодометрия
- •Расчет эквивалентов окислителей и восстановителей
- •Эталоны решения задач
- •Метод нейтрализации
- •Метод оксидиметрии
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
Шкала значений pH
 Таблица
3. Взаимосвязь
концентраций ионов H+
и OH.
Таблица
3. Взаимосвязь
концентраций ионов H+
и OH.
|
рН |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
[H |
100 |
10−1 |
10−2 |
10−3 |
10−4 |
10−5 |
10−6 |
10−7 |
10−8 |
10−9 |
10−10 |
10−11 |
10−12 |
10−13 |
10−14 |
|
[OH |
10−14 |
10−13 |
10−12 |
10−11 |
10−10 |
10−9 |
10−8 |
10−7 |
10−6 |
10−5 |
10−4 |
10−3 |
10−2 |
10−1 |
100 |
|
рОН |
14 |
13 |
12 |
11 |
10 |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
Зная концентрацию разбавленных растворов кислот и оснований, можно рассчитывать величины водородного показателя (рН) и гидроксидного показателя (рОН), определяя тем самым активную реакцию среды.
1. В водных растворах сильных кислот (HNO3, HCl, H2SO4 и др.):
|
|
(11) |
или
|
|
(11´) |
где С(![]() к-ты) молярная
концентрация эквивалента кислоты (для
одноосновных кислот она равна молярной
концентрации кислоты);
к-ты) молярная
концентрация эквивалента кислоты (для
одноосновных кислот она равна молярной
концентрации кислоты);
![]() кажущаяся
степень диссоциации (в долях от единицы).
кажущаяся
степень диссоциации (в долях от единицы).
В
предельно разбавленных водных растворах
сильных кислот кажущаяся степень
диссоциации![]() 1,
поэтому [Н+]
практически равняется общей концентрации
растворов этих кислот:
1,
поэтому [Н+]
практически равняется общей концентрации
растворов этих кислот:
![]()

2. В растворах слабых кислот (H2CO3, HCN, СН3СООН и др.):
|
|
(12) |
или
|
|
(12´) |
где степень диссоциации в долях от единицы;
![]() константа
диссоциации кислоты (для многоосновных
кислот, учитывают диссоциацию только
по первой ступени);
константа
диссоциации кислоты (для многоосновных
кислот, учитывают диссоциацию только
по первой ступени);
![]() ,
p
и рС(
,
p
и рС(![]() к-ты) отрицательные
десятичные логарифмы соответствующих
величин.
к-ты) отрицательные
десятичные логарифмы соответствующих
величин.
3. В водных растворах сильных оснований (NaOH, КОН, Са(ОН)2, Sr(OH)2 и др.):
|
|
(13) |
гдеС(
![]() осн) молярная
концентрация эквивалента основания
(для однокислотных оснований она равна
молярной концентрации основания);
осн) молярная
концентрация эквивалента основания
(для однокислотных оснований она равна
молярной концентрации основания);
В
предельно разбавленных водных растворах
сильных оснований кажущаяся степень
диссоциации![]() 1,
поэтому [ОН]
практически равняется общей концентрации
растворов этих щелочей:
1,
поэтому [ОН]
практически равняется общей концентрации
растворов этих щелочей:
![]()
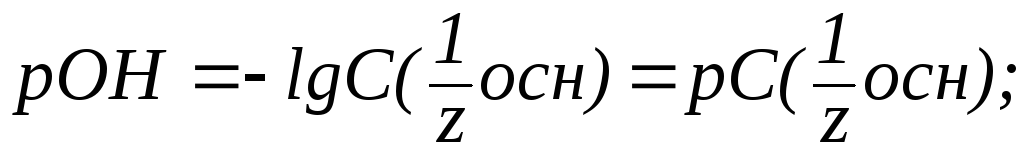

4. В растворах слабых оснований (NH3∙H2O):
|
|
(14) |
|
|
(14´) |
|
|
(14´´) |
где![]() ‑ константа
диссоциации основания.
‑ константа
диссоциации основания.
Кислотно-основное равновесие биологических жидкостей
Кислотно-основные процессы играют большую роль в жизни человека. Так, скорость ферментативных реакций в организме человека, а, следовательно, процессы обмена веществ и физиоло-гические функции в значительной степени зависят от активной кислотности среды. Таким образом, необходимым условием нормального течения жизненных процессов является постоянство рН биологических жидкостей (кислотно-основной гомеостаз). Нару-шение кислотно-основного равновесия (гомеостаза) в организме приводит к изменению рН биологических жидкостей, что, в свою очередь, нарушает нормальное течение процессов обмена веществ.
Сдвиг соотношения концентраций ионов H+ и OH в сторону увеличения активной кислотности (ацидоз) вызывает уменьшение рН (может возникать в результате нарушения выведения кислот, потери организмом значительных количеств оснований, при наличии высокой концентрации СО2 во вдыхаемом воздухе, при поносах, рвоте кишечным содержимым и другим причинам).
Сдвиг этого соотношения в сторону уменьшения активной кислотности (алкалоз) вызывает увеличение рН (может развиваться вследствие потери организмом анионов кислот или задержки щелочных катионов; при кишечной непроходимости, при нарушении выведения почками натрия, при поступлении в организм зна-чительных количеств щелочных веществ с пищей или лекар-ственными препаратами, при отравлениях и по другим причинам). Обе формы нарушения кислотно-основного равновесия в организме человека устраняют медикаментозным путем.
Таблица 4. Значения pH различных биожидкостей организма.
|
Биожидкость |
pH (в норме) |
Биожидкость |
pH (в норме) |
|
Желудочный сок |
0,9 1,1 |
Сыворотка крови |
7,40 0,05 |
|
Желчь в пузыре |
5,4 6,9 |
Спинно-мозговая жидкость |
7,40 0,05 |
|
Слюна |
6,35 6,85 | ||
|
Молоко |
6,6 6,9 |
Содержимое тонкого кишечника |
7,0 8,0 |
|
Моча |
4,8 7,5 | ||
|
Кожа |
6,2 7,5 |
Сок поджелудочной железы |
7,5 8,5 |
|
Эритроциты |
7,25 |



